纯红细胞再生障碍性(pure red cell aplasia, PRCA)是一种以严重贫血、网织红细胞减少、骨髓红系前体选择性减少甚至缺如为特征的骨髓衰竭综合征。获得性PRCA可分为原发性和继发性,均由免疫反应介导。红系定向祖细胞的数量减少和功能障碍,包括红系爆式集落形成单位(BFU-E)和红系集落形成单位(CFU-E),可能是红细胞生成减少的关键原因,尚需要进一步阐明。高通量测序对于深入研究红系祖细胞(EP)的减少或缺如的机制具有重要意义。本研究利用单细胞转录组测序(single-cell RNA sequencing, scRNA-seq)技术对PRCA患者的骨髓EP细胞进行分析,探索PRCA的发病机制,有望并指导临床治疗。该研究基于单细胞转录组测序技术揭示了获得性PRCA患者EP的异常转录组特征,发现患者EP中核糖体蛋白基因表达广泛下调、中性粒细胞颗粒相关基因表达上调,此外,免疫攻击、炎症反应、衰老、蛋白多聚泛素化也参与了疾病发生。研究还发现,BFU-E可能是红系分化障碍的关键阶段,且经治疗完全血液学缓解的患者BFU-E基因表达异常尚不能完全恢复。本研究在单细胞水平探索了PRCA的发病机制,并对临床治疗有指导意义。

该研究共纳入5例PRCA患者的骨髓标本,其中2例为新诊断的PRCA (ND-PRCA), 2例患者经西罗莫司治疗获得完全缓解(CR-PRCA),1例为难治性PRCA 患者(R-PRCA)。5例健康对照的scRNA-seq数据来自GEO数据库。经过质控分析后,该研究共纳入23186个谱系阴性(Lin-)细胞进行分析,其中包括6652个红系/巨核(E/MK)前体细胞。本研究进一步将红系/巨核前体细胞分为巨核红系祖细胞(MEP)、BFU-E、CFU-E、有核红细胞和巨核前体细胞(图1A)。研究发现,与对照组相比,ND-PRCA患者MEP、BFU-E比例没有明显降低,而CFU-E和有核红细胞比例显著降低,MK前体比例增加,这证实了PRCA红系发育受阻和MK的分化优势(图1B)。在CR-PRCA患者中,这一比例有显著改善。在1例R-PRCA患者中,CFU-E与有核红细胞的比例仍较低,与ND-PRCA相似。红系/巨核前体细胞发育轨迹图及多色流式细胞术验证结果支持这一结论(图1C, D)。
随后,研究者重点研究了各组患者EP的差异表达基因,包括MEP, BFU-E和CFU-E。结果显示,与对照组相比,ND/R-PRCA患者中核糖体蛋白基因在EP的三个阶段均普遍下调(图1E,图S1A-B),这表明核糖体生物发生缺陷可能是红细胞生成减少的关键机制。本研究结果提示,获得性PRCA与先天性PRCA (Diamond-Blackfan anemia, DBA)存在相似机制。DBA是一种由核糖体蛋白基因突变引起的核糖体病。中性粒细胞颗粒相关基因在EP的三个阶段均表达上调(图1E,图S1A-B),提示炎症反应可能损害红系分化。除了上述差异表达基因,GO富集分析还发现,与对照组相比,ND/R-PRCA患者BFU-E上调的其他差异表达基因富集在免疫应答、T/B细胞活化、细胞因子产生的阳性调控、蛋白多聚泛素化、衰老等功能(图1E)。ND/R-PRCA患者CFU-E中表达上调的差异表达基因也在免疫应答和炎症因子产生功能中富集,而编码血红蛋白的基因表达降低(图S1B)。这些结果表明,免疫反应可损伤EP,抑制红细胞生成,衰老、蛋白通过多聚泛素化降解可诱导EP凋亡。经西罗莫司治疗后,CR-PRCA患者CFU-E与ND/R-PRCA患者相比,上述基因表达异常明显改善(图S2)。然而,CR-PRCA患者BFU-E的基因表达异常仅部分改善,包括核糖体蛋白基因、中性粒细胞颗粒相关基因和血红蛋白编码基因,这表明停止治疗可能导致疾病复发 (图1F)。
研究者还比对了自己研究结果与其它相关研究在PRCA疾病的相似点和不同之处。另一份国外独立研究也应用scRNA-seq探索了先天性PRCA红细胞生成障碍的机制。Iskander等人分析了RPS-DBA和RPL-DBA基因型患者的造血细胞,发现这两种基因型细胞的发育轨迹完全不同。RPS-DBA患者的红系细胞几乎完全缺失,而RPL-DBA患者保留了部分异常的红系祖细胞和前体细胞。Rio等人的研究发现DBA患者的红系细胞存在珠蛋白链与血红素合成的失衡,导致红系分化受抑制,尤其是RPL5或RPL11缺失的患者。本研究通过scRNA-seq揭示了PRCA中EP的异常转录组特征。BFU-E的异常基因表达谱可能是红细胞生成受阻的关键因素,但其数量并未显著减少。Wang等人将BFU-E分为5群,发现DBA患者的红系细胞可能在BFU-E阶段发育受阻,患者BFU-E终末期细胞数量显著减少,转录谱异常。
本研究结果表明核糖体生物发生缺陷可能在红系分化阻滞中发挥重要作用,包括先天性和获得性PRCA。核糖体病通常表现为低增生性贫血,如Schwachman-Diamond综合征,先天性角化不良和软骨毛发发育不全。此外,骨髓增生异常综合征单纯del(5q) ,由于核糖体蛋白RPS14的单倍性不足所致,也表现为红系增生异常。但在获得性PRCA患者中p53信号通路未被激活,这与DBA不同。还需要深入研究核糖体生物发生缺陷对红细胞生成的影响。
除了炎症反应和免疫对EPs的攻击外,衰老和蛋白多聚泛素化也参与了红系分化受阻的过程。值得注意的是,通过西罗莫司治疗后的完全血液学缓解并不能完全纠正BFU-E的基因表达异常。本研究不仅更新了对PRCA发病机制的认识,还指导了PRCA的治疗策略。
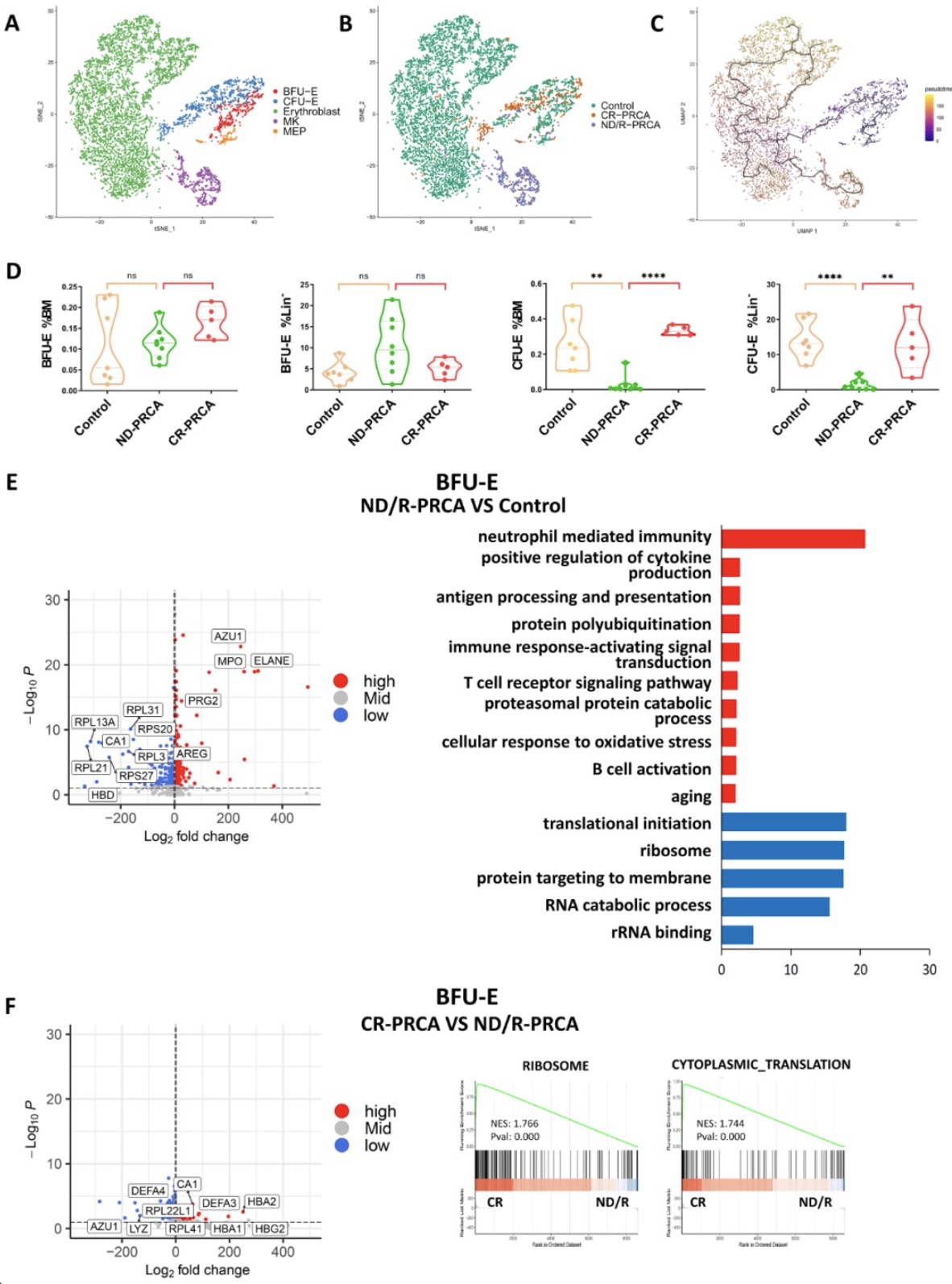
图1. PRCA患者与对照组红系/巨核系(E/MK)前体细胞转录组图谱及各组BFU-E差异表达基因分析
(图源:Yumei Liu. et al., Genes & Diseases, 2023)
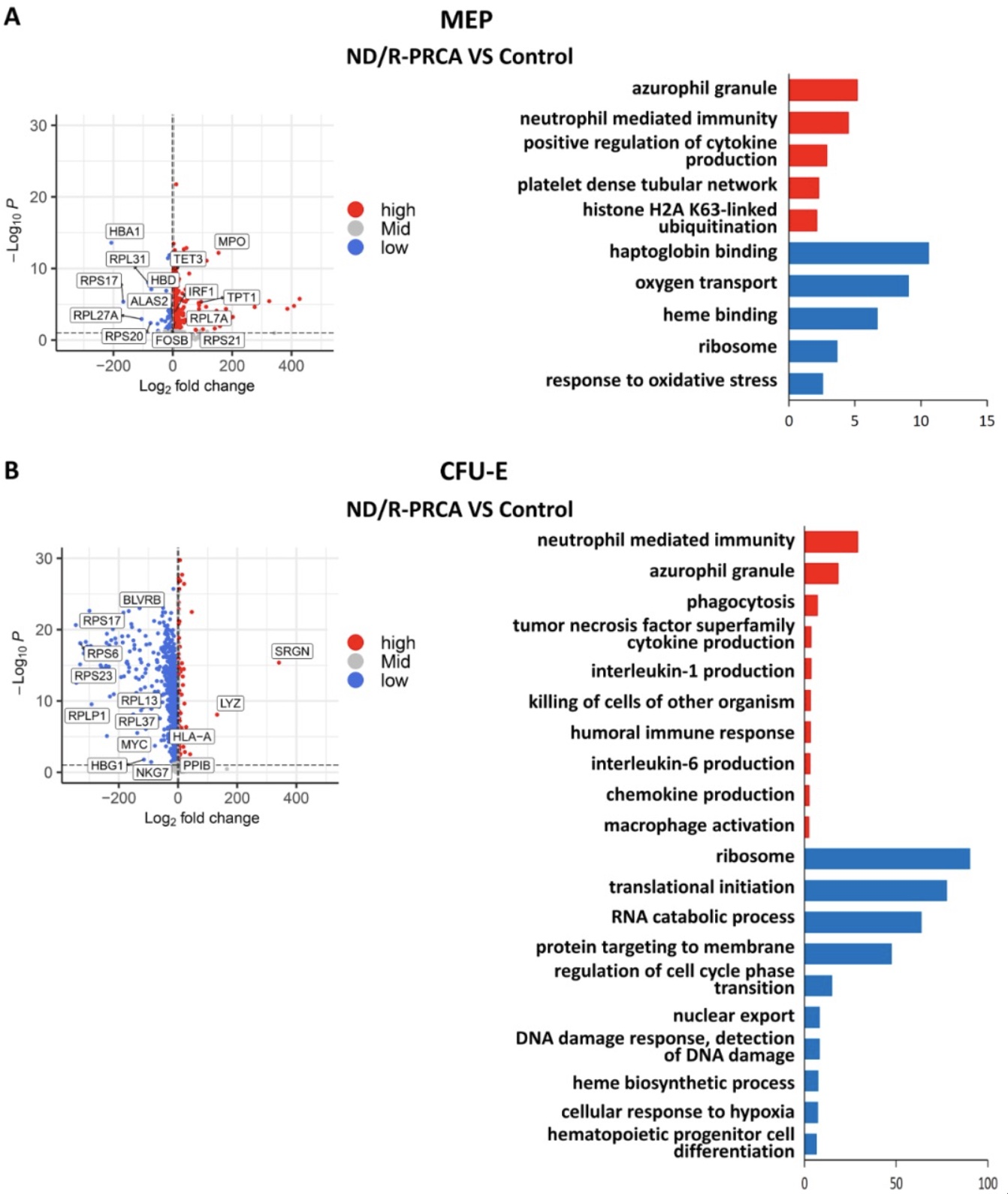
图S1.ND/R-PRCA与对照组MEP或CFU-E差异表达基因分析及GO功能富集分析
(图源:Yumei Liu. et al., Genes & Diseases, 2023)
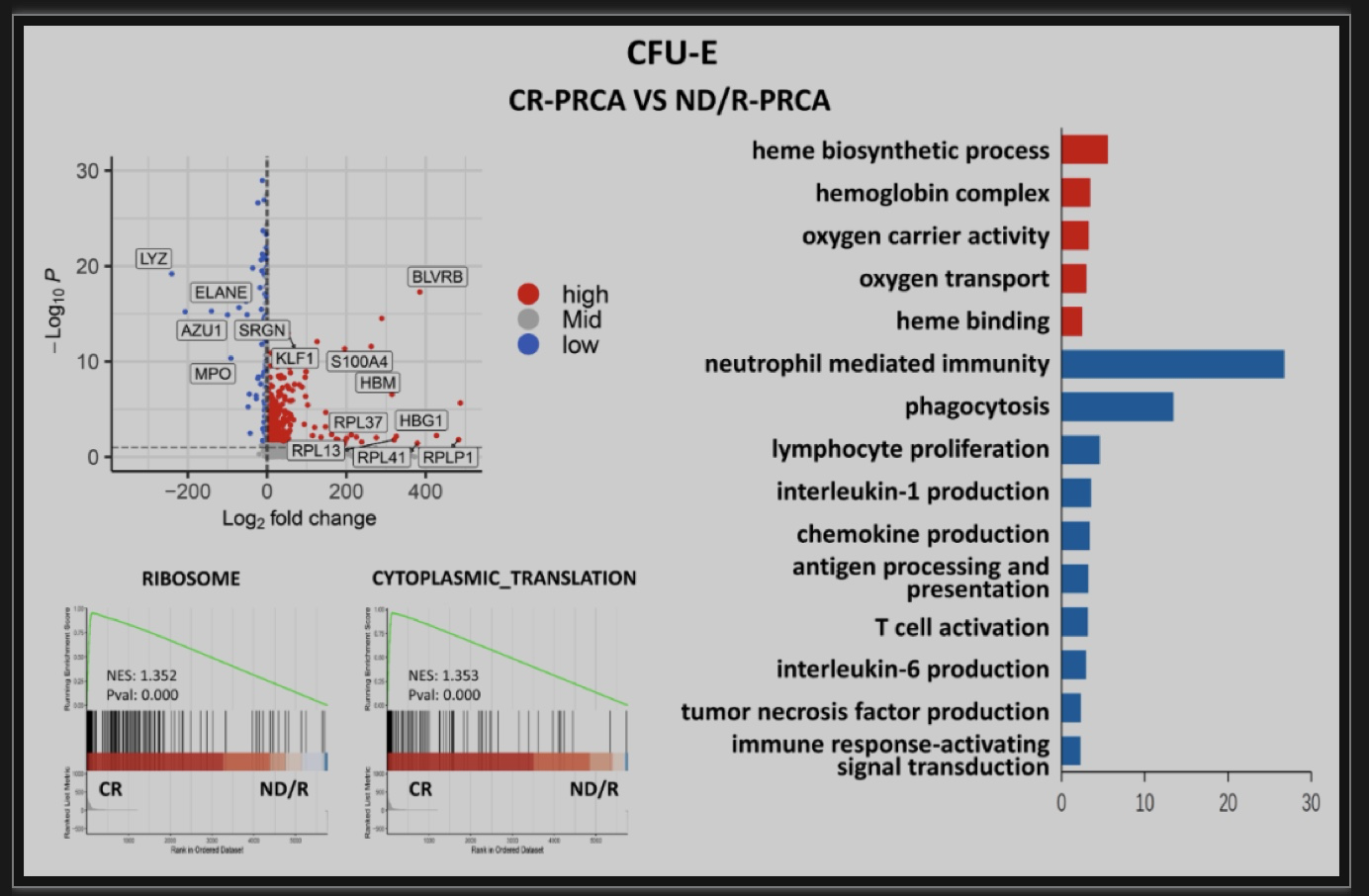
图S2. CR-PRCA与ND/R-PRCA患者相比CFU-E中差异表达基因及GO功能富集分析
(图源:Yumei Liu. et al., Genes & Diseases, 2023)
本研究应用scRNA-seq技术揭示了PRCA患者红系祖细胞的异常转录组特征,发现患者红系祖细胞中核糖体蛋白基因表达广泛下调、中性粒细胞颗粒相关基因表达上调,此外,免疫攻击、炎症反应、衰老、蛋白多聚泛素化也参与了疾病发生。BFU-E可能是红系分化阻滞的关键阶段,经治疗完全血液学缓解的患者BFU-E的基因表达异常尚不能完全恢复。本研究探索了PRCA红系衰竭的发病机制,并对临床治疗有指导意义。本研究的结论尚需进一步实验验证及深入研究,以明确具体机制。

