铜是生物系统中必需的微量元素,能够维持许多酶的活性和转录因子的功能。然而,在高浓度时,铜离子显示出细胞毒性,能够各类细胞死亡,如凋亡、坏死性凋亡、类凋亡、焦亡、铁死亡和铜死亡。此外,铜离子可以触发自噬(是一种依赖于溶酶体的降解途径,调节细胞在各种应激条件下的生存或死亡命运中发挥双重作用)。病理上,由于环境或遗传原因导致的铜代谢受损涉及多种人类疾病,如罕见的威尔逊病和常见的癌症。在治疗上,铜离子络合剂和铜配体化合物是潜在的抗肿瘤药物,可以单独使用或与其他药物或方法联合使用来治疗癌症。在这篇综述中,作者总结了铜代谢分子机制及其对细胞死亡和自噬调控方面取得的进展,这些研究可能有助于将来设计临床工具,以改善癌症的诊断和治疗。作者首先总结了铜离子的关键代谢过程及其在人体生理和疾病中的重要作用,讨论了铜离子如何影响及触发各种类型的细胞死亡(包括凋亡和非凋亡细胞死亡)的最新进展。此外,还梳理了自噬是如何选择性降解细胞死亡调节蛋白以促进或抑制铜相关的细胞毒性,强调了铜离子络合剂和配体化合物在治疗肿瘤中的作用,指出了研究铜离子在细胞死亡中的调控机制对于开发新的抗癌此略非常重要。

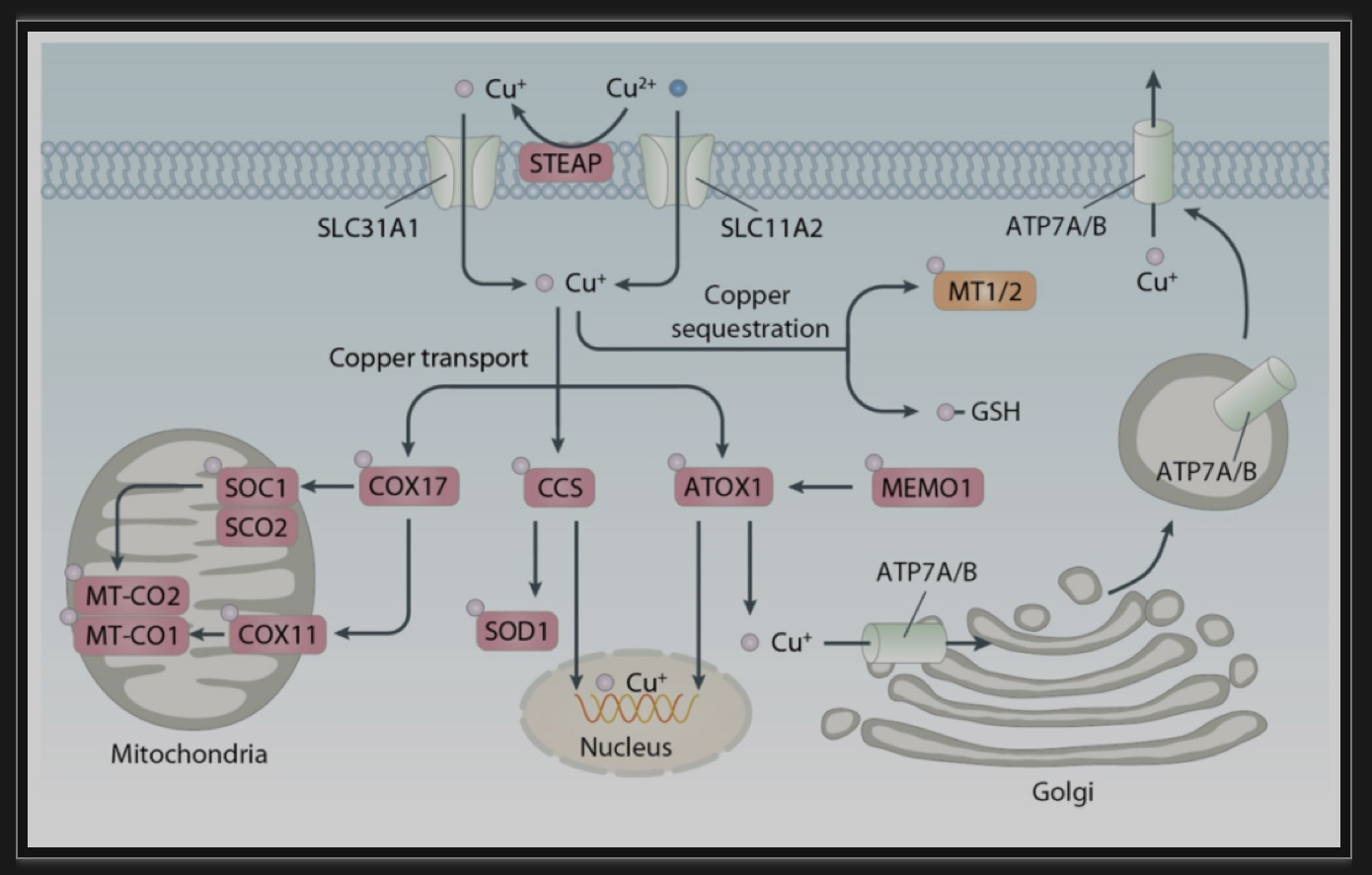
图1.铜代谢的分子机制
(图源: Xue Q, et all. Autophagy, 2023)
过量铜离子通过多种机制诱导细胞凋亡(图2)。首先,铜离子作为一种氧化还原活性金属,参与芬顿反应生成活性氧(ROS)。铜诱导的ROS导致细胞色素C(CYCS)和线粒体凋亡诱导因子1(AIFM1)从线粒体释放到细胞质中,导致PC12嗜铬细胞瘤细胞caspases激活和DNA断裂。铜诱导的ROS还会增加脂质过氧化,消耗谷胱甘肽(GSH),使细胞更容易受到氧化损伤。其次,铜在细胞核内的积累可以与DNA结合,导致多个生物系统的DNA损伤。铜的潜在结合位点涉及相反链的鸟嘌呤和胞嘧啶。铜还通过与DNA相互作用产生氧化损伤来诱导碱基取代突变。第三,铜与硫基结合,使含硫基的酶如蛋白酶体亚基失活。Cu(II)抑制纯化的20S蛋白酶体或19S蛋白酶体去泛素酶的凝乳胰蛋白酶样活性[1]。这些研究提供了一种基于铜的方法来靶向泛素-蛋白酶体系统治疗人类癌症。
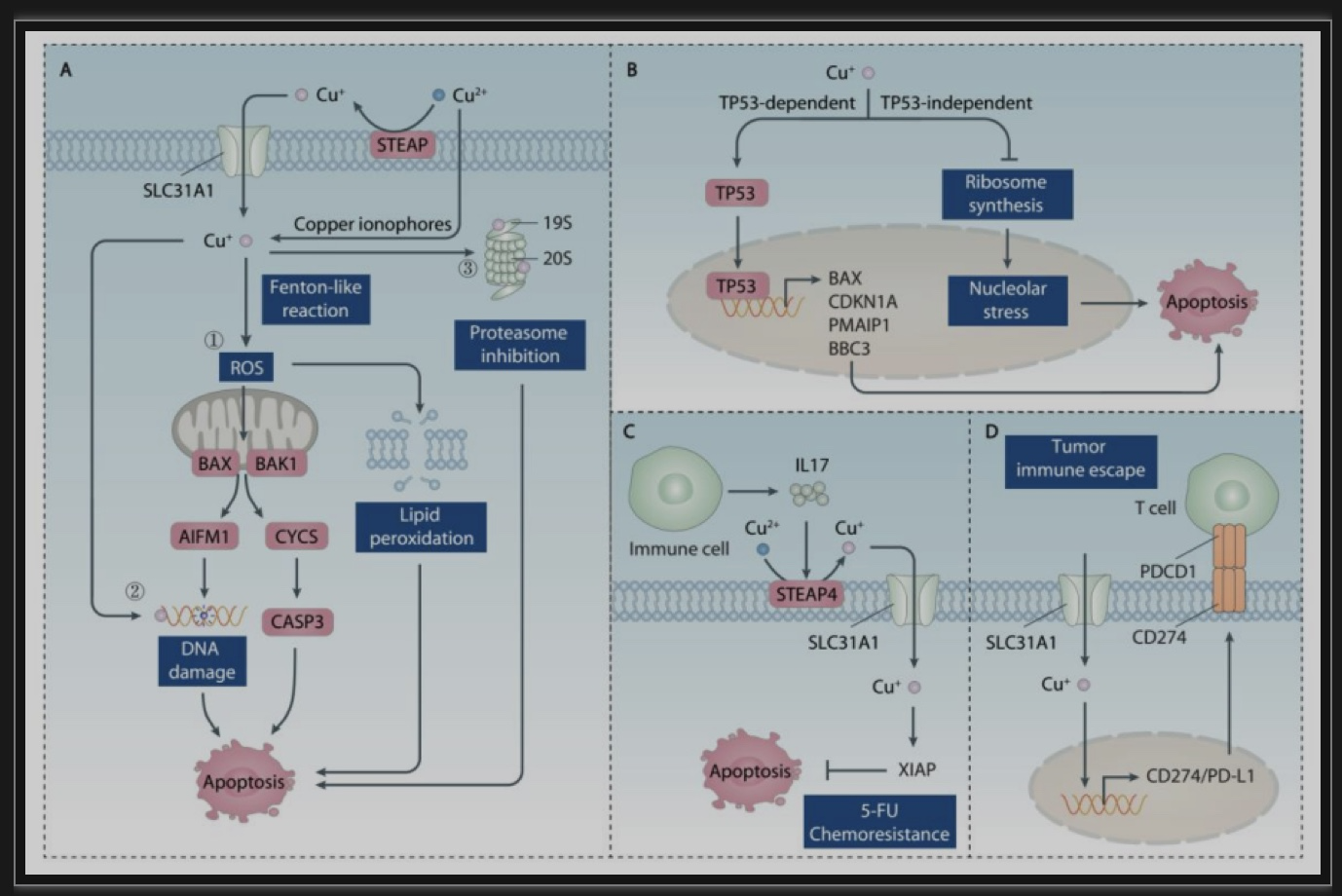
图2.铜离子在凋亡中的调控作用
(图源: Xue Q, et all. Autophagy, 2023)
2.细胞类凋亡
铜诱导的类凋亡(图3)为治疗抗凋亡肿瘤提供了一种潜在的方法。铜介导的内质网应激和caspase3抑制作用导致肿瘤细胞中铜配合物毒性。泛素-蛋白酶体系统的抑制是铜诱导的内质网应激和随后的中毒的另一个可能原因。例如,铜离子通过靶向19S蛋白酶体去泛素酶或20S蛋白酶体引发内质网应激促发类凋亡,而不依赖caspase激活[2]。另一项研究还发现,细胞内铜过载通过诱导ROS和未折叠蛋白反应触发非caspase依赖形式的类凋亡。虽然目前对铜诱导细胞类凋亡的研究多依赖于铜结合剂的使用,但铜对类凋亡分子机制的直接影响仍有待进一步研究。
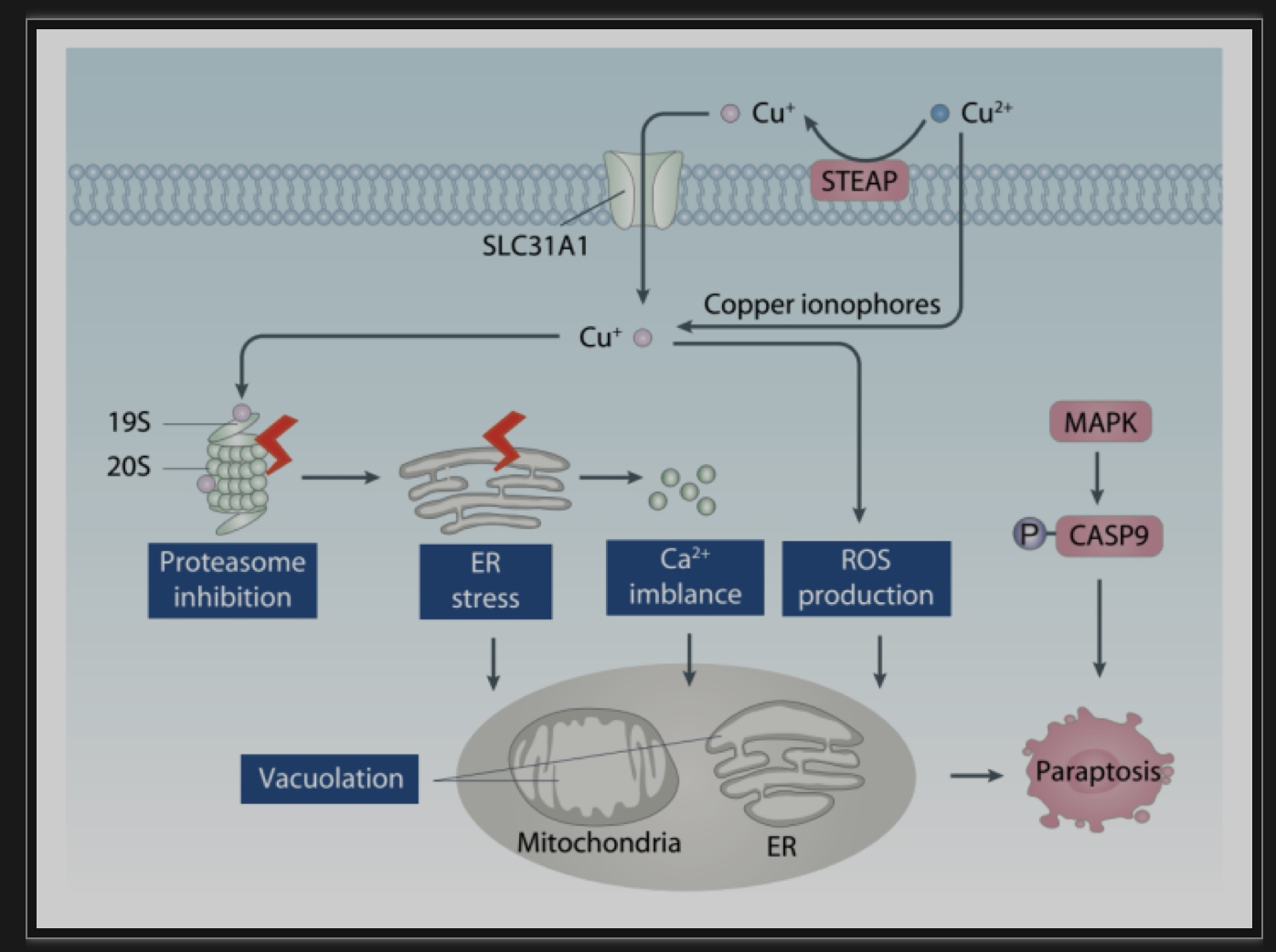
图3.铜离子在类凋亡中的调控作用
(图源: Xue Q, et all. Autophagy, 2023)
3.细胞焦亡
ROS的产生也可能有助于铜诱导的焦亡(图4)。铜暴露增加了肝细胞中caspase1和焦亡相关基因如IL1B和NLRP3的表达。抗氧化剂N-acetylcysteine (NAC)和caspase抑制剂Z-YVAD-FMK可减弱过量铜诱导的肝细胞焦亡。因此,铜诱导的ROS可激活NLRP3炎性小体,诱导焦亡。同样,Cu(II)处理增加了焦亡相关基因如NLRP3、caspase1、GSDMD和IL1B的表达,主要通过激活内质网应激途径诱导焦亡。内质网应激抑制剂,如4-PBA和MKC-3946,可减少铜诱导的细胞焦亡。然而,在肿瘤中,目前尚不清楚铜是否能引起焦亡。

图4.铜离子在焦亡中的调控作用
(图源: Xue Q, et all. Autophagy, 2023)
4.细胞铁死亡
铁死亡(Ferroptosis)是一种铁依赖性的的新型的细胞死亡方式,诱导铁死亡可能作为新型抗肿瘤策略[3]。由于铁和铜具有很强的氧化还原电位,它们都能通过芬顿或类芬顿反应诱导羟基自由基(·OH)的生成。尽管先前的研究表明铁是唯一能引发铁死亡的金属离子,但越来越多的证据表明铜在某些条件下可以促进或抑制铁死亡(图5)。铜结合剂或铜配合物,如双硫仑-铜(disulfiram-copper)和elesclomol-铜破坏线粒体稳态,导致氧化应激,从而导致肝癌和结直肠癌的铁死亡。这与观察到的过量铜积累会在癌细胞中产生大量ROS是一致的。此外,铜在胰腺癌中通过诱导自噬受体TAX1BP1介导的GPX4的自噬降解促进铁死亡 [4]。相反,铜离子也可能通过影响HIF1A抑制铁死亡的发生。含铜纳米颗粒提供了一种可行的铜递送方法,诱导结直肠癌细胞铁死亡。因此,铁死亡是一种依赖金属包括铁和铜的细胞死亡模式。
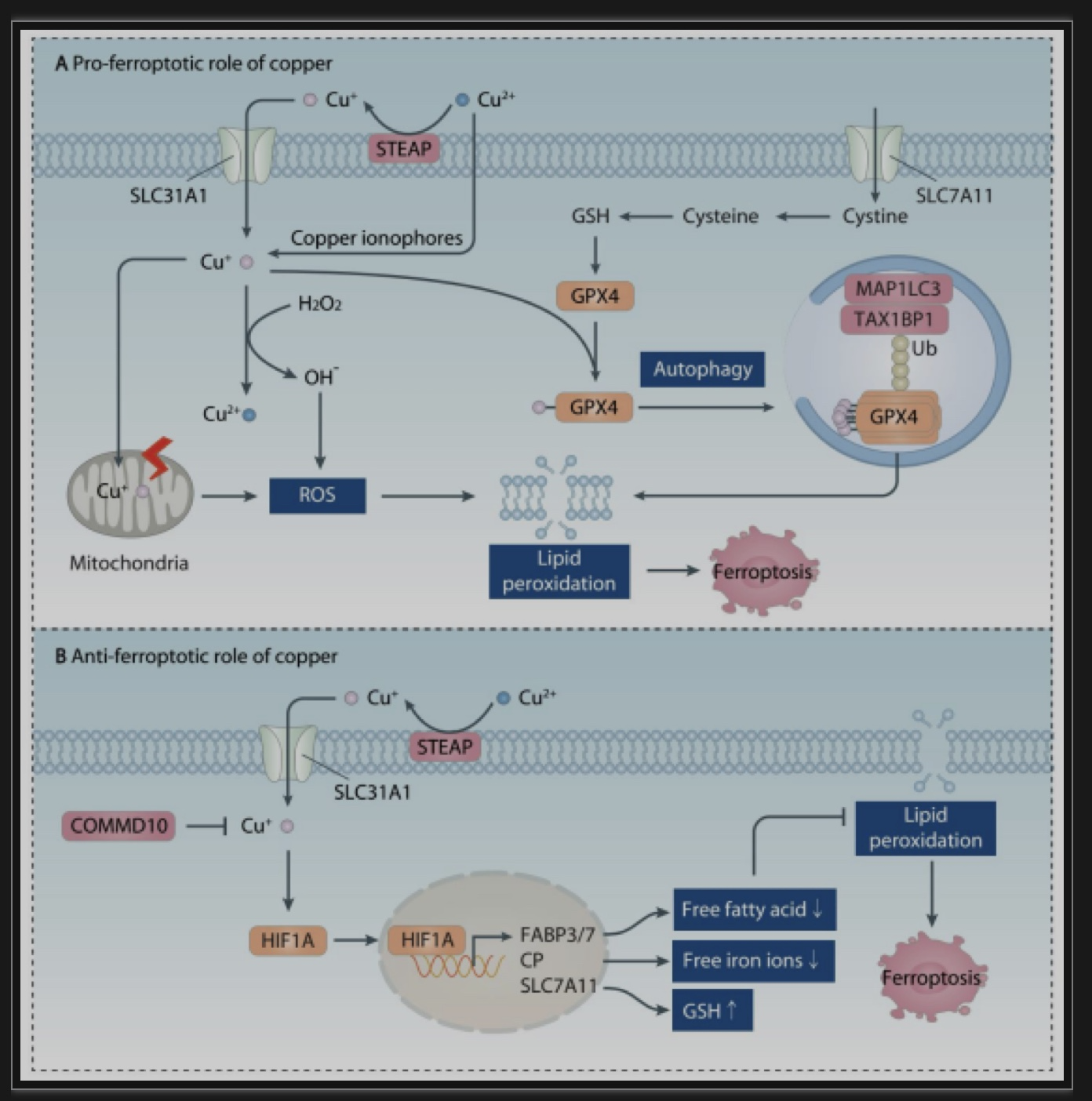
图5.铜离子在焦亡中的调控作用
(图源: Xue Q, et all. Autophagy, 2023)
5.铜死亡
铜死亡被称为由线粒体应激和损伤驱动的铜依赖细胞死亡(图6)。铜离子载体elesclomol通过与Cu(II)形成elesclomol-铜复合物将Cu(II)带入细胞而产生细胞毒性。这种类型的细胞死亡依赖于受损的线粒体呼吸和随后的线粒体蛋白应激,而不是线粒体氧化应激。此外,线粒体能量消耗激活AMPK,引起HMGB1磷酸化,能够促进肝癌和胰腺癌细胞铜死亡,进一步支持铜死亡作为一种代谢性细胞死亡的形式。
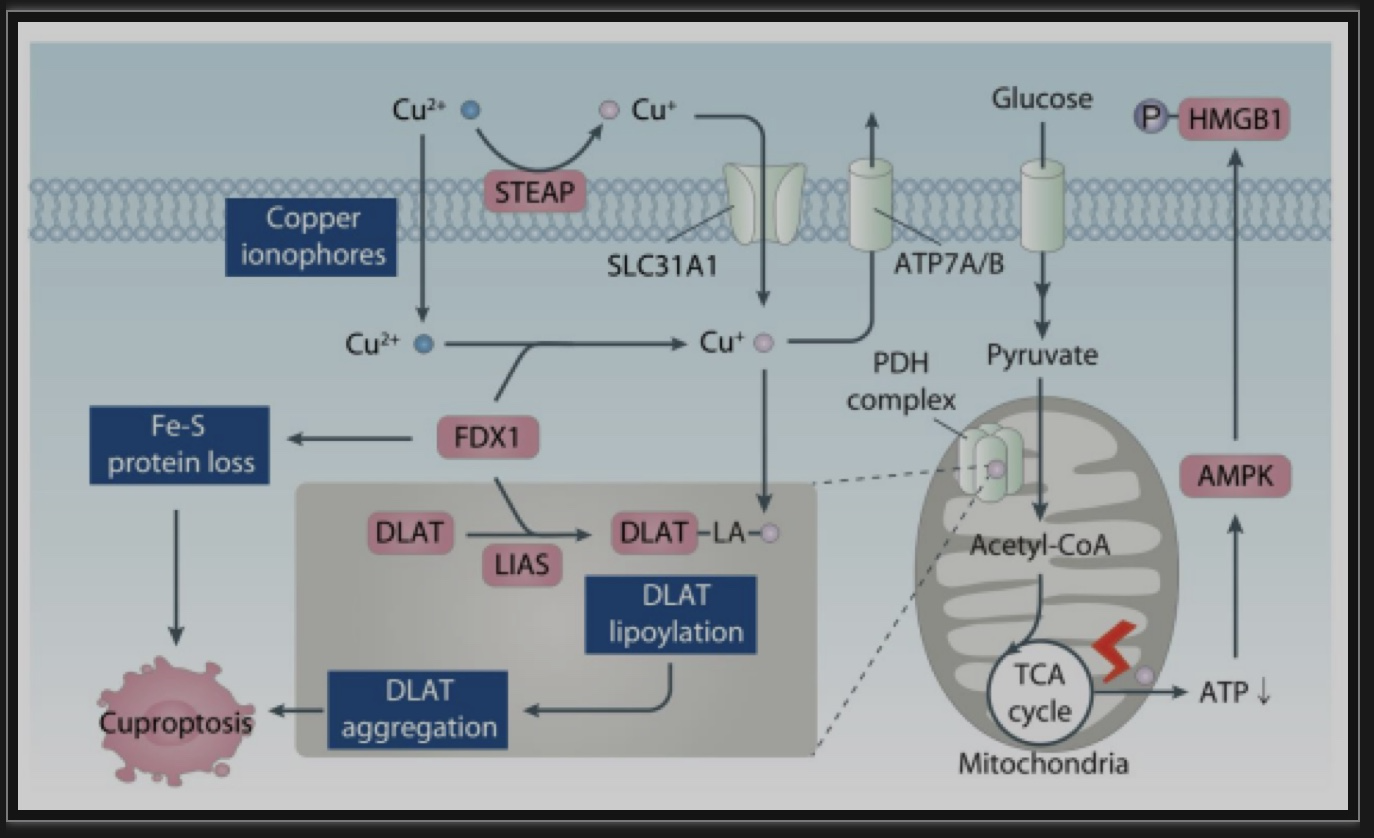
图6.铜离子在铜死亡的调控作用
(图源: Xue Q, et all. Autophagy, 2023)
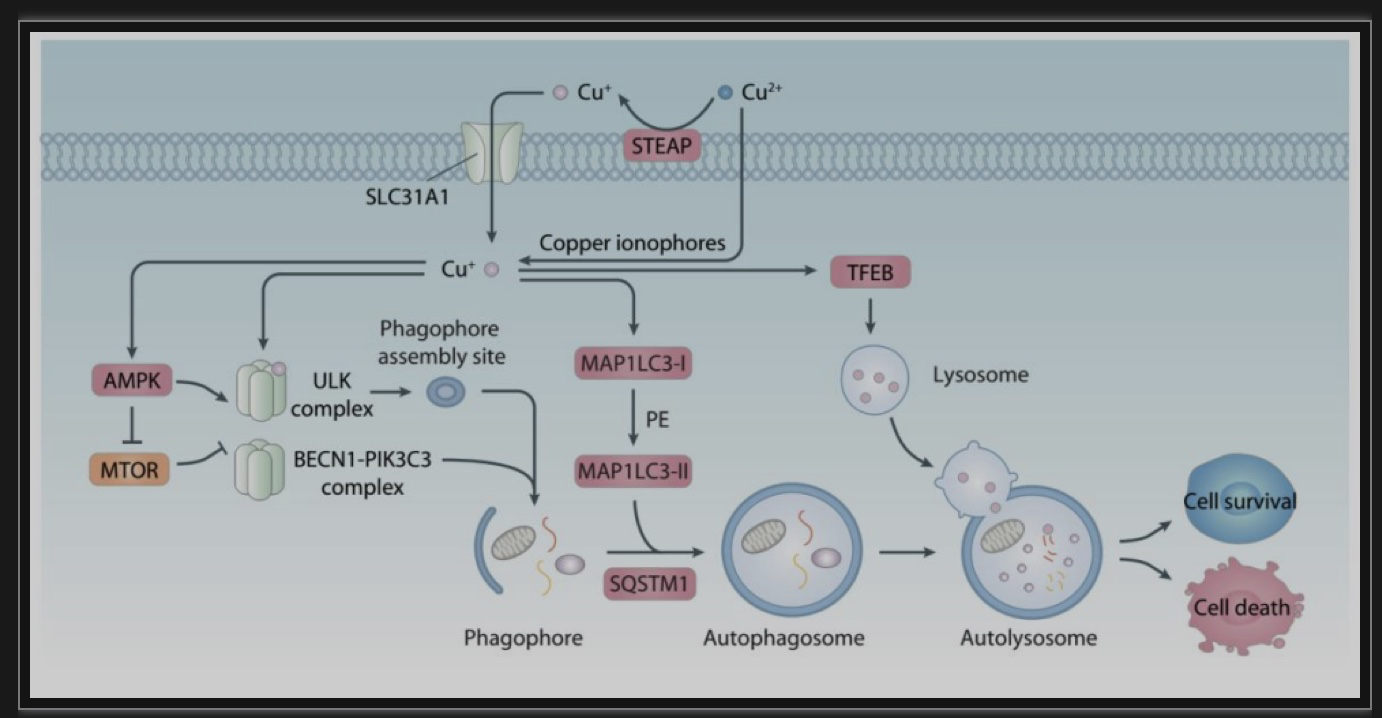
图7.铜离子在自噬的调控作用
(图源: Xue Q, et all. Autophagy, 2023)
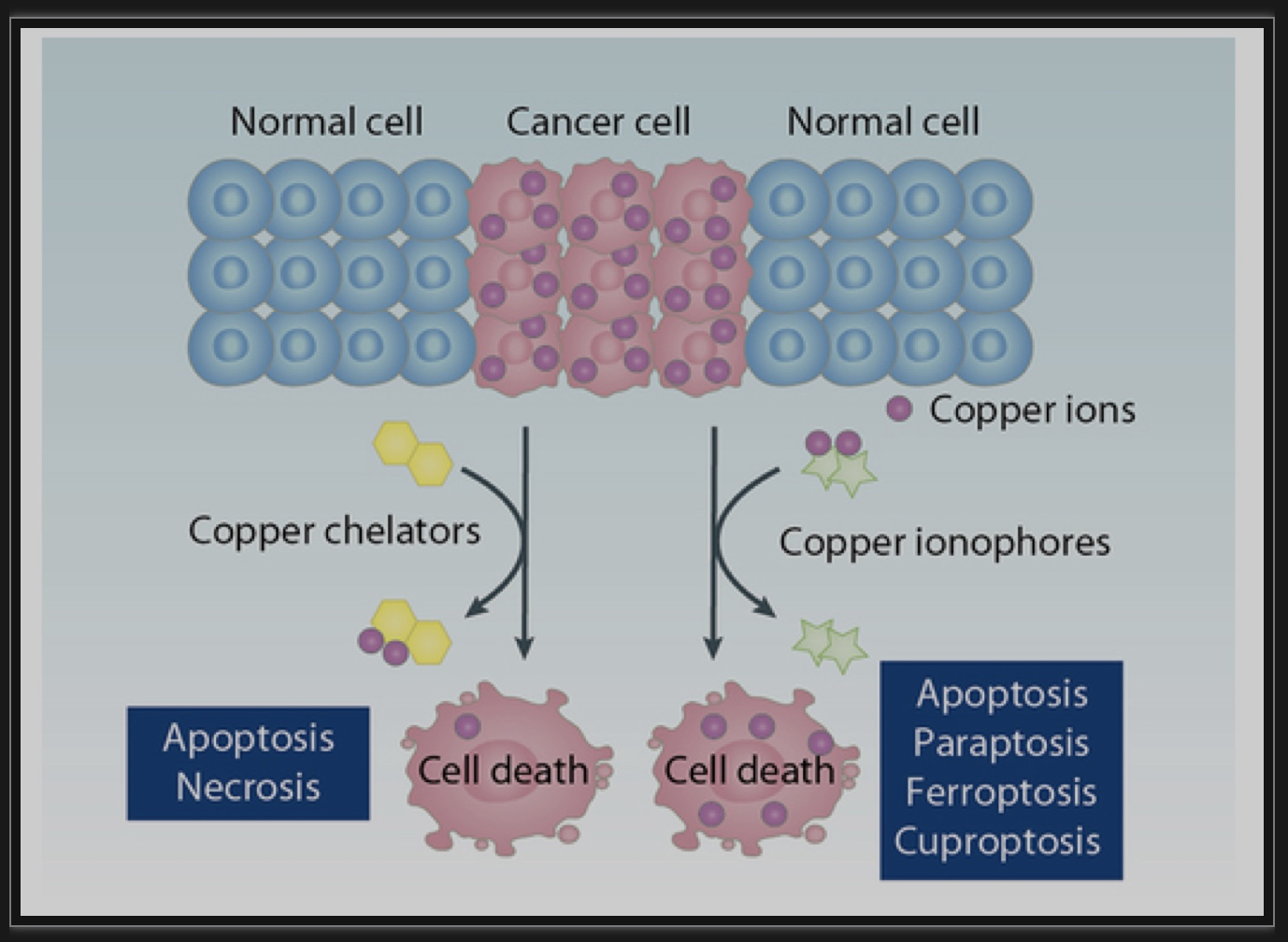
图8 铜螯合剂和离子载体在癌症治疗中的应用
(图源: Xue Q, et all. Autophagy, 2023)
铜是基本生命过程中必不可少的微量元素,包括代谢、反应、运动、生长、分化和繁殖。然而,铜过量会导致氧化损伤和细胞死亡。铜稳态被破坏与包括癌症在内的多种人类疾病有关。铜代谢异常或重编程导致肿瘤内铜增加或改变全身铜分布,从而加速肿瘤标志的发展,这是肿瘤细胞获得的一系列功能能力。尽管临床前研究表明,铜螯合或通过铜离子载体诱导铜依赖性细胞死亡具有有效的抗肿瘤作用,但在其临床转化中仍存在一些挑战,且如何减少铜靶向治疗的毒副作用仍然是临床肿瘤学关注的问题。

