猴痘病毒是1958年首次从研究用猴体内被鉴定到的,1970年出现首例人类感染猴痘病例,在之后的几十年内,几乎从未在非洲大陆之外的地域发生感染。然而从2022年5月底起,由猴痘病毒西非分支毒株进化的突变株引起的猴痘传染病开始在全球范围内传播。2022年7月23日,世界卫生组织宣布,在多个国家和地区发生的猴痘疫情构成“国际关注的突发公共卫生事件”,这是世卫组织的最高级别警告,目前仅有新冠与脊髓灰质炎同处于这一警报下[1]。
猴痘病毒是痘病毒科的正痘病毒属成员,一同在该属的还有曾经令人闻声色变的天花病毒,曾在上个世纪夺去数亿人的生命[2, 3]。猴痘病毒的遗传物质是一个约197千碱基对(kb)的双链DNA (dsDNA)分子,编码超过180个蛋白质。猴痘病毒的生命周期发生在感染细胞的细胞质中,通过自身编码的DNA复制机器完成其DNA的复制。该复制机器由DNA聚合酶F8,加工辅助因子A22和尿嘧啶DNA糖基化酶E4组成,在复制病毒基因组的过程中起到至关重要的作用,是开发相关抗病毒药物的关键靶点 [4-6]。而此前,人们对于猴痘病毒的DNA聚合酶全酶的组装和工作机制的相关研究还较少。
该研究利用冷冻电镜技术及生化实验深入研究了猴痘病毒的DNA聚合酶全酶的组装和工作机制,并采用分子对接技术揭示了核苷酸类似物西多福韦衍生物CDVpp和阿糖胞苷三磷酸Ara-CTP与痘病毒DNA聚合酶的相互作用机制,为开发针对猴痘病毒和其他相关痘病毒的靶向抗病毒疗法打下了坚实基础。

作者首先成功解析了来自2022年的猴痘西非病毒株 (Genbank ID: ON563414.3)的DNA聚合酶F8/A22/E4的冷冻电镜三维结构(分辨率为3.5埃)(图1)。根据高分辨率的结构进行蛋白模型搭建发现,F8聚合酶的结构呈开放构象,全长1006个氨基酸中有927个侧链被解析,包括了N端、核酸外切酶、手掌、手指、拇指结构域,以及5个“痘病毒特异性”插入序列 (Insert) [7]。A22蛋白起到一个关键桥梁的作用,其N端与E4'结合,C端与F8的痘病毒特异性Insert 3相互作用。F8和A22之间能够形成一个广泛的疏水网络,另外F8的Asn576和Arg577能够与A22的Asn373形成氢键 (图2B)。而F8和E4结合的界面主要由F8的Val178、Phe179和Leu278与Val33, E4的Trp36、Ile135和Tyr136所涉及的疏水相互作用介导(图2C)。与VACV的同源聚合酶E9相比,结构分析发现F8的拇指结构域和A22 的middle neck结构域之间的相互作用界面阻碍了DNA的结合,暗示该复合物处于自抑制状态 (图2D)。
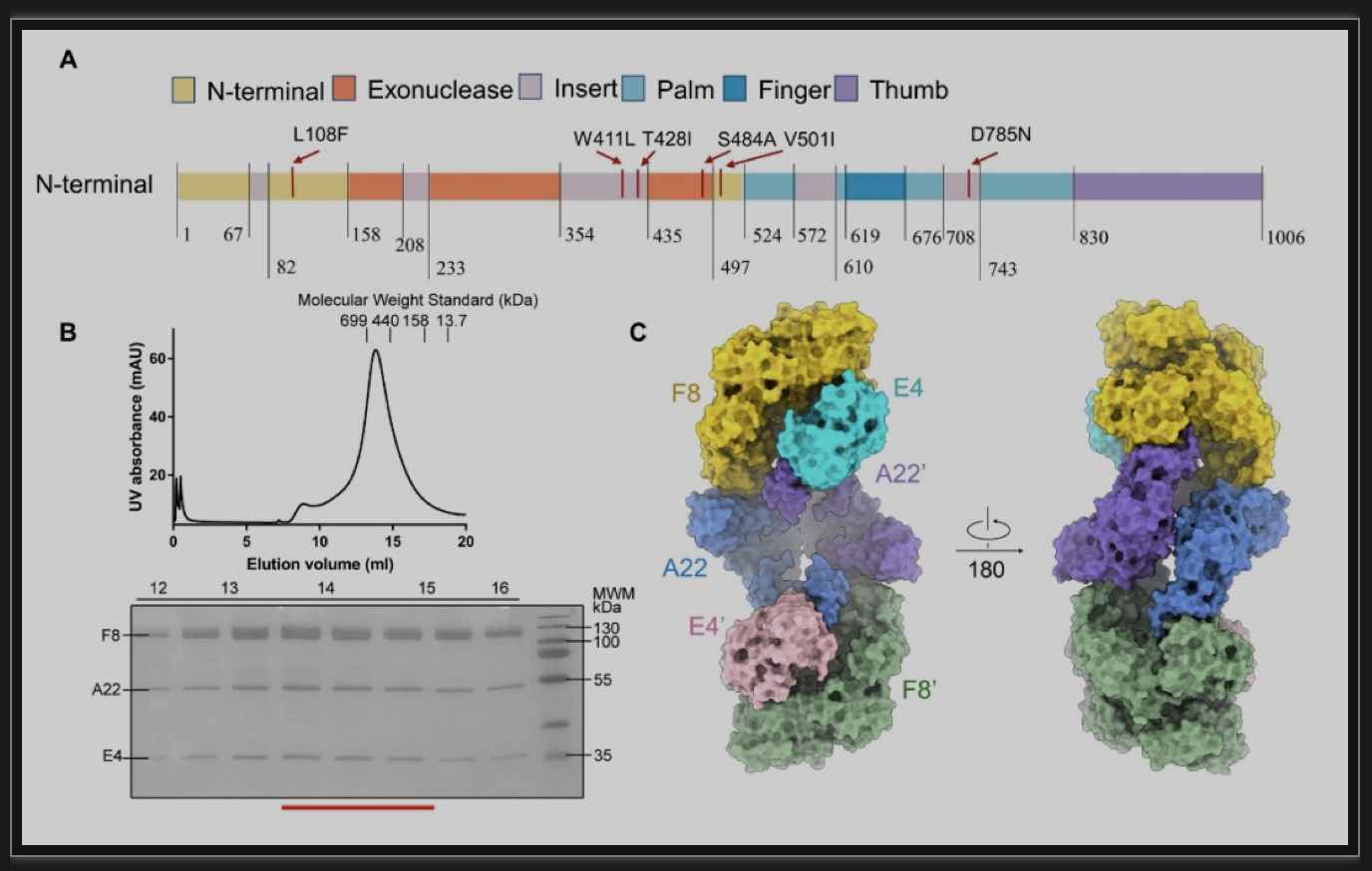
图1 猴痘病毒DNA聚合酶全酶特征及其整体结构
(图源:Li, et al., Science advances, 2023)
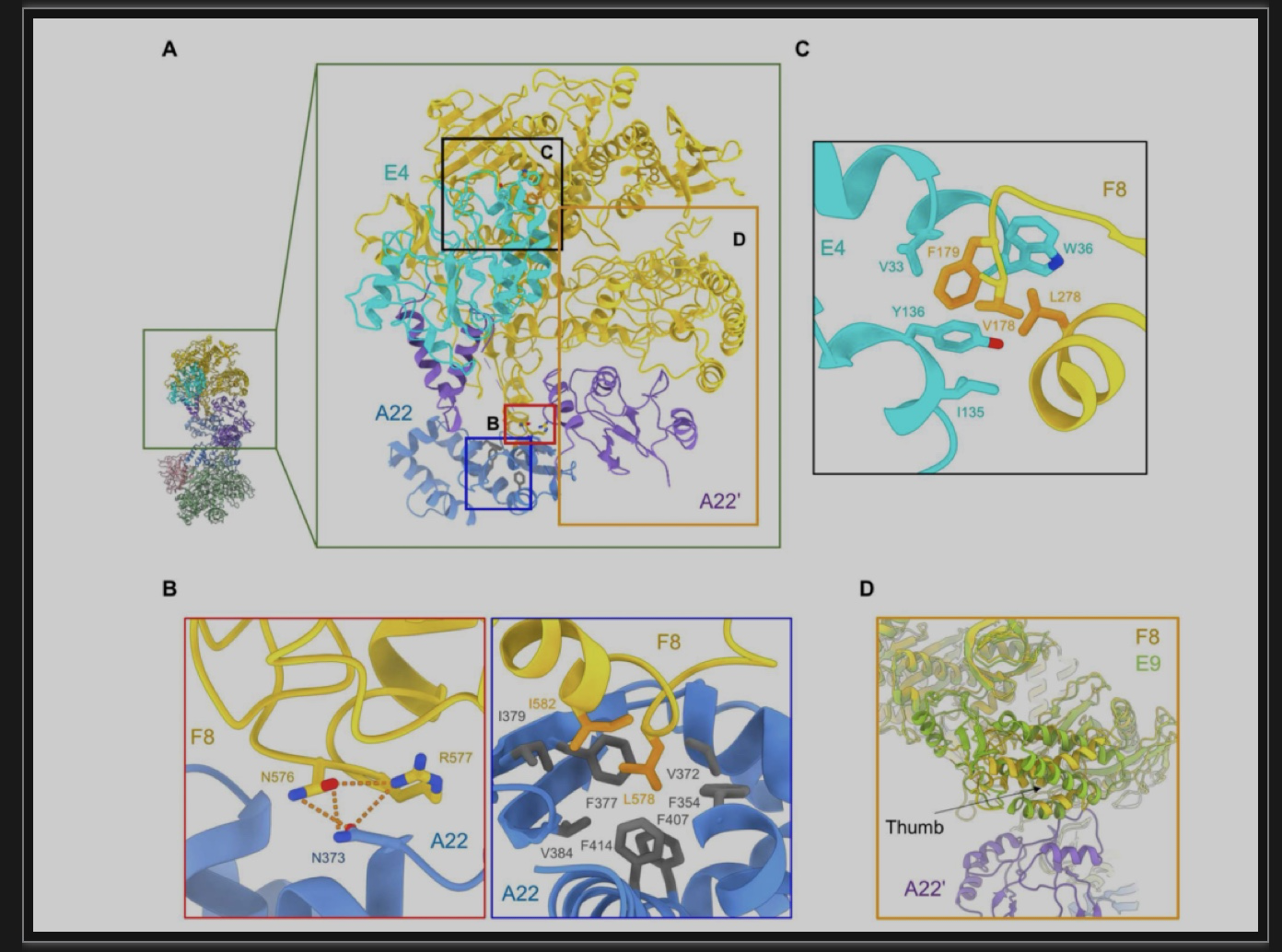
图2 F8-A22-E4六聚体复合物中的多个相互作用界面
(图源:Li, et al., Science advances, 2023)
为了探索MPXV复制DNA的分子机制,该研究尝试将双链DNA底物与六聚复合体进行孵育。让人惊讶的是,外源性dsDNA的加入导致了层析后一个峰的增加,而在SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)上仍然包含F8/A22/E4的条带,这提示了猴痘DNA聚合酶全酶复合物可能出现的另一种状态(图3A)。随后,作者收集了新峰的部分,并制备了冷冻电镜样品进行结构解析, 发现了猴痘病毒的DNA复制全酶可以被双链DNA诱导从无活性的六聚体形式转变为有活性的三聚体形式(图4B)。
基于该发现,该文提出了由F8/A22/E4复合物介导的DNA复制全酶的工作模型。该模型阐释了自抑制六聚体形式的全酶由于无法暴露F8和E4的DNA结合位点,从而无法发挥其复制功能。而外源性双链DNA的加入引发全酶构象变化,使DNA聚合酶由六聚体形式转变为三聚体形式,释放了拇指结构域的DNA结合位点,与模板引物链结合,使F8由开放构象变为了闭合构象。F8的高分辨率结构为进一步分析各结构域和新出现的突变提供了框架,促进了对全酶靶向药物的进一步认识。
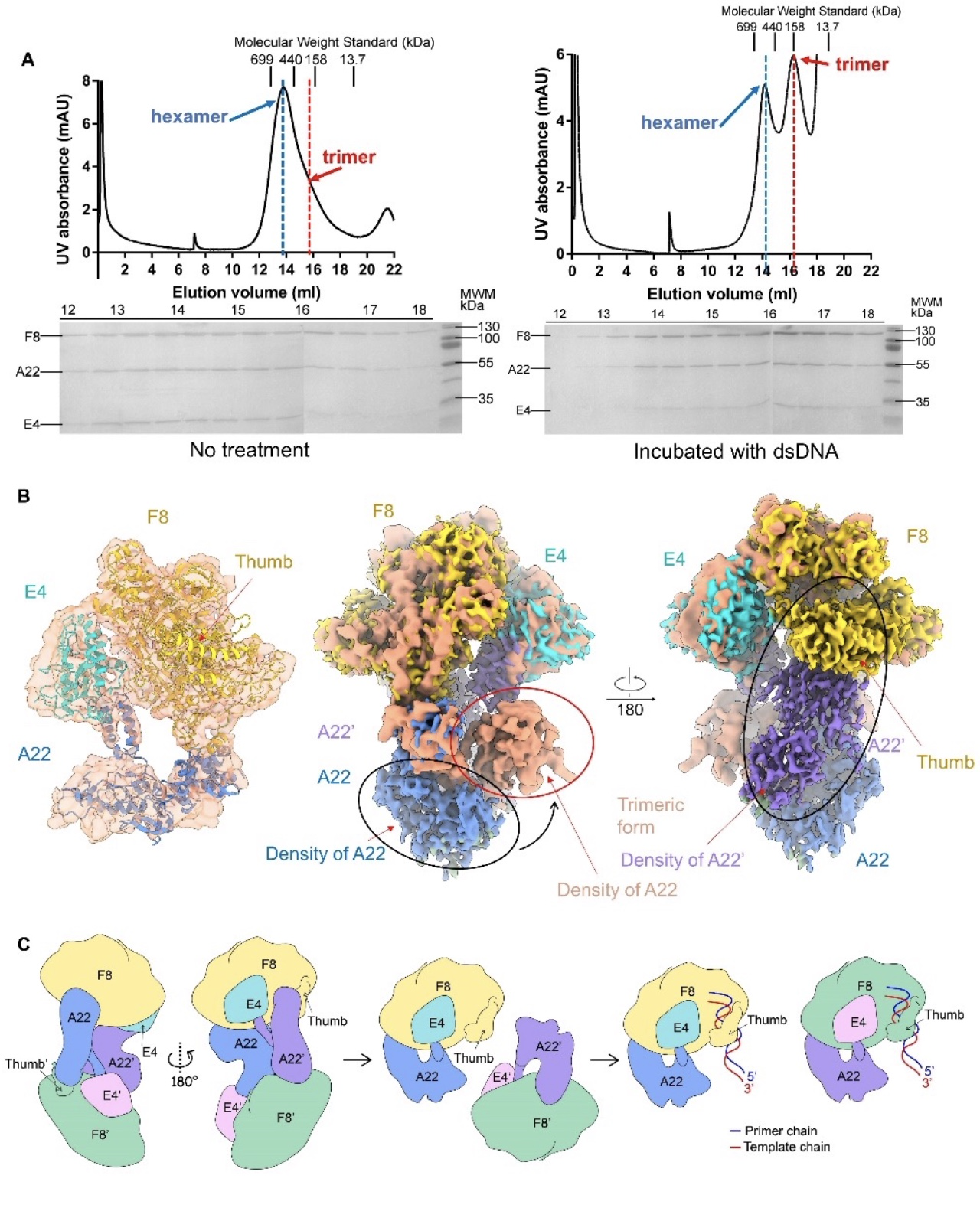
图3 猴痘病毒DNA聚合酶全酶及其工作复制机理假定模型
(图源:Li, et al., Science advances, 2023)
另外,该研究还利用分子对接技术探索了DNA竞争性抑制剂CDVpp和Ara-CTP抑制猴痘病毒和痘苗病毒DNA聚合酶活性的潜在分子机制。研究表明,这两种药物都能够与猴痘病毒F8和牛痘病毒E9活性口袋中的氨基酸残基构成稳定的氢键网络,从而形成很强的结合亲和力,这一结果也为后期开发抗猴痘和其他正痘病毒的药物提供了结构基础。
总而言之,猴痘病毒 DNA聚合酶全酶的高分辨率结构揭示了过程性因子的结合模式,并提供了对其工作机制的理解。此外,该复合物的动态构象变化还需要进一步的结构和功能研究以获得更多的功能状态。

