嵌合抗原受体(CAR)T淋巴细胞过继转移是肿瘤、自身免疫性疾病、动脉粥样硬化等疾病治疗中最有前途的免疫疗法之一[1,2] 。然而,该疗法的主要限制是免疫细胞能否准确到达靶组织,因为即使T细胞能够识别并杀死靶细胞,但如果不能到达靶组织,在体内仍不会发挥疗效。临床研究表明,大多数经静脉转移至人体内的T细胞在非瘤组织中被检测到,而仅有一小部分最终到达目标肿瘤部位[3] 。由于CAR-T细胞转移到靶肿瘤部位的效率低下,许多实体瘤的CAR-T细胞免疫疗法尚未取得成功。出于同样的原因,个体需要静脉注射大量高度活化的工程细胞,这进一步增加了细胞制造成本以及发生T细胞毒性和细胞因子释放综合征(CRS)的风险[4,5] 。
研究人员提出自体T细胞在体外制造过程中经历分子和细胞重编程,促进了T细胞在体内的活化和扩增,但不会驱动T细胞向靶细胞迁移,并可能增加毒性。靶向ST3GAL1-βII-spectrin轴可改善T细胞到肿瘤细胞靶点的归巢,提高T细胞免疫治疗的疗效,同时降低与非特异性细胞毒性相关的风险。

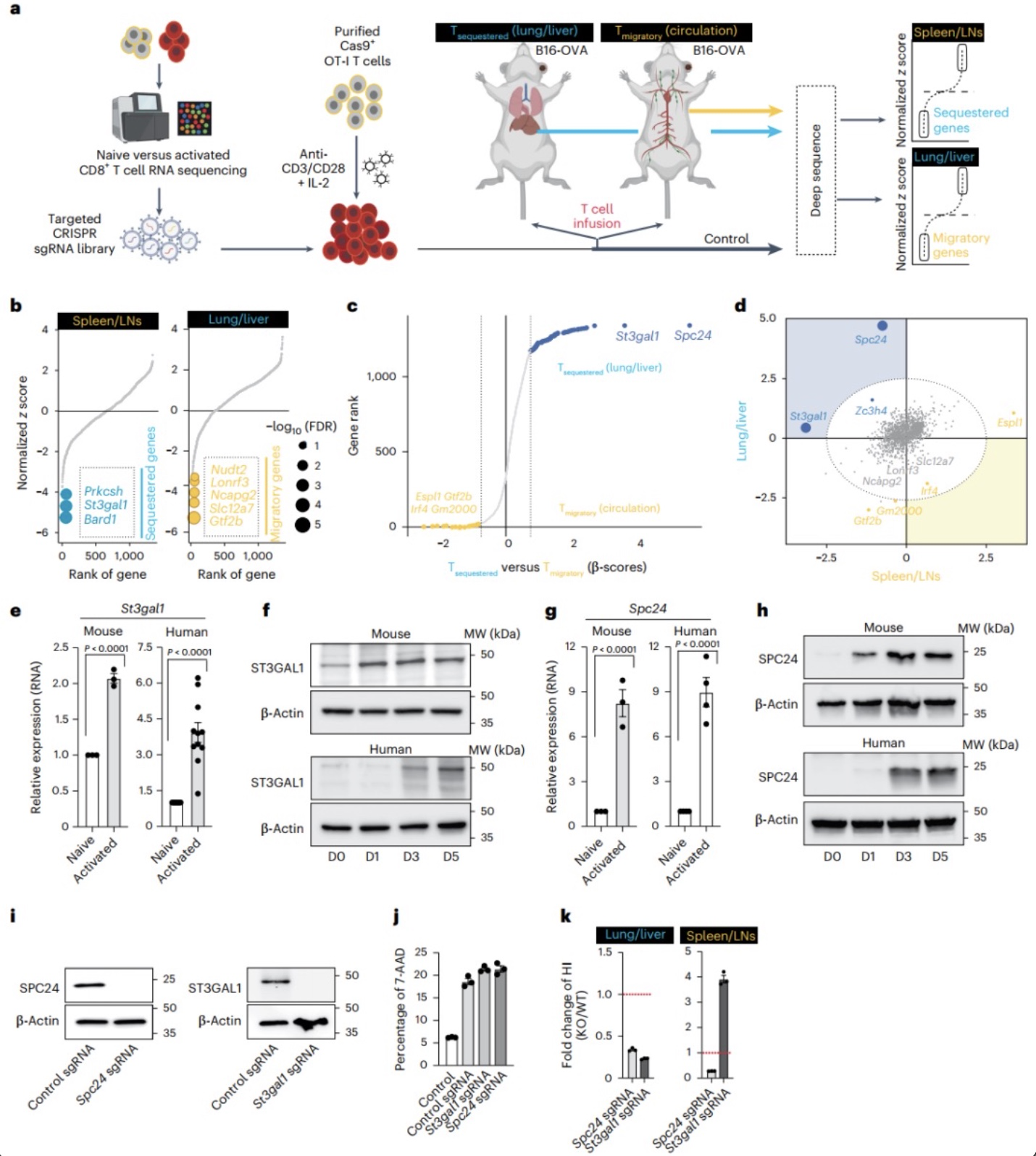
图1 使用CRISPR筛选技术鉴定出CAR-T细胞迁移调节因子
(图源:Hong, et al., Nature immunology, 2023)
接下来研究人员进一步剖析了ST3GAL1调控CAR- T细胞迁移的分子机制。流式细胞术分析显示体外激活的小鼠和人CD8+ T细胞与Maackia amurensis凝集素-II(MAL-II)表面结合增强,MAL-II是一种优先结合α2,3-连接唾液酸的植物凝集素。此外,在活化的CD8+ T细胞中,St3gal1缺失显著降低了MAL-II的细胞表面结合能力,进一步证实了唾液化聚糖活性的增加与St3gal1过表达有关。对CD8+ T细胞中MAL-II免疫沉淀物的分析显示,CD18是携带st3gal1特异性α2,3唾液化聚糖的T细胞糖蛋白。St3gal1沉默后MAL-II与CD18的结合减少,而CD18蛋白的总表达保持不变。淋巴球功能性抗原1(LFA-1)是两个非共价键结合的次单体(α次单体与β次单体)组成的异二聚体糖蛋白,α次单体又名CD11a,β次单体又称CD18。在LFA-1头环的晶体结构中,O-聚糖位点位于βI结构域内,在决定LFA-1的配体结合特异性和亲和力中起关键作用。上述研究提示,在活化T细胞中过表达的ST3GAL1通过促进LFA-1的糖基化导致早期T细胞在肺循环内累积。
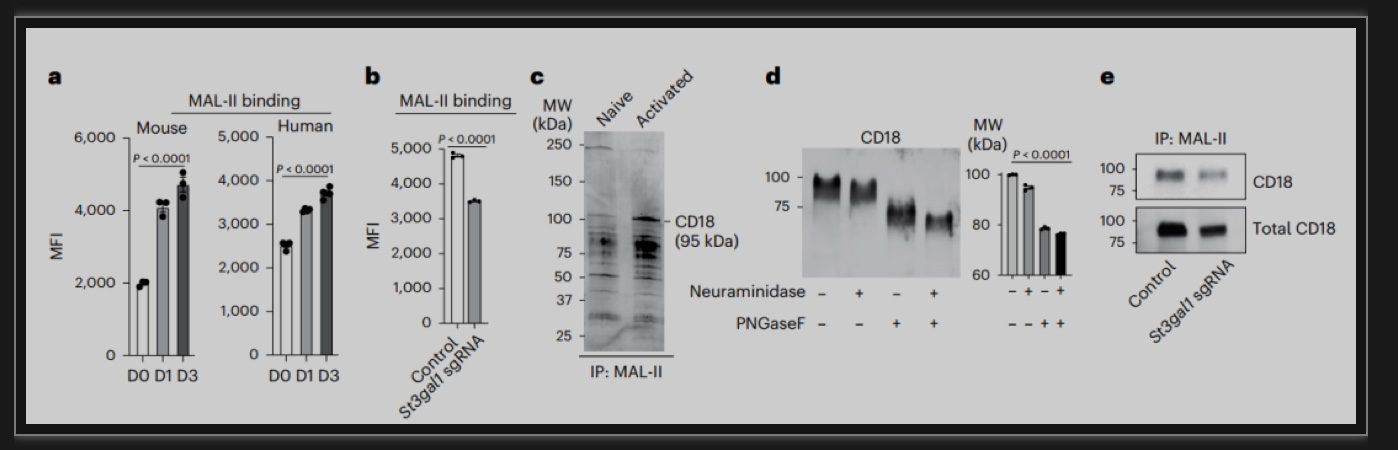
图2 ST3GAL1调控LFA-1介导的CAR-T细胞迁移
(图源:Hong, et al., Nature immunology, 2023)
LFA-1与细胞间粘附分子1(ICAM-1)结合后外向内信号传导,重塑细胞骨架,通过整合素内吞作用调节粘附作用[8] 。研究人员通过分析从ICAM-1结合的T细胞中获得的LFA-1免疫沉淀发现,在T细胞中,αII-和βII-spectrin以及非肌肉肌球蛋白重链IIA(MyH9)三种细胞骨架分子与LFA-1的内吞作用和表面分布有关。三种LFA-1相关分子在naive T细胞中高度表达,在活化T细胞中,αII-spectrin和MyH9的表达水平保持不变,而βII-spectrin的表达显著下调,这提示βII-spectrin可能参与调控活化T细胞中LFA-1的功能。进一步研究发现,在体外活化的CD8+ T细胞中恢复βII-spectrin的表达后,可逆转ST3GAL1诱导的LFA-1内吞噬过程的下调,使细胞对ICAM-1的整体粘附和迁移正常化。

图3 ST3GAL1-βII-spectrin轴调控LFA-1介导的CAR-T细胞迁移
(图源:Hong, et al., Nature immunology, 2023)
接下来,研究人员使用从GFP-RosaβII-spectrin小鼠(TβII-spectrin)和RosatdTomato(TControl)小鼠中分离的T细胞进行了体内竞争归巢实验。在过继转移早期阶段,招募到肺部的CAT-TβII-spectrin细胞数量显著低于CAT-TControl细胞组,相反,CAT-TβII-spectrin细胞在瘤内聚集。与对照组相比,过继转移CAT-TβII-spectrin细胞的荷瘤小鼠表现为肿瘤明显消退和生存率显著提高。过继转移14天后,肿瘤大小差异更为明显,且肿瘤内和淋巴结内CAT-TβII-spectrin细胞浸润显著增加。这些结果表明,CAR-T细胞中βII-spectrin的表达促进其募集到靶肿瘤部位并抑制肿瘤生长。

图4 βII-spectrin的表达可改善CAR-T细胞的肿瘤特异性归巢
(图源:Hong, et al., Nature immunology, 2023)
最后,研究人员收集了人CAR-T细胞,并在治疗前(前5天)和治疗后(注射CAR-T细胞后第2天)对接受CD19 CAR-T细胞治疗的个体连续采集血样。CD19 CAR- T细胞的蛋白质印迹显示,在部分或完全缓解的患者CAR- T细胞中βII-spectrin的表达水平显著提高。此外,CAR-T细胞中βII-spectrin的表达水平与CRS严重程度和神经毒性作用呈现负相关性,表明βII-spectrin可能是严重毒性作用的独立预测因子。

图5 βII-spectrin的表达可预测机体对CAR-T细胞治疗的反应
(图源:Hong, et al., Nature immunology, 2023)

