氧化应激(Oxidative stress, OS)定义为“氧化剂和抗氧化剂之间的不平衡有利于氧化剂,导致氧化还原信号和控制的中断和/或分子损伤”。活性氧(oxygen species, ROS)是正常细胞代谢的产物,在生物系统中具有双重作用。例如,在适合细胞生理学的浓度下,它可以发挥各种生化作用,这可能有助于调节细胞活力和功能或诱导有丝分裂反应。过量的ROS可破坏细胞脂质、蛋白质或DNA,改变其正常功能并促进炎症反应。因此,氧化应激被认为与一系列的发病机制有关,包括癌症、糖尿病、肺缺血/再灌注损伤、炎症性疾病及其与血栓的形成、神经退行性疾病、心血管疾病、胎儿生长受限(FGR)和衰老过程。
如今,越来越多的证据表明,血小板在肿瘤发生的所有阶段都发挥着重要作用,包括肿瘤生长、外渗和转移。血小板与癌细胞相互作用可以促进肿瘤细胞的生长,增加癌细胞的可塑性,促进癌症转移。癌细胞可以通过血小板教育激活血小板,改变血小板的功能,增加血小板聚集。活化的血小板可以释放生物活性物质,如microRNA和生长因子进入血液。血小板和肿瘤的相互作用可以促进肿瘤细胞的生长,增加癌细胞的可塑性,促进癌症转移。如生长因子促进肿瘤血管生成和肿瘤转移,microRNA诱导上皮间质转化(epithelial-mesenchymal transition, EMT)增强干细胞化疗耐药。尽管成熟的血小板缺乏细胞核,不会产生新的转录本,但除了先前的巨核细胞来源的转录本外,它们还可以通过从其他细胞中隔离生物分子来接收新的转录本。血小板可以隔离肿瘤来源的转录本并不断积累,因此是一个高度动态的RNA文库。已有研究表明,血小板通过避开免疫系统而影响癌症特征。血小板与肿瘤细胞的直接接触可以转移主要组织相容性复合体(MHC)I类分子,降低自然杀伤细胞(NK)对肿瘤细胞的杀伤作用,促进免疫逃逸。本文探讨了ROS、血小板和癌症之间的恶性循环相互作用,认为ROS可以通过血小板对肿瘤生长和转移起到促进作用。

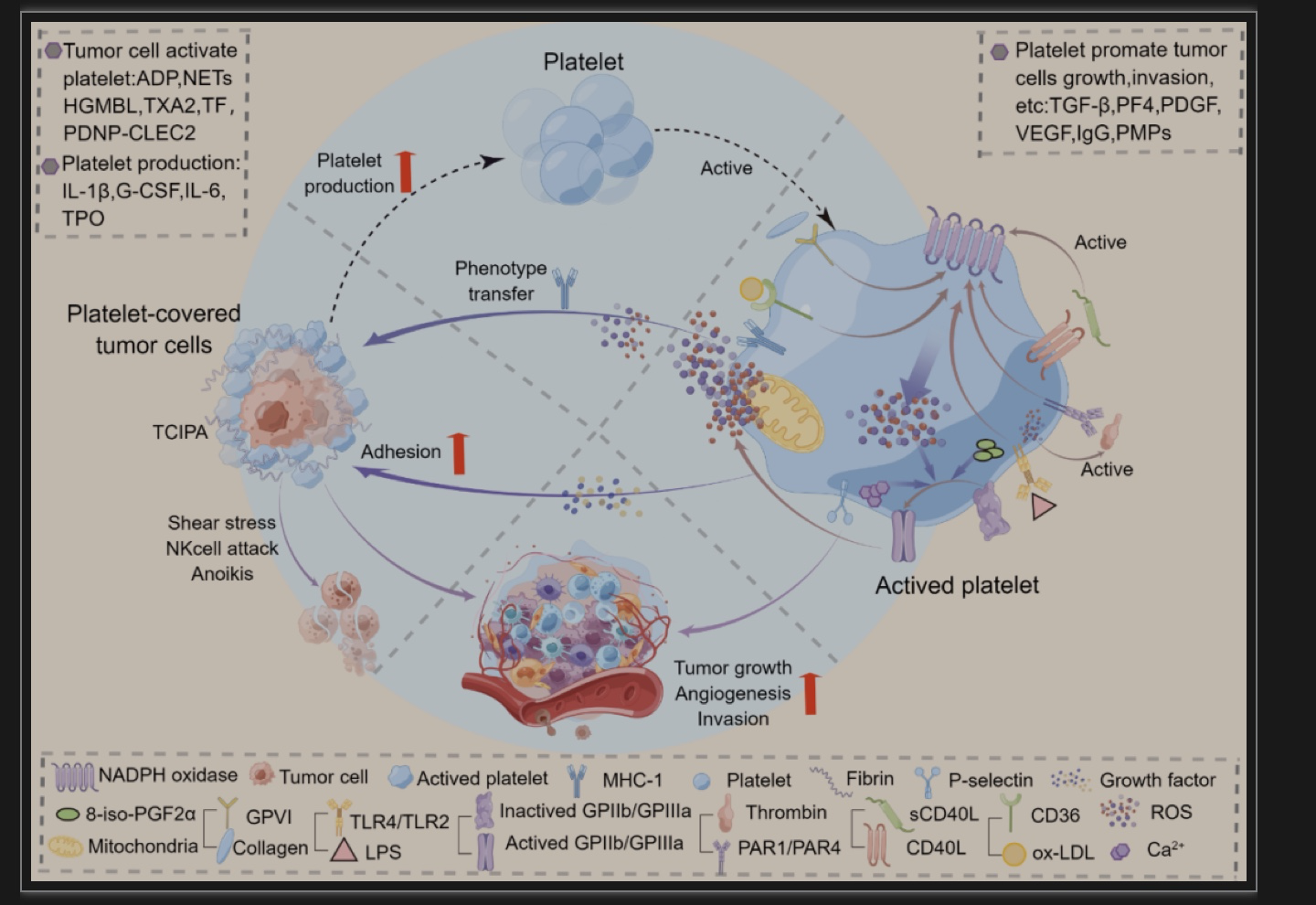
图1 氧化应激、癌细胞和血小板引起的恶性循环的图解
(图源:Zhang, et al., Pharmacological research, 2023)
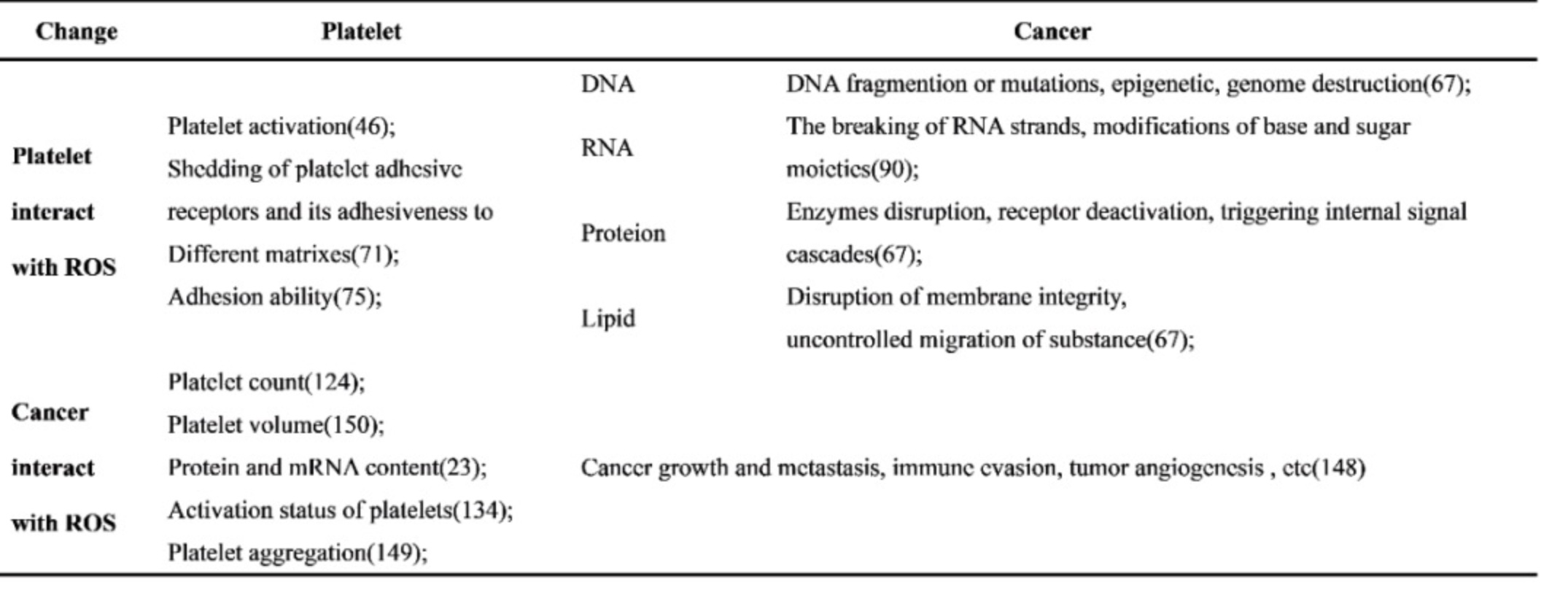
表1 ROS、血小板和癌症相互影响
(表源:Zhang, et al., Pharmacological research, 2023)
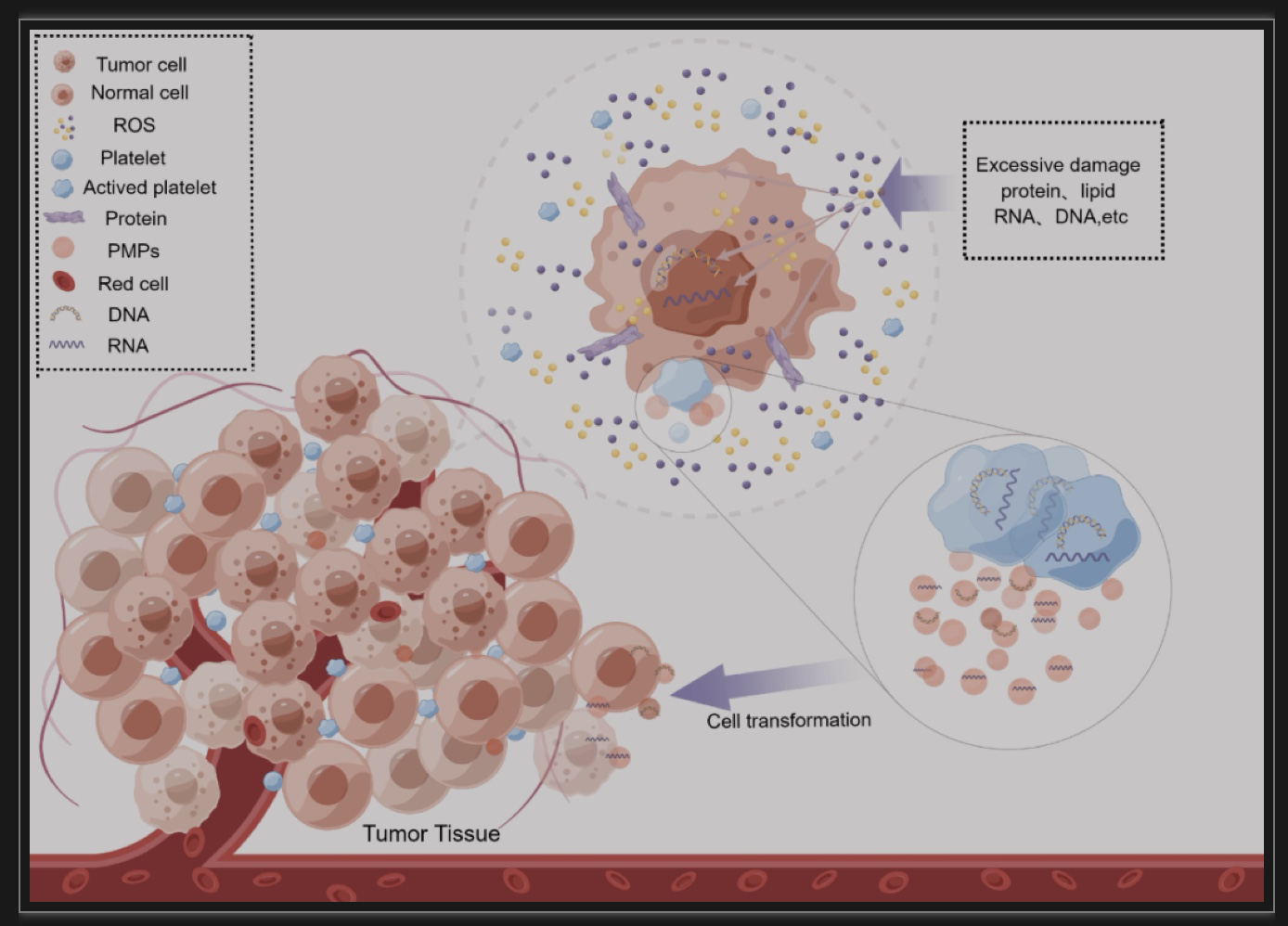
图2 高水平的细胞内ROS可通过多种途径(破坏细胞脂质和膜蛋白、RNA和DNA等)参与癌变过程
(图源:Zhang, et al., Pharmacological research, 2023)
血小板衍生微泡(PMP)是在细胞凋亡和/或应激时,活化的血小板从细胞膜的细胞外芽释放的囊泡。越来越多的证据表明,PMP不仅携带和传递细胞信号,而且是止血、炎症和血管生成的重要调节因子,而且在血栓性、炎症性疾病和癌症进展中发挥作用。在氧化应激存在的情况下,ROS可以通过调节几种microRNAs的生物发生和表达促进癌变。如表2所示的一些关于ROS、miRNAs和pmp如何在癌症中相互作用的相关研究。
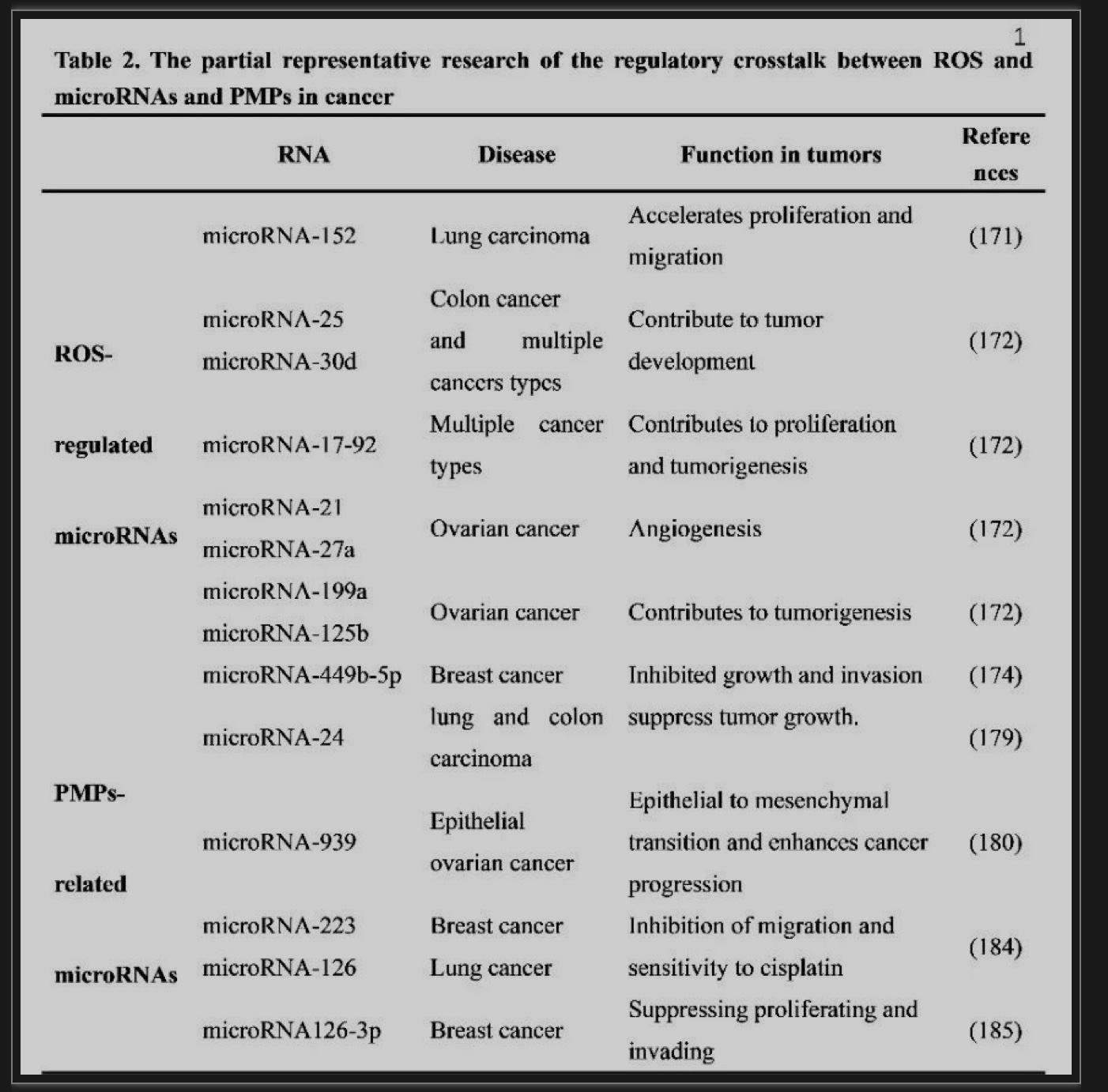
表2 ROS、miRNAs和pmp如何在癌症中相互作用的相关研究
(表源:Zhang, et al., Pharmacological research, 2023)

表3 靶向血小板-肿瘤相互作用的癌症治疗策略
(表源:Zhang, et al., Pharmacological research, 2023)
癌症因其发病率高、死亡率高、预后差而引起人们的广泛关注。癌症的发展涉及多个因素、阶段和步骤。肿瘤微环境中存在着复杂的肿瘤发病生态系统。整个癌症过程受到血小板和ROS的影响,它们都是肿瘤微环境的重要组成部分。血小板活化后释放细胞因子和生长因子,可导致ROS的产生,对癌症产生生物学影响。当癌细胞快速增殖时,其代谢加速,导致高ROS水平。癌细胞也可以影响血小板的各种特性,并改变其功能。血小板除了促进血管生成、肿瘤细胞粘附和侵袭外,还起到阻挡癌细胞的物理屏障和帮助免疫系统逃逸的作用。在这些复杂的相互作用周期中,血小板RNA可能横向运输与癌细胞进行交流(图2)。我们的假设也是,ROS可能通过血小板在各种癌症过程中发挥积极作用,为未来的临床靶点和诊断标志物提供新的思路。

