Wolff定律提出骨密度适应施加在骨骼上的机械力。骨在需要的地方就生长,不需要的地方就吸收。机械力对于骨骼稳态是必不可少的,骨骼的形成、吸收和适应依赖于机械信号,长期高强度运动,加强身体支撑部位的骨量。相比之下,长期暴露在微重力环境中或长期卧床休息会导致承重骨骨质丢失,增加骨折风险。长期以来,身体感知和传递机械力以调节骨骼重塑的机制一直是研究人员和临床医生研究的一个活跃领域。这样的研究将使人们对骨骼疾病有更深入的了解,并确定骨骼再生的新策略。近年来,诸多研究揭示了离子通道在参与骨组织细胞对机械力的感知和响应中的重要作用。
研究表明,破骨细胞功能受机械刺激的调节,同时伴有钙调氯离子通道—Anoctamin 1(Ano1)水平的变化。在机械力加载条件下,细胞内氯离子浓度增加,钙信号受到抑制。另一方面,机械去负荷降低细胞内氯离子浓度,促进钙信号。破骨细胞中Ano1的敲除对机械力加载或去负荷没有反应。Ano1是破骨细胞中一种以前未被识别的机械敏感通道,Ano1通过其钙调节的通道活性在破骨细胞中起机械传感器的作用。

首先,利用三种机械力刺激模型对诱导分化过程中的原代破骨细胞进行处理,三种机械力刺激模型分别是流体剪切力(FSS)、4 G超重(HG)和0.01 g回转模拟微重力(MG)。FSS和HG处理后,western blot结果显示破骨细胞的转录因子NFATc1的蛋白水平受到抑制,TRAP染色结果显示破骨细胞数量明显减少(图1a-d)。MG处理后,NFATc1的蛋白水平升高,破骨细胞数量增加(图1e和f)。研究者进一步分析机械力刺激对Ano1表达的影响,qRT-PCR及western blot证实FSS和HG抑制Ano1的表达(图1g-j),MG促进Ano1的表达(图k和l)。这部分结果证明,破骨细胞响应机械力刺激并伴随Ano1表达的变化。
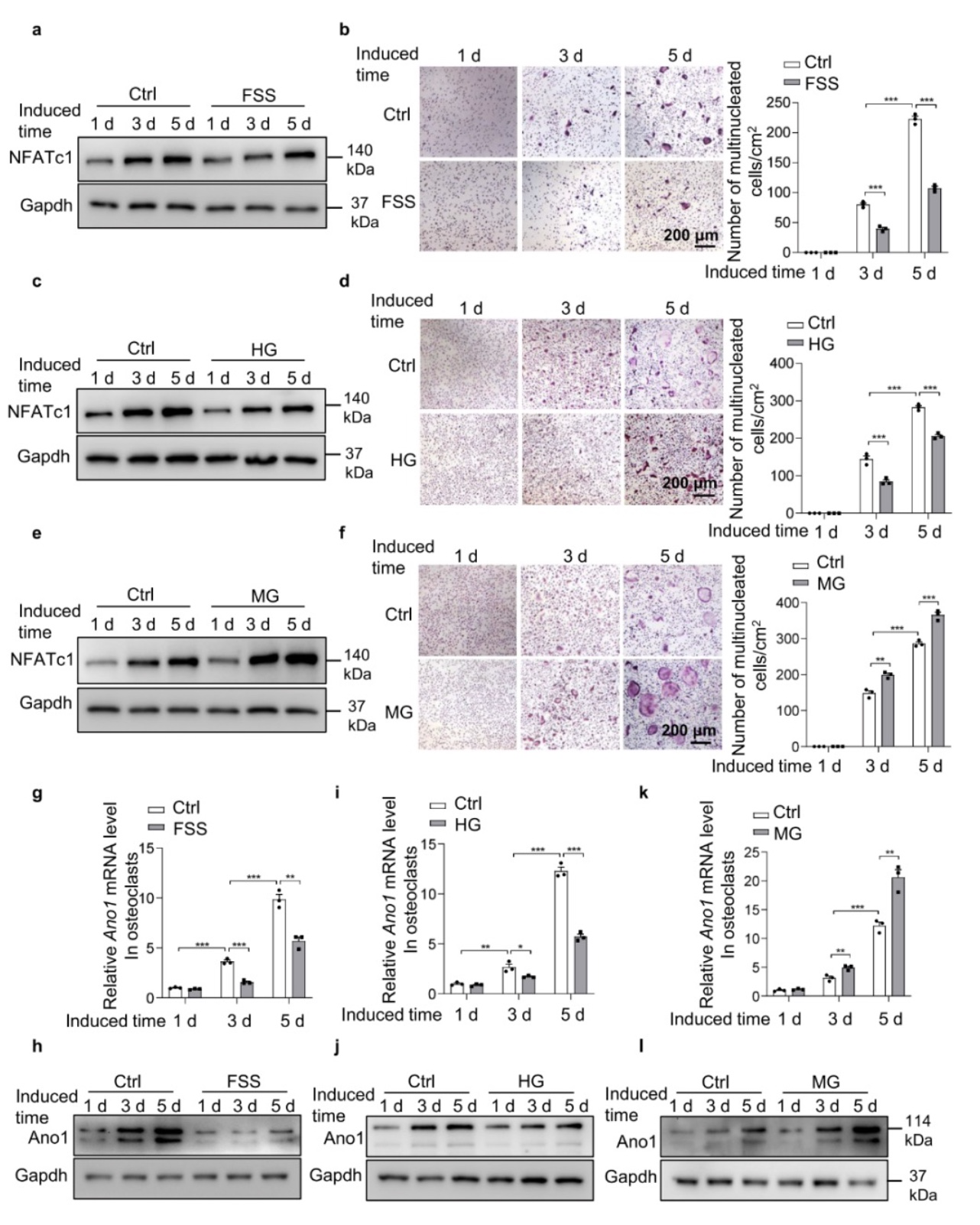
图1 机械刺激引起的破骨细胞活性改变伴随着Ano1表达的变化
(图源:Sun, et al., Communications biology, 2023)
接下来验证Ano1是否参与了机械力刺激对破骨细胞的影响,利用破骨细胞特异的Ano1基因敲除小鼠(Ctsk-Cre; Ano1fl/fl)和其对照小鼠(Ano1fl/fl)来源的破骨细胞,进行MG处理。TRAP染色结果显示MG处理后Ano1fl/fl的TRAP+破骨细胞数量是增加的,Ctsk-Cre; Ano1fl/fl的破骨细胞数量没有明显变化(图2a);qRT-PCR结果显示MG处理后Ano1fl/fl的破骨细胞的标志性基因NFATc1、Acp5、Ctsk和Mmp9的表达是升高的,而Ctsk-Cre; Ano1fl/fl的破骨细胞在MG处理后这些基因的表达没有明显变化(图2b和c)。已知保守的氨基酸残基E702和E705是Ca2+依赖性通道激活的两个关键位点,调控Ano1的通道活性。为了确定钙结合位点是否在Ano1介导的机械刺激中起关键作用,研究者在Ctsk-Cre; Ano1fl/fl的破骨细胞中过表达Ano1野生型质粒(Ano1)或Ano1 的E702和E705位点突变的质粒(E702/E705Q),然后进行MG处理。发现Ctsk-Cre; Ano1fl/fl的破骨细胞对MG没有响应,野生型Ano1可以恢复但是E702和E705位点突变的质粒不能使Ctsk-Cre; Ano1fl/fl的破骨细胞恢复对MG的响应(图2d)。这些结果说明了Ano1在破骨细胞对机械刺激的响应中起着重要的作用。
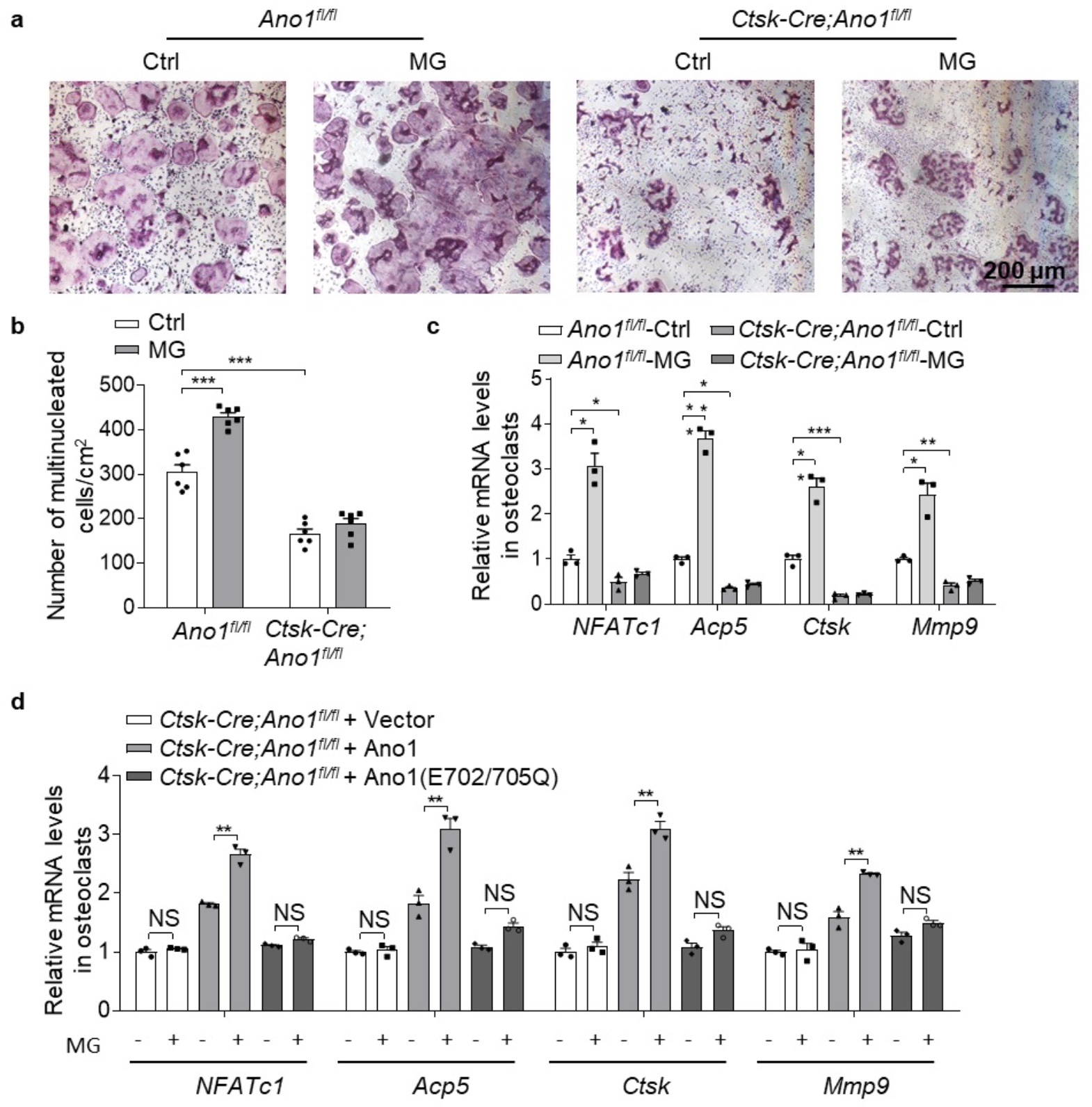
图2 Ano1基因敲除减弱机械去负荷对破骨细胞活性的增强
(图源:Sun, et al., Communications biology, 2023)

图3 Ano1介导机械刺激对胞内Cl-浓度的影响
(图源:Sun, et al., Communications biology, 2023)
为了在体验证Ano1是否介导了破骨细胞对机械力的响应,研究者对3月龄的Ctsk-Cre; Ano1fl/fl和Ano1fl/fl小鼠进行后肢去负荷模拟失重(HS)处理28天,检测骨量以及破骨细胞功能的变化。Micro-CT分析发现,Ano1fl/fl小鼠HS处理后与对照处理小鼠相比,骨量降低,BV/TV减少了43%、Tb.N减少了14%、Tb.Th减少了11%,Tb.Sp增加了13.8%,而Ctsk-Cre; Ano1fl/fl小鼠经HS处理后BV/TV减少了23%、Tb.N减少了10%、Tb.Th减少了7%,Tb.Sp增加了14.2%(图4a和b),HS对Ctsk-Cre; Ano1fl/fl小鼠骨量的影响明显小于Ano1fl/fl小鼠。相应的,HS处理后的Ano1fl/fl小鼠骨组织中破骨细胞数量增加25.7%(图4c和d),血清中破骨细胞标志性蛋白CTX-1的水平增加21.8%(图4e),骨组织中破骨细胞的标志性基因的表达升高(图4f),而Ctsk-Cre; Ano1fl/fl小鼠中的这些指标没有明显变化(图4c-f)。以上结果表明,Ano1介导了尾吊模拟失重导致的骨丢失,Ano1基因敲除能够缓解模拟失重导致的骨丢失。
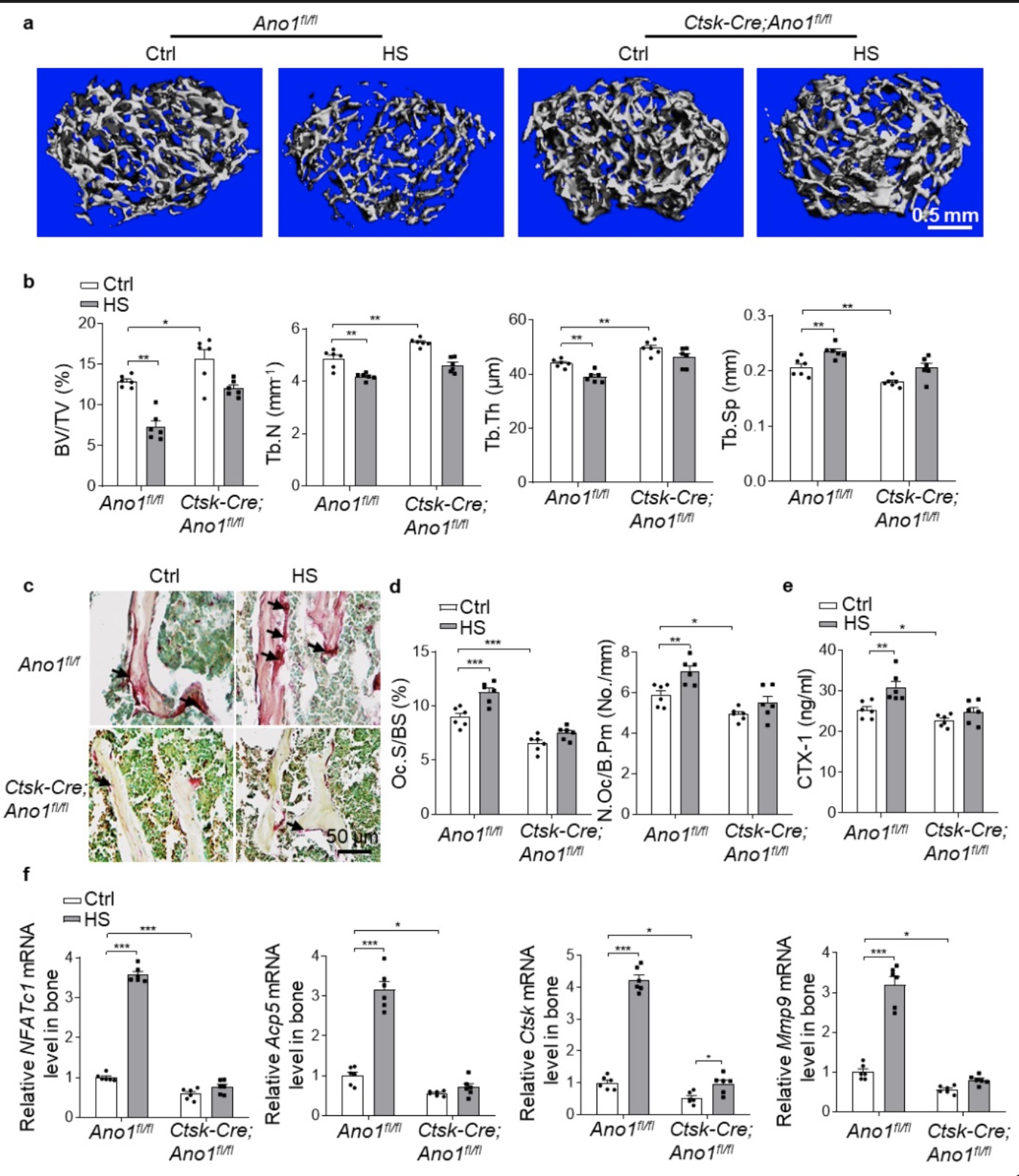
图4 破骨细胞特异性Ano1基因敲除缓解后肢去负荷诱导的骨丢失
(图源:Sun, et al., Communications biology, 2023)
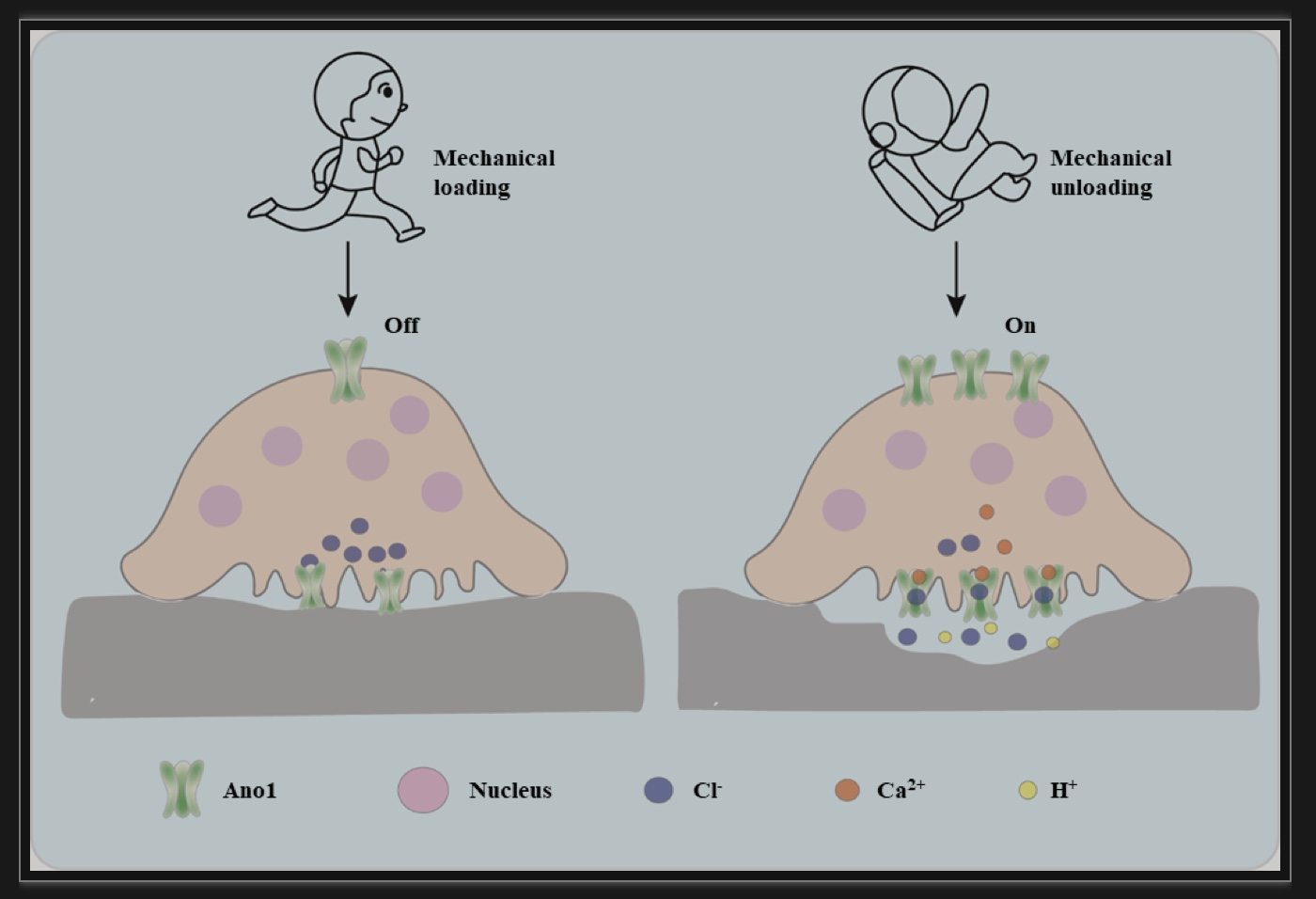
图5 Ano1在破骨细胞对机械刺激响应中的作用模式图
(图源:Sun, et al., Communications biology, 2023)

