脑出血是发病率和致残率较高的脑卒中亚型,多数脑出血幸存者存在严重的感觉、运动和认知功能障碍,日常生活难以自理。目前仍缺乏有效的治疗方式以改善脑出血引起的神经功能损伤[1]。神经炎症和焦亡是脑出血后继发性脑损伤的重要病理生理过程。催产素是一种由下丘脑产生的多效性神经肽,除却其在外周中经典的促进分娩和催乳等效应,中枢神经系统中的催产素在应激、抗炎、抗氧化和神经发生等方面发挥重要作用[2]。目前尚不清楚催产素能否在脑出血中发挥神经保护作用。
研究发现催产素经鼻给药可有效改善脑出血小鼠的神经功能预后,减轻神经元焦亡、炎症和线粒体过度分裂,该保护作用可能通过OXTR/p-PKA/DRP1信号通路实现。结合多项临床研究中催产素经鼻给药的安全性与可靠性,催产素有望成为改善脑出血患者预后的潜在治疗药物,具有重要临床转化价值。

据报道,蛛网膜下腔出血患者的脑脊液[3]和血管性痴呆患者的梗死灶周围组织中催产素(oxytocin,OXT)和催产素受体(oxytocin receptor,OXTR)的含量发生变化。该研究通过自体血纹状体立体定位注射构建小鼠脑出血(intracerebral hemorrhage,CH)模型,应用ELISA和WB检测了损伤侧纹状体中催产素相关信号的变化,发现ICH后雄性和雌性小鼠纹状体中OXT含量减少、OXTR含量增加(图1A-C)。
基于内源性OXT在ICH后减少,作者进一步探索了外源性补充OXT能否减轻ICH后的神经功能损伤。研究发现在雄性和雌性小鼠中,ICH后第3天纹状体和下丘脑中的OXT水平降低,鼻内OXT治疗恢复了纹状体中的OXT水平,但下丘脑中的OXT水平没有恢复(图 1D)。随后,作者在ICH造模后第14天通过转棒实验、新物体识别实验和三箱社交实验评估了纹状体中恢复的OXT水平是否可以改善小鼠的长期神经功能预后,结果表明鼻内OXT给药能有效改善雄性和雌性ICH小鼠的运动功能和认知记忆功能(图1E)。
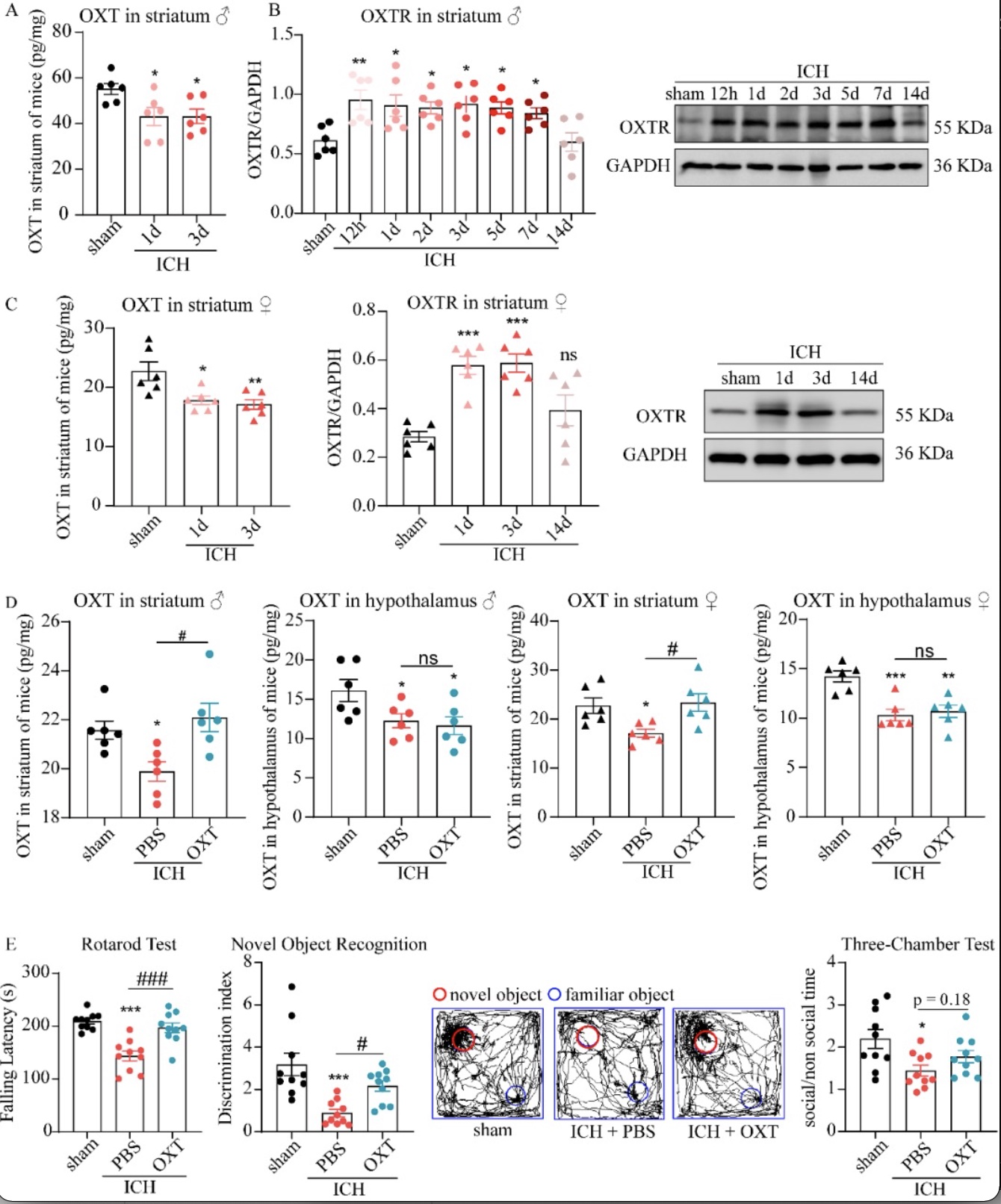
图1 ICH后OXT和OXTR的变化及OXT治疗对远期神经行为的神经保护作用
除了长期行为缺陷外,ICH小鼠急性期还存在明显的感觉和运动功能障碍,可在ICH 后第3天通过改良Garcia评分、爬杆实验和前肢放置实验进行评估。该研究发现OXT治疗可有效恢复小鼠短期行为学表现(图2A)。据报道,OXT主要通过激活其受体OXTR发挥作用[4],为了探索OXT是否通过激活OXTR介导对ICH的神经保护作用,该研究在OXT给药前给予OXTR抑制剂L-368, 899,发现与ICH + OXT组相比,ICH + OXT + L-368, 899组小鼠改良Garcia评分恶化、爬杆时间延长、前肢放置率降低(图2A)。上述结果提示OXT通过OXTR改善ICH小鼠的短期神经功能。
前文中作者发现OXT可以改善ICH小鼠的长期和短期神经功能损伤,但其潜在机制尚不清楚。作者通过WB和IF评估了OXT治疗后细胞焦亡相关因子ASC、NLRP3、caspase-1和GSDMD的含量变化情况。发现OXT通过激活OXTR抑制神经元焦亡,从而改善小鼠的神经功能(图2B-F)。
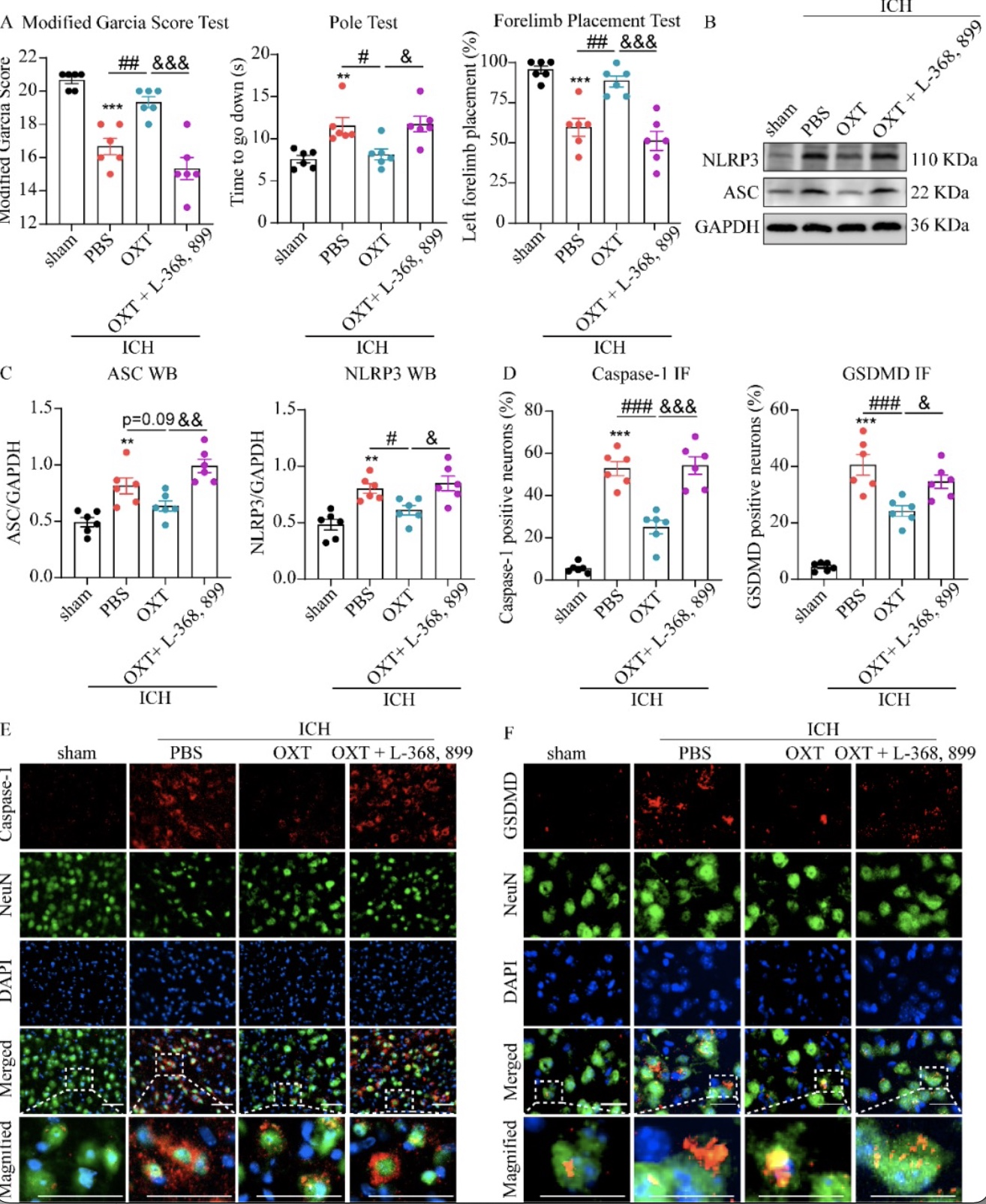
图2 OXT通过激活OXTR减轻短期神经功能缺损和神经元焦亡
细胞焦亡与神经炎症密切相关[5]。通过WB和IF实验,作者发现与sham组相比,ICH后第3天右侧纹状体中IL-1β和IL-18的相对蛋白含量显著增加(图3A)、血肿周围组织的IL-1β荧光强度明显增强、TNF-α+阳性的促炎型小胶质细胞数量增加(图3B-C)。OXT治疗减少了上述炎症因子和促炎型小胶质细胞的激活,而这一神经保护作用被L-368, 899抑制(图3A-B)。焦亡因子、炎症因子的大量释放可引起明显的神经元损伤、变性,该研究进一步使用FJC染色来检测变性神经元,发现OXT给药通过激活OXTR减轻了神经元变性(图3D)。
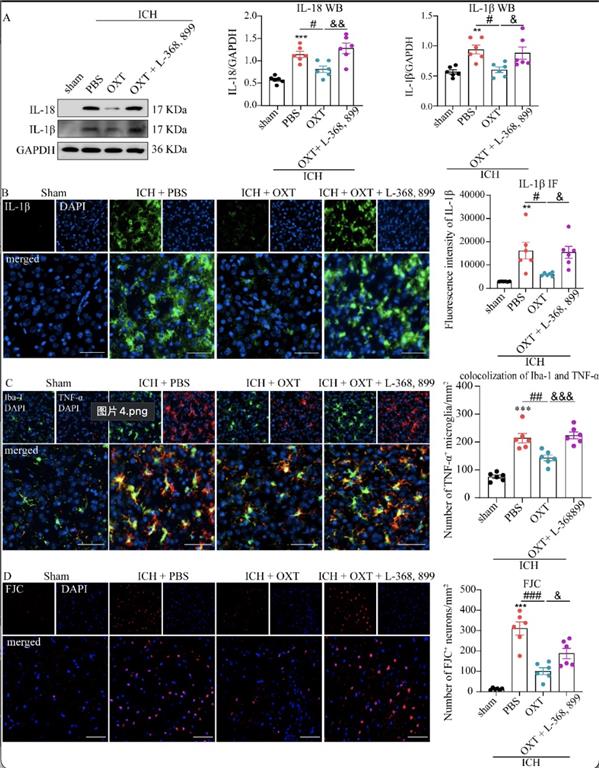
图3 OXT减少神经炎症和神经元变性
细胞焦亡过程中炎症因子的释放依赖于神经元膜上焦亡孔道的形成,这是细胞焦亡的主要特征之一。因此,作者利用透射电镜观察ICH后血肿周围组织神经元是否存在焦亡打孔。如图4A中红色箭头所示,ICH后第3天小鼠损伤侧纹状体的神经元细胞膜连续性中断,形成明显孔道。OXT给药组小鼠血肿周围的神经元细胞的结构完整、胞膜连续无中断(图4A)。通过电镜观察到神经元焦亡打孔的同时,作者亦报道了线粒体形态的改变。ICH组的神经元线粒体呈圆形、碎片化,伴有明显的肿胀、嵴塌陷和外膜破裂(图4A,绿色剪头)。OXT给药后线粒体形态明显好转,呈现轻度水肿,嵴清晰,结构延展,而L-368, 899处理组线粒体内部结构紊乱,肿胀明显(图4A)。
线粒体形态异常可引起ROS产生增多,继而加重细胞焦亡。因此,研究通过mitoSOX染色检测线粒体来源的ROS水平,发现OXT治疗显著降低了ICH后mitoSOX的荧光强度(图4B)。以上结果表明ICH后神经元的线粒体存在结构紊乱、功能失衡,导致组织氧化应激,而OXT通过激活OXTR减轻了线粒体氧化应激。
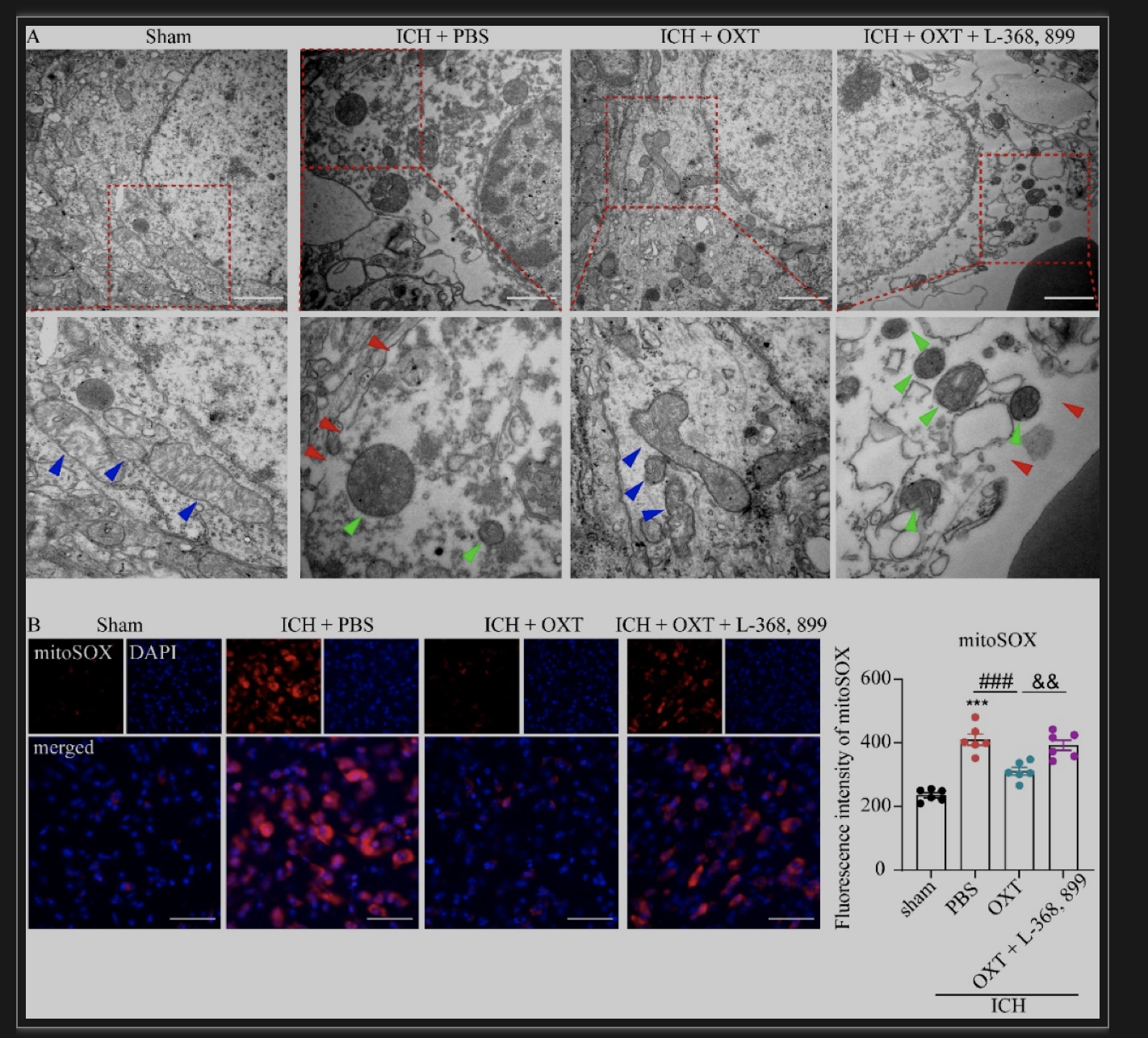
图4 OXT通过激活 OXTR减少焦亡孔和线粒体活性氧的形成
线粒体结构紊乱及ROS增加与线粒体过度分裂相关[6]。通过线粒体外膜蛋白TOMM20染色标记线粒体并统计线粒体的纵横比以量化其形态改变,该研究发现ICH后组织中线粒体碎片化明显,鼻内给予OXT治疗后ICH小鼠的线粒体纵横比有所恢复,而L-368, 899阻断了OXT的作用(图5A)。
线粒体分裂主要由分裂蛋白DRP1介导,DRP1需从细胞质募集到线粒体外膜才能促发分裂过程。p-PKA可介导DRP1 Ser637位点的磷酸化(p-DRP1(S637)),从而限制其从细胞质转移至线粒体,进而抑制线粒体分裂。该研究发现ICH后第3天,损伤侧纹状体中p-DRP1(S637)的蛋白水平显著降低、DRP1与线粒体的共定位增加(图5B-C)。OXT处理增加了p-PKA的含量以及DRP1在Ser637位点的磷酸化、减少了DRP1向线粒体的募集,运用OXTR抑制剂L-368, 899抵消了OXT的这一作用(图5B-C)。
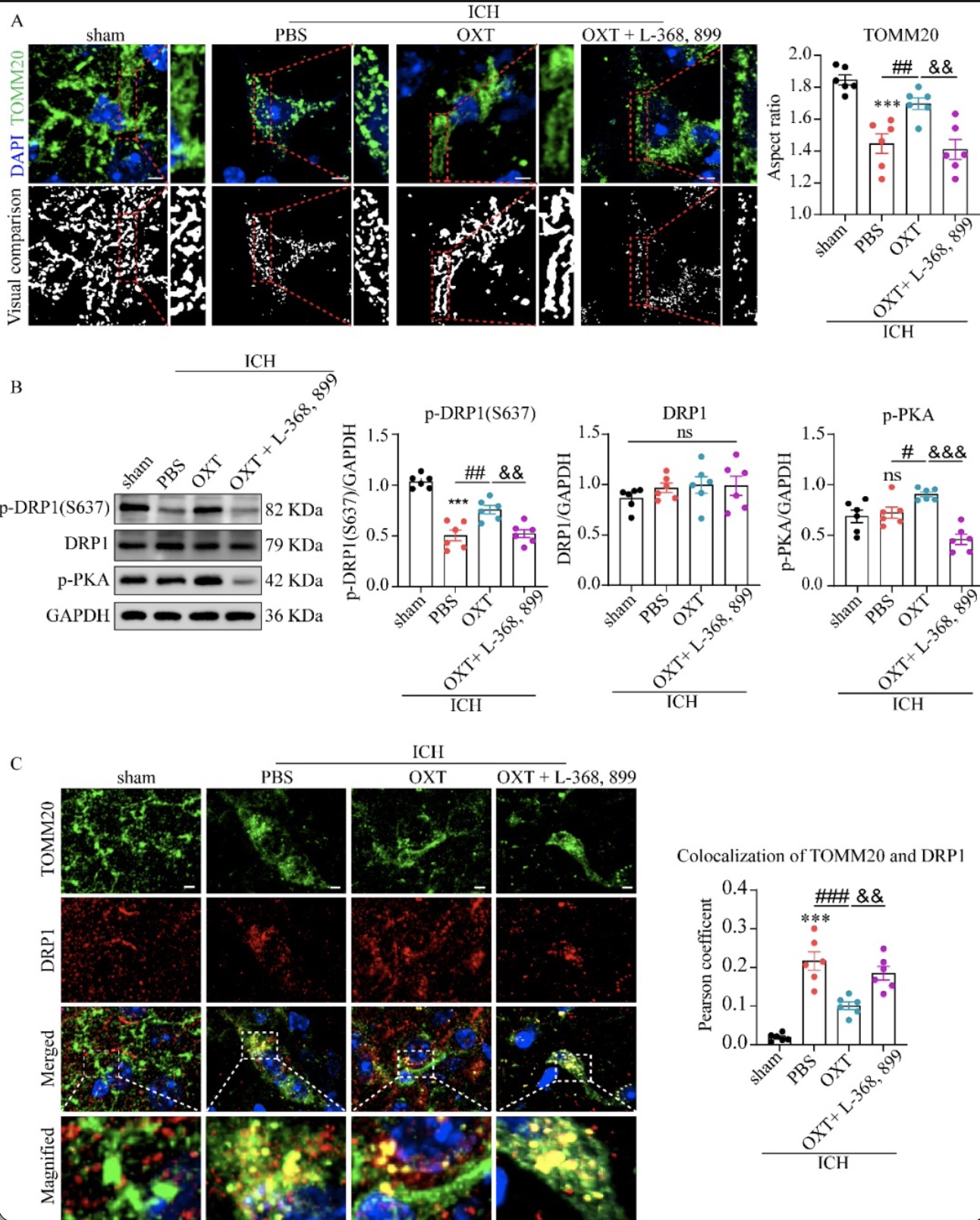
图5 OXT通过 p-PKA/DRP1途径抑制线粒体过度分裂
为了证实p-PKA信号通路在OXT的神经保护作用中的必要性,作者使用选择性p-PKA抑制剂H89以抑制p-PKA的活性,实验结果表明抑制p-PKA后,OXT无法发挥减少焦亡、炎症和线粒体分裂的神经保护作用(图6),可见p-PKA信号通路是OXT改善ICH预后的关键因子。

图6 p-PKA抑制剂H89阻断OXT的神经保护作用
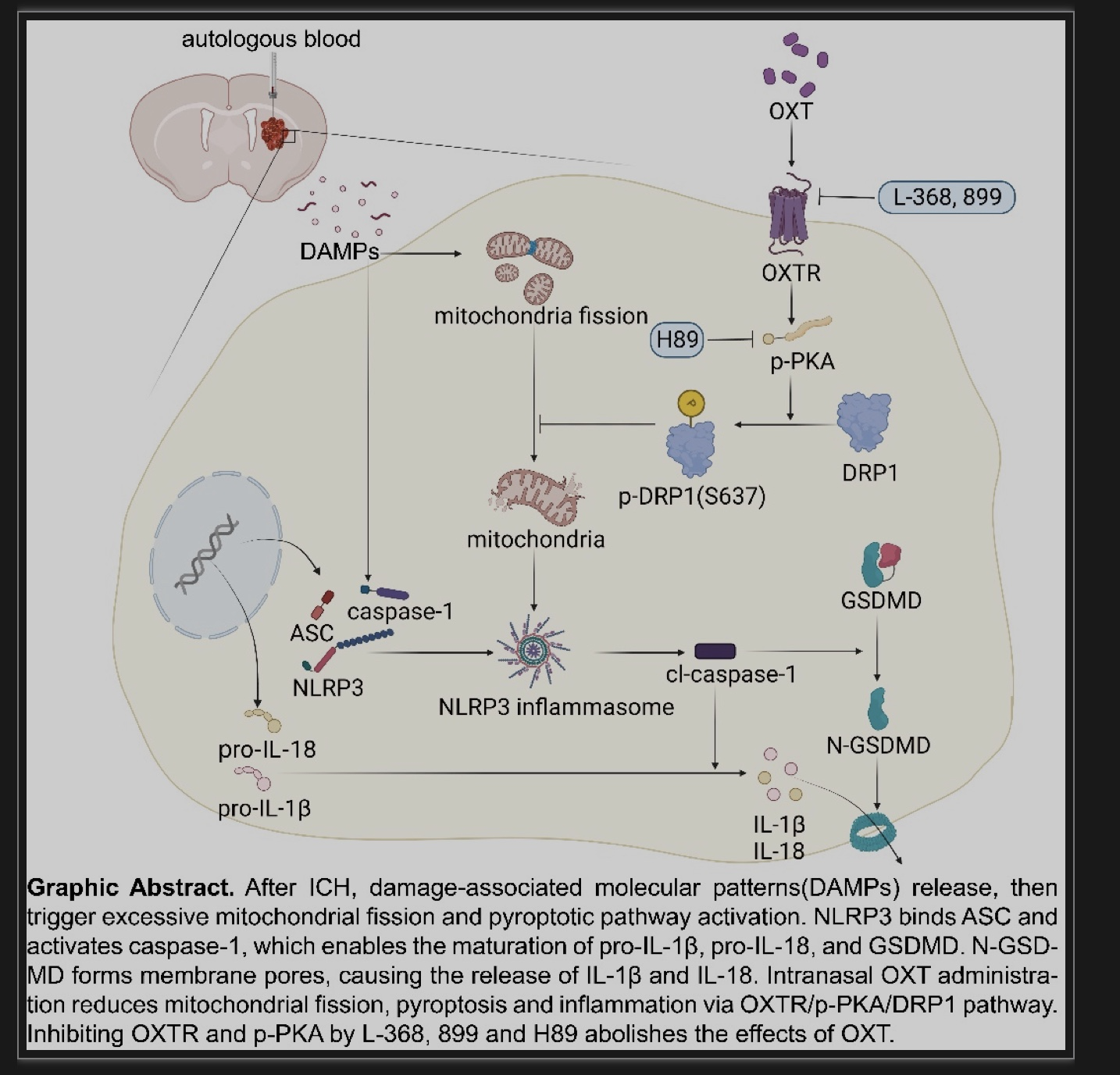
图6 文章总结图
该研究首次报道了ICH小鼠患侧纹状体中OXT水平明显降低,而OXTR含量升高(图6)。其次,OXT治疗可增加纹状体中OXT的含量,并改善了ICH小鼠的短期和长期神经功能损伤。同时,OXT通过激活OXTR减少了神经元焦亡和炎症。机制上,发现OXT通过激活p-PKA和增加DRP1 Ser637位点的磷酸化,以缓解线粒体过度分裂,并减少线粒体氧化应激水平,从而改善ICH小鼠的神经功能。作者揭示了经鼻OXT给药能够改善ICH小鼠的神经功能预后,提示OXT有望成为治疗ICH患者的有效药物,具有重要临床转化价值。然而,仍需进一步探索OXT对ICH后血肿占位效应、脑水肿、血脑屏障破坏、钙超载等病理过程的影响。此外,ICH小鼠对OXT的反应可能存在年龄和性别差异,仍需更深入的研究以阐明其作用和机制。

