7月14日,渤健(Biogen)向中国国家药品监督管理局药品审评中心递交ASO药物——托夫生注射液(Tofersen)的上市申请,并获得受理。此前,Tofersen获FDA加速批准上市,成为首个针对遗传性肌萎缩侧索硬化症的基因靶向疗法。

图片来自https://www.cde.org.cn/
肌萎缩侧索硬化症(ALS)是一种进行性神经退行性疾病,俗称“渐冻症”。疾病导致患者大脑与脊髓中的运动神经元丧失。随着疾病进展,ALS患者逐渐失去移动、说话、吞咽和呼吸等能力,ALS患者在确诊后平均寿命小于5年。
研究表明许多基因与该疾病相关,其中超氧化物歧化酶(SOD1)的突变蛋白与运动神经元退化有关。SOD1-ALS是遗传性或家族性ALS的第二种最常见形式,占家族性ALS的20%和所有ALS病例的2%。
Tofersen是渤健和Ionis联合开发的一款反义寡核苷酸(ASO)药物,针对超氧化物歧化酶1突变导致的肌萎缩侧索硬化症。ASO通过与SOD1 mRNA杂交,使SOD1 mRNA被使其被核糖核酸酶RNase-H降解,减少突变的SOD1蛋白生成。
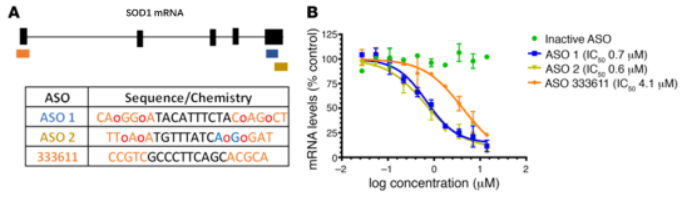
图片来自Antisense oligonucleotides extend survival and reverse decrement in muscle response in ALS models;ASO1和ASO2靶标到SOD1 mRNA的3’ UTR,此前报道的ASO 333611靶标到SOD1 mRNA的第一号外显子。ASO含有硫代磷酸骨架修饰(未修饰的磷酸二酯键用红色的o表示,橙色表明2’-MOE修饰,蓝色表明cEt修饰)。临床前实验表明ASO1与ASO2比ASO 333611生物活性更好,后续选择ASO1进行后续临床试验。
临床研究表明反义寡核苷酸BIIB067(tofersen)可以降低SOD1-ALS患者脑脊液中的SOD1蛋白的浓度,并且降低了血浆中与ALS进展相关的生物标志物神经丝蛋白轻链(NfL)的水平。

图片来自文献Trial of Antisense Oligonucleotide Tofersen for SOD1 ALS
Tofersen的上市拓宽了ASO药物的应用领域,证明了ASO药物的商业价值。渤健的研发管线中也有针对其他神经系统疾病的多款ASO药物。
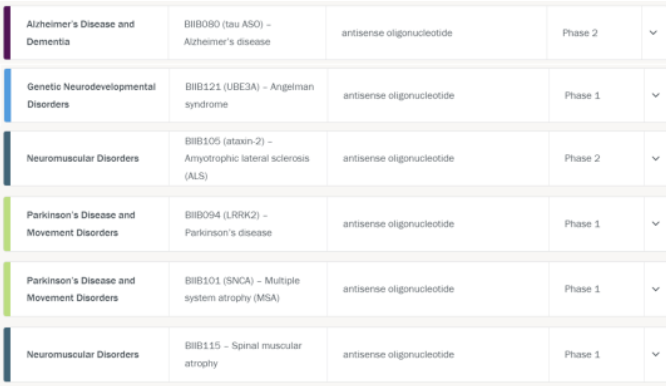
图片来自https://www.biogen.com/science-and-innovation/pipeline.html
何为ASO
ASO(antisense oligonucleotide,反义寡核苷酸)通常由12~25个核苷酸组成,进入细胞后可以与RNA进行碱基互补配对,通过不同的机制,调控基因表达。
ASO的探索起源于1978年的一项研究,作者在文章里设计了一条寡核苷酸靶向Rous肉瘤病毒的一段RNA序列,并表明这条寡核苷酸在组织培养基中可抑制病毒复制。此后关于ASO的研究广泛展开;19世纪80年代,研究者们开始将ASO应用到药物发现中。
ASO常见化学修饰
对ASO进行化学修饰主要目的是:增加ASO对靶标RNA的亲和力;增强ASO的核酸酶抗性;获得更好的药代动力学特性;减少免疫原性。随着人们对核酸结构、生化特性的理解,ASO的化学修饰目前聚焦在磷酸骨架和核糖上。
1. 磷酸骨架修饰
目前应用广泛的磷酸骨架修饰有硫代(PS)、磷酰二胺吗啉代(PMO)和肽核酸(PNA)。
PS修饰赋予ASO显著的核酸酶抗性。虽然每个硫代修饰会使ASO对靶标RNA结合的Tm值降低0.2℃~0.5℃,但是通过其他修饰,比如核糖2'位修饰可以得到弥补。
由于负电荷分布的差异,PS骨架相比于PO骨架亲脂性较高。这种特性使得PS修饰的ASO更好地与血浆蛋白结合,减少了ASO的肾脏排泄;同时也增加了细胞对ASO的摄取。
值得注意的是,硫代修饰后,形成了P手性中心,因此硫代修饰的ASO存在多个异构体;但目前仍没有确切的临床证据表明,硫代修饰ASO的异构体在药物作用或副作用上表现出差异。
PMO修饰增强了ASO的核酸酶抗性,却不影响ASO对靶标RNA的结合。但是PMOs在生理pH下呈中性,难以与蛋白结合,容易被肾脏代谢,意味着它需要更高的药物剂量。
PNA是一种非天然的核酸类似物,由重复的N-(2氨基乙基)甘氨酸单元组成,酰胺键取代了DNA分子的磷酸二酯键骨架,碱基则通过亚甲基羰基连接在甘氨酸的氮原子上。
由于是人工合成的产物,PNA可以抵抗核酸酶和蛋白酶的降解;PNA与DNA或RNA的杂交遵循碱基互补配对原则,并且杂交活性几乎不受盐浓度影响。与DNA或RNA不同,PNA骨架几乎不带电荷,使得PNA与DNA或RNA结合时并不受静电排斥力;因此PNA-DNA或PNA-RNA杂交双链比天然的DNA双链、RNA双链或DNA-RNA杂交双链都更稳定。
2. 核糖修饰
微小的改变可以发挥巨大的作用,DNA与RNA之间的差别也仅在与核糖2'位的羟基。ASO序列中进行核糖修饰可影响ASO对RNA的亲和力、酶抗性,以及ASO与靶标RNA结合后的生物活性。目前ASO中常用的2'位修饰有2'-MOE、2'-OMe。许多基于2'位修饰的研究表明2'-MOE极大地延长ASO的半衰期,减少免疫原性,提升了ASO的效力,是一个强有力的修饰。
除了上述提到的修饰,ASO中常见的核糖修饰还有LNA(锁核酸)和cEt(受约束的乙基)修饰。
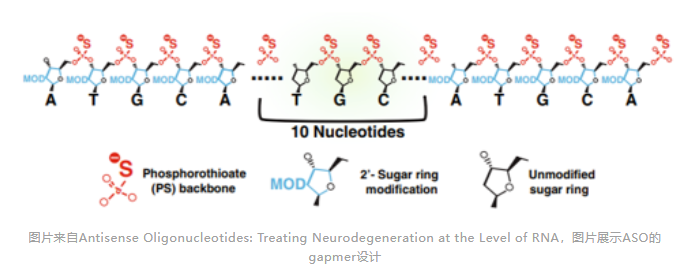
ASO发挥作用的机制
ASO发挥作用的机制可以分为两大类:结合介导的降解和结合引起的干扰。
RNase-H介导的水解是目前研究最深入的机制。RNase-H可识别DNA-RNA杂交双链并导致靶标RNA水解。研究表明ASO-RNA复合物要作为RNase-H的底物,ASO中至少需要5个连续的脱氧核苷酸基团,在具有8~10个脱氧核苷酸时,酶活性达到最佳。因此ASO利用RNase-H降解RNA时,通常具有一个8~10个脱氧核苷酸组成的中心区域,两侧则是2'修饰的核苷酸。
另外也有研究表明,ASO有不依赖于RNase H的mRNA降解途径。
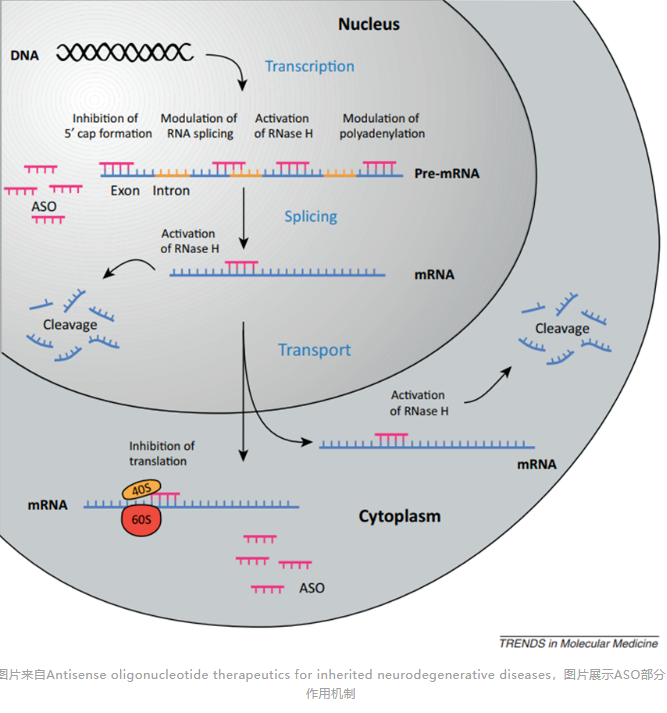
除了降解靶标mRNA外,ASO可以利用空间占位对mRNA进行调控。在这类机制中,ASO不需要RNase-H起作用,而需要ASO与靶标RNA之间较高的亲和力。ASO利用空间占位机制发挥作用大致可细分为以下几个机制:
1. 阻断mRNA翻译。mRNA需要经过翻译才能表达为蛋白发挥功能。ASO通过与mRNA结合,翻译相关蛋白对mRNA的识别或结合,阻断mRNA的翻译,从而降低基因表达。
2. 切除mRNA 5'端帽子结构。有文章报道利用ASO裂解mRNA的帽子结构,抑制mRNA的翻译。
3. 调节mRNA多聚腺苷酸化位点。ASO也可通过与前体mRNA的多聚腺苷酸化位点结合,影响mRNA多聚腺苷酸化位点的选择,从而影响mRNA的稳定性。
4. 调控mRNA剪接。mRNA剪接需要剪接信号和相关蛋白的配合,是一个精细调控的过程,具有序列特异性。ASO通过与前体mRNA杂交,阻碍了剪接相关蛋白与前体mRNA结合,从而调控mRNA剪接。该策略的经典例子为已上市的ASO药物Nusinersen。
除了以上的机制,ASO也可通过与miRNA结合间接调控mRNA,或与mRNA上游的翻译调控元件结合,影响mRNA翻译。
图片来自Antisense oligonucleotide therapeutics for inherited neurodegenerative diseases,图片展示ASO部分作用机制
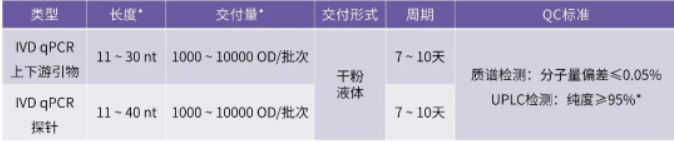
安升达引物合成服务内容
可单批次合成1000 OD~ 10000 OD IVD引物及探针
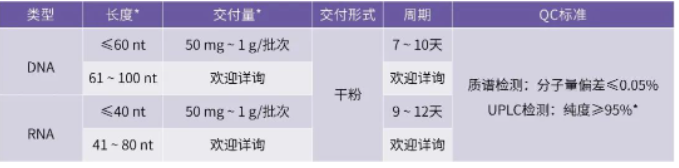
可单批次合成从毫克到克级高纯度DNA/RNA Oligos

* 其他长度、交付量、纯度欢迎详询
服务优势
安升达引物合成部门深耕寡核苷酸合成领域十余年,拥有丰富的引物合成经验,产品受到国内外客户广泛赞誉;除常规的技术支持外,专业的研发团队也可以提供更多个性化的解决方案。
参考文献:
[1] McCampbell A, Cole T, Wegener AJ, et al. Antisense oligonucleotides extend survival and reverse decrement in muscle response in ALS models. J Clin Invest. 2018;128(8):3558-3567. doi:10.1172/JCI99081
[2] Miller TM, Cudkowicz ME, Genge A, et al. Trial of Antisense Oligonucleotide Tofersen for SOD1 ALS. N Engl J Med. 2022;387(12):1099-1110. doi:10.1056/NEJMoa2204705
[3] Southwell AL, Skotte NH, Bennett CF, Hayden MR. Antisense oligonucleotide therapeutics for inherited neurodegenerative diseases. Trends Mol Med. 2012;18(11):634-643. doi:10.1016/j.molmed.2012.09.001
[4] DeVos SL, Miller TM. Antisense oligonucleotides: treating neurodegeneration at the level of RNA. Neurotherapeutics. 2013;10(3):486-497. doi:10.1007/s13311-013-0194-5
[5] Pellestor F, Paulasova P. The peptide nucleic acids (PNAs), powerful tools for molecular genetics and cytogenetics. Eur J Hum Genet. 2004;12(9):694-700. doi:10.1038/sj.ejhg.5201226

