线粒体是真核细胞的能量供应中心,且线粒体形态、组成和发挥的功能在不同的环境刺激及细胞和组织中表现出明显差异。线粒体的研究从聚焦于线粒体形态改变发展到系统性线粒体组学,研究者逐渐认识到线粒体在不同细胞组织间甚至单个细胞内从形态到组成上的异质性。细胞和组织间的线粒体异质性与组织修复、稳态维持和免疫调节等生理过程息息相关,关于不同细胞、组织来源的线粒体组学测序结果阐明了线粒体异质性的分子基础。在多种疾病发生过程中,有关于阿尔兹海默病、心肌疾病、非酒精性肝炎、肌无力等相关疾病线粒体异质性的研究表明,靶向特定组织细胞线粒体,以缓解异常线粒体积累和氧化压力增加,进而改善临床上疾病预后进程。
文章总结了线粒体形态和组成成分在不同组织、器官上的异质性,并对当前的线粒体分离和组学等前沿技术,和潜在的靶向线粒体差异性的治疗手段进行了讨论。该综述突出了线粒体在不同器官来源疾病的特异性特征和潜在机制,以及未来线粒体异质性研究的最新进展和发展方向,为新型的线粒体靶向治疗在临床上的应用提供了理论基础。
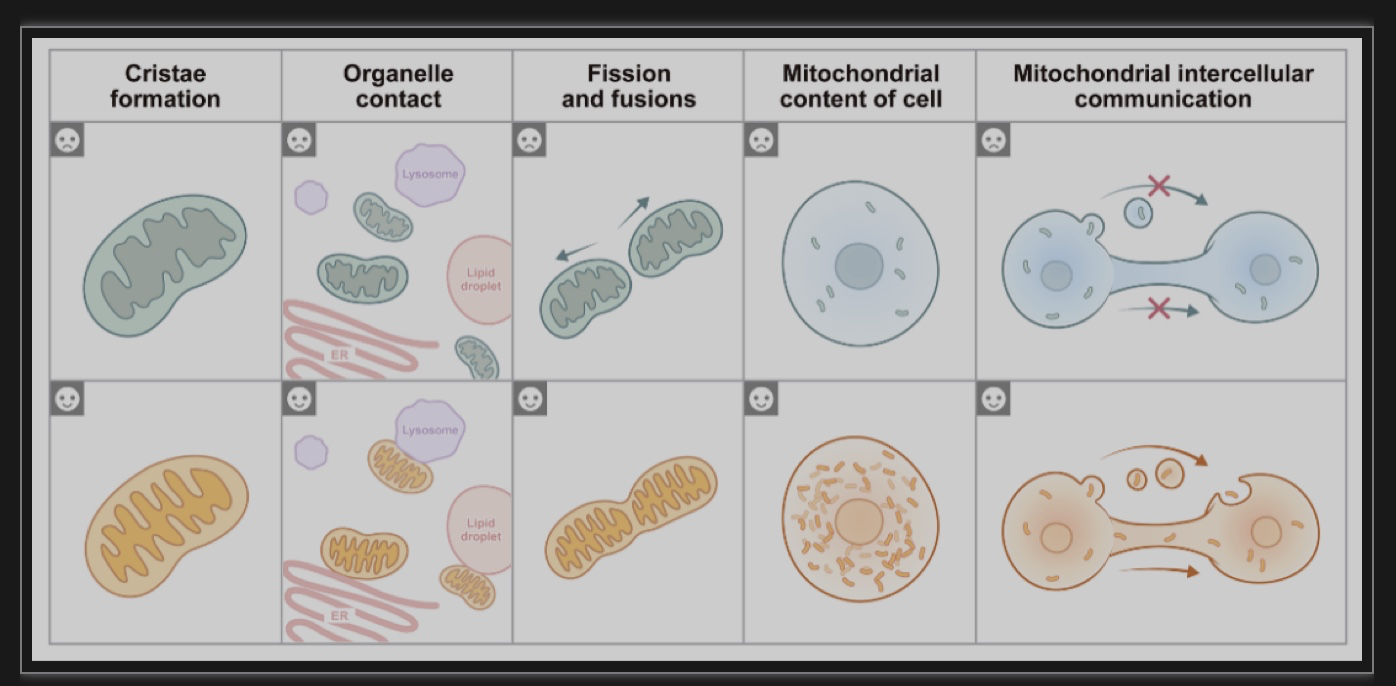
在哺乳动物细胞线粒体研究进程中,基于线粒体荧光标记技术和成像技术的发展,总结了线粒体内嵴的数量、线粒体和内质网、溶酶体等细胞器的接触、不同组织、器官的线粒体形态,细胞内线粒体含量、以及线粒体在细胞间转移等形态特征均具有显著差别。
组织细胞内线粒体嵴含量与细胞及组织对于能量的供应需求相关,通常认为代谢活动旺盛的细胞或者组织线粒体嵴含量高于代谢活动低的细胞或组织(图1)。
图1 线粒体在细胞能量代谢失稳或环境胁迫条件下的形态学特征,与线粒体在生理条件下健康的形态学特征。线粒体嵴密度与细胞能量低有关;线粒体与其他细胞器的接触,如内质网、溶酶体和脂滴;线粒体分裂和融合;细胞内线粒体的含量;在生理和病理条件下,细胞间线粒体转移。
OPA1、Yme1L、MICOS、Sam50和ATAD3A等蛋白介导了线粒体内嵴的形成,同时线粒体内嵴含量也受到线粒体融合和裂解的分子机制调控,并且直接影响了器官发育、损伤修复和癌变等过程。线粒体与溶酶体和内质网等细胞器的接触对于耦合线粒体和其他细胞器间的代谢过程十分重要。而线粒体的含量受到线粒体的生物发生降解过程的调节,且与细胞及组织对于能量的供应需求相关,通常认为代谢活动旺盛的细胞或者组织线粒体含量高于代谢活动低的细胞或组织。例如在寒冷刺激下,棕色脂肪组织的线粒体生物生成增加,增强其细胞的线粒体代谢速率,进一步促进产热。细胞间的线粒体转移同样具有多种形态,线粒体通过囊泡(EVs)、纳米管(TNTs)和裸露的线粒体等途径从供体细胞转移到受体细胞中。
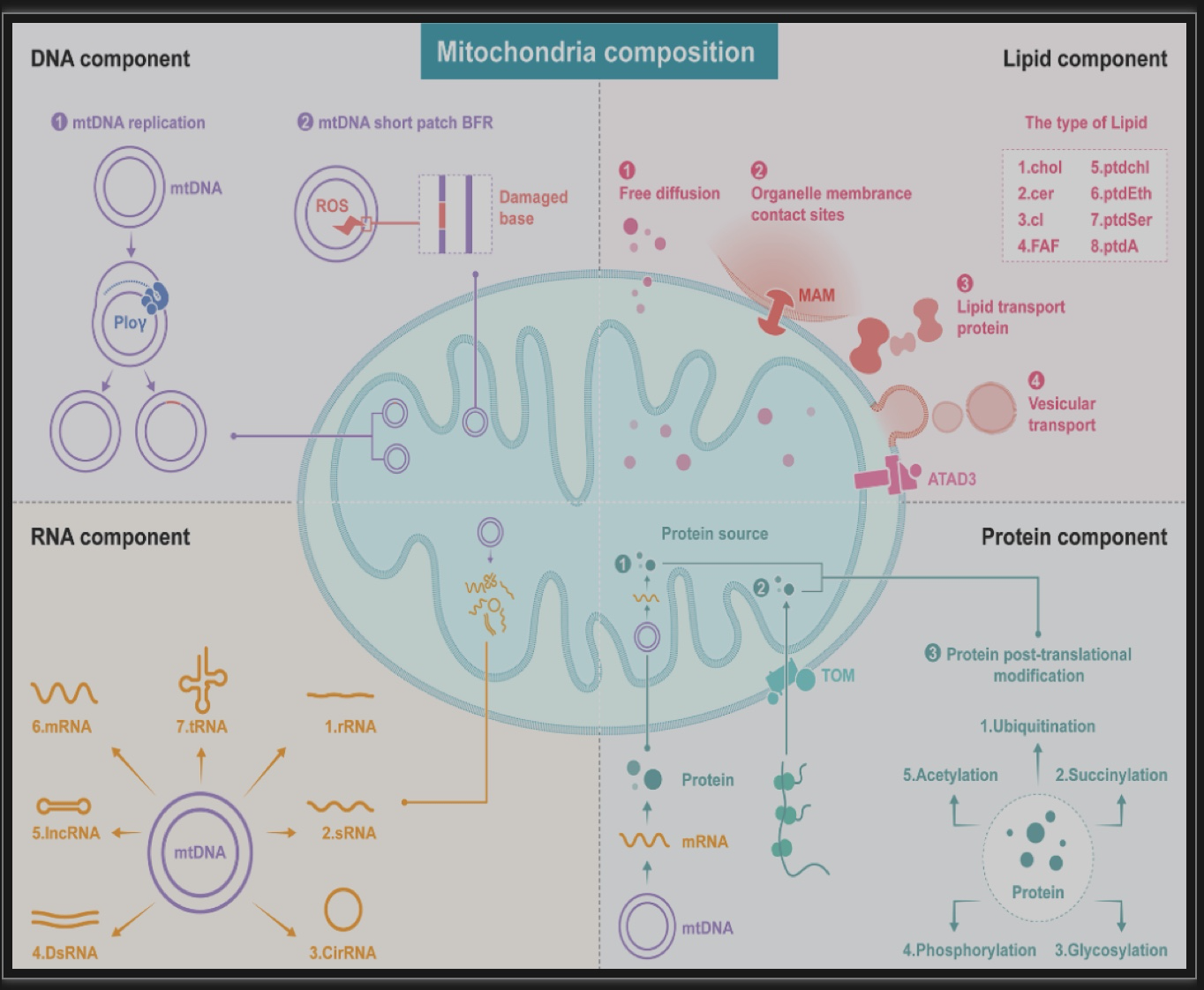
线粒体由线粒体基因组,转录的RNA,核基因和线粒体基因编码的蛋白以及组成线粒体膜的脂质分子构成。随着线粒体组分的分离和测序技术的进步,研究发现线粒体组分构成不仅在组织器官间存在显著差异,甚至是在单个细胞内,其线粒体组分构成也存在显著差异。例如神经细胞内,细胞突触线粒体和细胞胞体线粒体的蛋白组学测序结果存在显著差异。
不同器官来源的疾病模型中,病理条件下的细胞或组织线粒体基因组、转录组和蛋白组的突变位点具有特异性。文章进一步总结线粒体基因组突变、RNA转录水平差异、蛋白质含量和翻译后修饰的差异以及线粒体脂质成分改变的异常改变与多种疾病发生的关系(图2)。
图2 线粒体组分的异质性。DNA组成:线粒体基因组的多样性来自线粒体基因组复制过程中的碱基错配和mtDNA短补丁碱基切除修复(BER)后的碱基突变。RNA组分:线粒体基因组转录本包括rRNAs、sRNAs、CircRNAs、dsRNAs、IncRNAs、mRNA和tRNAs。蛋白质组分:线粒体蛋白质组的多样性源于两种主要的蛋白质输入途径,即核编码蛋白的输入途径和线粒体蛋白质的翻译途径。此外,线粒体蛋白通过复杂的翻译后修饰机制发生改变。线粒体脂质的异质性是由四种相关的脂质运输途径引起的,包括自由扩散、细胞器膜接触、脂质转运蛋白和囊泡转运。
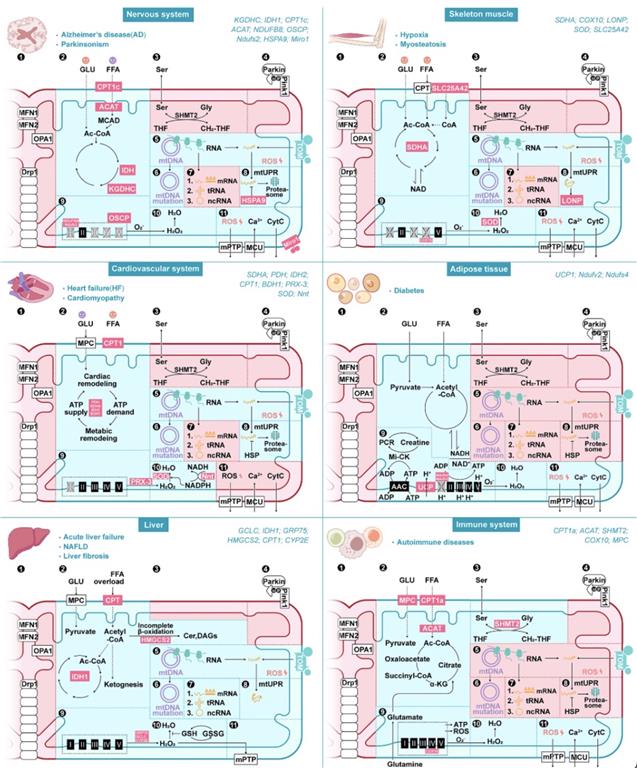
线粒体作为哺乳动物细胞的能量供应工厂,其与器官病变产生和疾病进程紧密相关。作者总结了脑、心脏、肝脏、肌肉、脂肪与免疫细胞等组织器官的线粒体异质性以及在疾病发生过程中线粒体的特异性突变位点。
线粒体不仅是细胞能量代谢的主要途径,还发挥着基因组转录和翻译、氨基酸,脂质以及核苷酸的代谢、钙平衡、细胞凋亡信号转导和氧化还原的功能。线粒体特异性位点的突变与特定器官来源疾病相关,作者总结了包括阿尔兹海默症、帕金森病、心肌梗死、非酒精性肝炎、肌无力,肥胖和免疫缺陷等疾病条件下潜在的线粒体突变位点,其中涉及到组织线粒体基因,转录和蛋白组翻译和修饰的改变(图3)。
图3 组织中线粒体异质性的比较。组织线粒体蛋白质组有显著差异的途径。病理状态以青色标记,线粒体蛋白质组学结果或线粒体途径无显著差异与线粒体蛋白质组学结果无关的变化被标记为粉红色。
线粒体的能量代谢途径以及非折叠蛋白反应(UPRmt)的功能异常加速了阿尔兹海默症和帕金森病的疾病进程,其中三羧酸循环的关键酶包括丙酮酸脱氢酶(PDH)、α-酮戊二酸脱氢酶(KGDHC)和异柠檬酸脱氢酶1(IDH1),氧化呼吸链复合体Ⅰ的关键组分NADH:泛醌氧化还原酶B8亚基(NDUFB8)的、NADH:泛醌氧化还原酶核心亚基S2(NDUFS2)和ATP合酶的组分寡酶素敏感相关蛋白(OSCP)和脂代谢关键酶肉碱棕榈酰转移酶1C(CPT1C)或乙酰辅酶A乙酰转移酶1(ACAT)等特异性位点与神经退行性疾病进程的恶化关系紧密。而神经系统的线粒体非折叠蛋白反应相关基因如(HSPA9、HSP60、YMEL1L)在病理条件下会补偿性升高表达量,靶向抑制HSPA9基因表达会导致β-淀粉样蛋白的毒性增加。
在心肌系统来源的疾病进程中,线粒体的代谢途径和ROS积累反应加速了心肌疾病恶化进程,其中三羧酸循环的关键酶包括丙酮酸脱氢酶(PDH)、琥珀酸脱氢酶(SDHA)和异柠檬酸脱氢酶1(IDH2),脂质代谢的肉碱棕榈酰转移酶1C(CPT1C)和3OH-丁酸脱氢酶(BDH1)等特异性位点的功能异常加速心肌疾病的恶化。而心肌组织线粒体的ROS的过度积累会加速心肌的损伤,超氧化物歧化酶(SOD)和抗氧化蛋白(PRX-3)在心肌组织的ROS损伤积累过程发挥重要作用,心肌组织特异性敲除SOD的高脂饮食小鼠模型在4月龄时死亡,暗示了线粒体的ROS清除维持了心肌系统的稳定。另有研究发现心肌组织中特有的ROS清除反应,通过烟酰胺核苷酸转氢酶(Nnt)逆转NADH和ATP反应生成NADPH,增强NADPH相关的抗氧化反应。
在肝脏疾病进程中,线粒体的代谢反应、ROS的积累以及异常蛋白的积累加速了非酒精性肝炎和肝硬化的疾病进程,其中肝脏器官线粒体脂质代谢的生酮关键酶3-羟基-3-甲基戊二酰辅酶a合成酶2(HMGCS2),生脂反应关键酶线粒体甘油-3-磷酸乙酰转移酶(GPAM)以及脂肪代谢途径的肉碱棕榈酰转移酶1C(CPT1)和氨基酸代谢途径的丝氨酸代谢关键酶丝氨酸羟甲基转移酶1(SHMT1)和丝氨酸羟甲基转移酶2(SHMT2)对于维持肝脏的丝氨酸合成途径以及降低肝脏脂肪加工压力发挥重要功能。
在骨骼肌系统中,Ⅰ型肌肉纤维和ⅡA型肌肉纤维和Ⅱ型肌肉纤维的线粒体组分具有显著差异,Ⅰ型肌肉纤维和ⅡA型肌肉纤维具有更高丰度的氧化呼吸链和脂质代谢相关蛋白。而在骨骼肌得病理条件下,线粒体的代谢途径和ROS反应和异常蛋白得积累加速了骨骼肌无力、衰老和二型糖尿病的进程。氧化呼吸链组分蛋白ATP合酶β亚基(ATP5F1B)以及三羧酸代谢和脂质代谢相关的173种蛋白发生显著改变。同时,线粒体Lon蛋白酶同源物(LONP)清除骨骼肌线粒体异常蛋白,当LONP异常时,骨骼肌线粒体蛋白积累导致肌无力相关病理改变。
在脂肪组织中,线粒体相关的代谢途径与脂肪组织产热关系密切,定位于线粒体内膜的解耦联蛋白1(UCP1)是脂肪组织的产热功能的关键蛋白,棕色脂肪组织在寒冷刺激的条件下,线粒体数量增加,形态改变,快速激活棕色脂肪组织的产热功能。而白色脂肪细胞的线粒体功能更多倾向于合成代谢,以促进脂肪的存储和氧化。而在二型糖尿病的病理条件下,脂肪组织线粒体的三羧酸循环、氧化呼吸链反应和脂质代谢功能均受损,而ROS在脂肪细胞线粒体内积累。氧化呼吸链组分蛋白NADH:泛醌氧化还原酶核心亚基V2(NDUFV2)和NADH:泛醌氧化还原酶亚基S4(NDUFS4)等特异性位点的改变诱导脂肪组织的脂肪异常积累,ROS反应酶(MnSOD)对于减轻脂肪细胞的线粒体的ROS积累至关重要。
而在免疫系统中,线粒体对于免疫细胞发挥其正常功能至关重要,线粒体的代谢反应、ROS生成和氨基酸代谢在免疫细胞发挥功能的过程中参与调节了免疫细胞的活化和吞噬作用。在巨噬细胞吞噬病原体过程中,巨噬细胞线粒体的ROS生成增加以促进病原体的失活;T细胞活化反应过程中,线粒体的丝氨酸代谢途径激活促进了T细胞的存活和活性,有趣的时,体外添加丝氨酸等代谢底物,衰老的活性化T细胞活性增强。氧化呼吸链组分蛋白细胞色素c氧化酶装配因子血红素A:法尼基转移酶(COX10)的T细胞特异性敲除导致了细胞的增殖受损和小鼠的早夭,提示了线粒体在免疫细胞的正常功能维持的关键作用。
当前临床上针对于线粒体功能障碍的治疗策略主要针对于缓解线粒体的氧化损伤、碳压力和促进线粒体生物生成等方面。
在靶向线粒体氧化损伤方面,临床上应用抗氧化剂,如MitoQ和CoQ10等,MitoQ和CoQ10通过清除异常积累的氧化压力以达到减缓心肌损伤和神经退行性疾病进程。在靶向缓解线粒体碳压力上,临床上通过补充烟酰胺单核苷酸(NAM)或者线粒体代谢抑制剂,如MitoSNO等,NAM可以补充线粒体NAD+库和降低线粒体蛋白乙酰化底物浓度以实现缓解心肌缺血再灌注导致的能量供应不足的损伤,而MitoSNO作为线粒体复合体I的抑制剂,可以降低ROS的生成以缓解心肌能量供应不足所导致的损伤。在靶向促进线粒体生物生成的功能上,临床上主要通过促进PGC1α或抑制DRP1活性,如抗糖尿病药物吡格列酮(pioglitazone)、罗西格列酮(rosiglitazone)和5-氨基咪唑-4-甲酰胺核糖核苷酸(AICAR),吡格列酮和罗西格列酮可以通过增加PGC1α的表达水平来增强线粒体的生物生成。AICAR是PGC1α的激动剂,通过激活PGC1α活性来增强线粒体的生物生成。作者总结了相关治疗策略在临床上的应用,并且结合线粒体基因编辑技术的最新进展,评述了线粒体基因组编辑在临床上的应用潜力。
传统的生物化学和分子方法促进了我们对于线粒体异质性的理解。对线粒体多组学的系统研究对于我们理解线粒体异质性形成和维持的分子机制具有更深入的了解。对此,基于清除线粒体致病的mtDNA突变和联系疾病表型与线粒体功能异常机制仍然十分具有挑战性,靶向干预线粒体以缓解多器官来源的病理进程的治疗方案为缓解疾病进展提供新思路。