糖尿病肾病(Diabetic kidney disease)是糖尿病患者的主要并发症之一,同时也是全球慢性肾病和终末期肾病的主要原因[1]。糖尿病病人的早期肾损伤缺乏典型症状,起病隐匿,当体检或就诊时往往已经达到中晚期。目前主要治疗方案是通过控制血糖血压延缓糖尿病肾病的进展,但由于缺乏针对糖尿病肾病本身的治疗方案,导致其治疗难度大,预后差,最终进展至终末期肾病。因此,积极探索糖尿病肾病初期的发病机制、寻找新的诊断生物标志物和治疗靶点,对糖尿病肾病的预防、诊断及治疗有着重要的临床价值。
肾小球是肾组织中过滤血液生成原尿的重要结构,对肾脏的过滤功能起到决定性作用。在糖尿病早期,肾小球对高血糖产生应激反应,导致滤过功能亢进(glomerular hyperfiltration),从而导致自身发生病理学病变[2]。肾小球病变是糖尿病肾病最早的改变,也被认为是导致肾小球硬化和最终肾脏衰竭的关键原因[1]。保持肾小球滤过率对糖尿病肾病的治疗和预后具有重要意义。然而目前尚不完全清楚肾小球在应激反应中发生的关键信号通路。该研究是第一个对早期糖尿病肾病在单细胞层面上的全面综合性分析。过去对糖尿病肾病的研究具有时间点上的局限性并缺乏对肾小球细胞在单细胞层面上的深入分析。在此项研究中,研究者们利用糖尿病小鼠模型研究糖尿病肾病初期的发病机制、结合单细胞和bulk RNA测序分析,发现并验证了机械敏感转录通路在糖尿病肾病初期应对肾小球滤过功能亢进的应激反应。此信号通路对肾小球硬化导致的终末期肾病起到关键性作用。值得关注的是,对来自不同临床中心病人组群的肾脏样本测试结果表明,此信号通路在与肾小球滤过功能亢进相关的慢性肾病中均具有激活反应,这意味着机械敏感转录通路可作为潜在的肾小球靶点用于治疗慢性肾病(图1)。

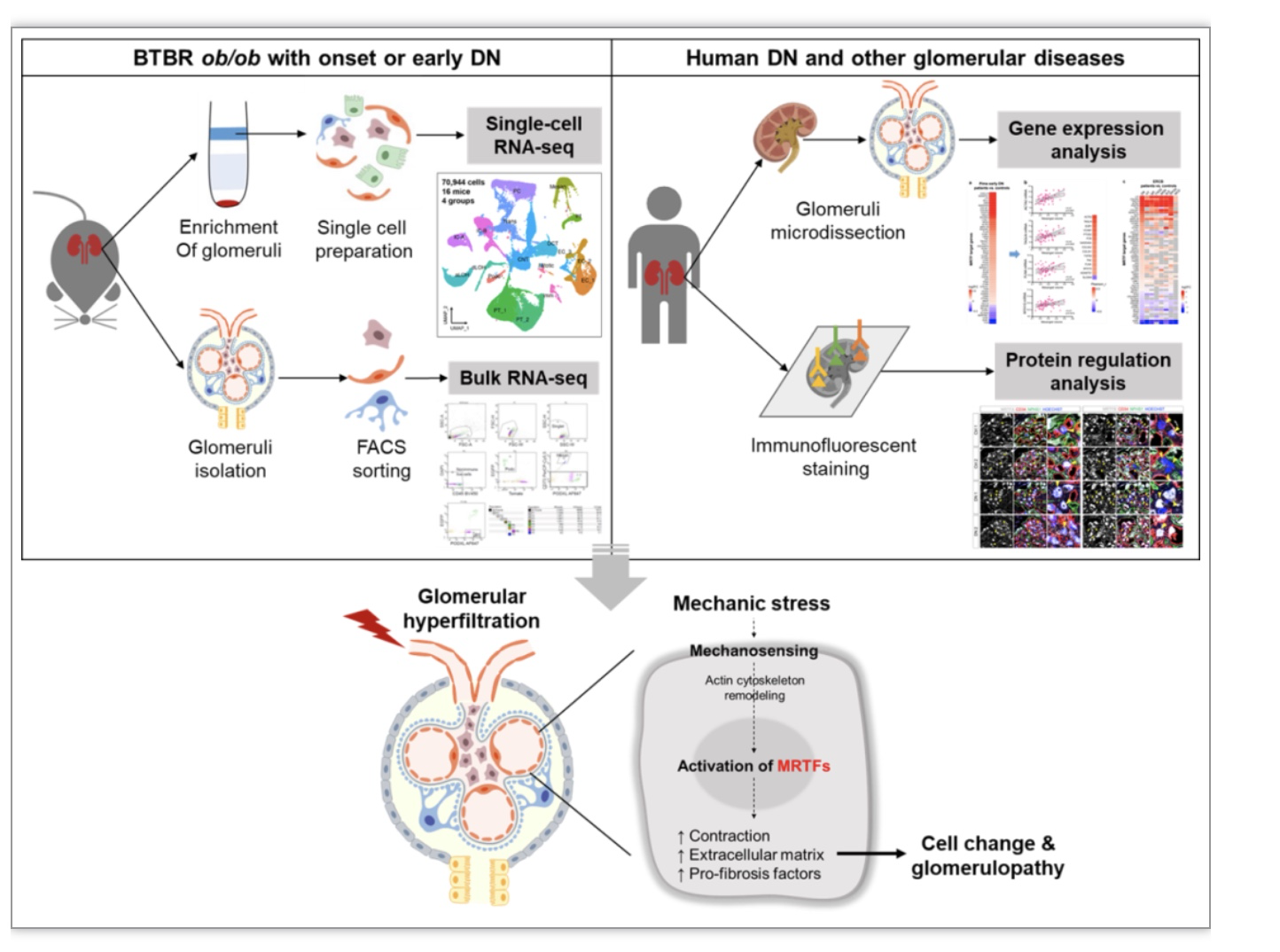
图1. 实验方案设计及主要结论
(图源:Liu, et al., Genome medicine, 2023)
为了研究糖尿病肾病早期发生的细胞和分子变化,研究者们使用BTBR ob/ob小鼠作为二型糖尿病肾病疾病模型。基于各项生理指标,将6周龄和12周龄分别定义为糖尿病肾病的起始阶段和早期阶段。作为此项研究的重要对象,肾小球在肾脏组织中占比很小,肾小球细胞类型属于肾脏中的稀有细胞类型,在常规整肾单细胞分离和抓取过程中容易流失,导致在单细胞分析中难以被检测到或者数量极少,无法进行有意义的生物信息学分析。为此,研究者改进了单细胞分离操作流程,通过密度梯度离心(Percoll)富集肾小球组织,从而显著提高了肾小球细胞类型在单细胞中的比例和数量,同时也显著提高了单细胞测序的深度和分辨率。研究者共对来自16只小鼠肾脏组织的70,944个单细胞进行了分析并鉴定出18种细胞类型(图2b-c)。
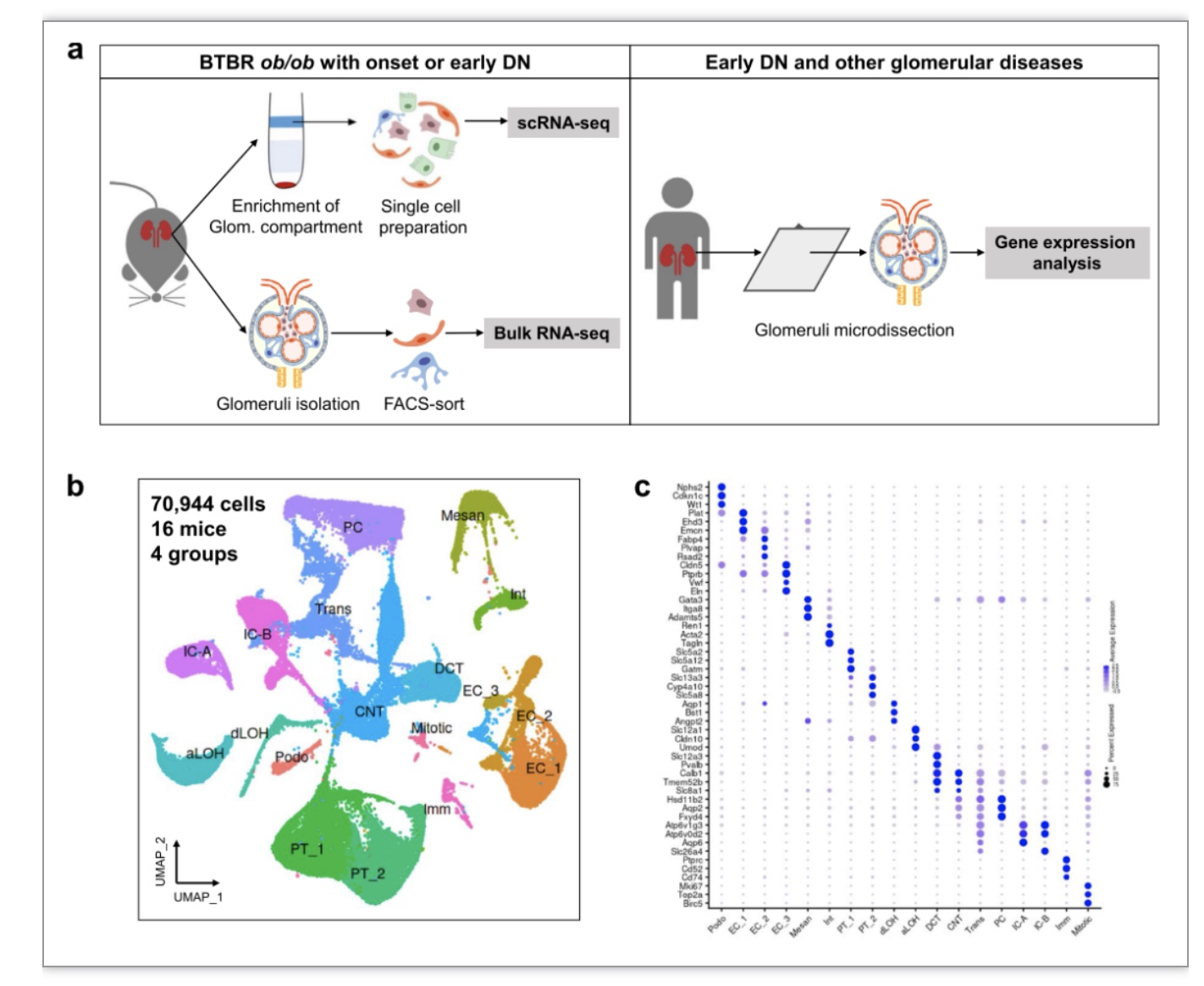
图2b-c. BTBR ob/ob小鼠肾脏早期糖尿病肾病的测序分析
(图源:Liu, et al., Genome medicine, 2023)
研究者们依次比较了各个细胞类型中糖尿病肾病与对照组肾脏的基因表达水平差异。在所有细胞类型中,肾小球系膜细胞(Mesan)和近曲小管细胞(PT)的差异表达基因(DEGs)数量最高(图2d),表明这两种细胞类型在糖尿病肾病的早期阶段受到主要影响。富集分析表明,在糖尿病肾病早期PT细胞类型多种代谢过程发生变化,属于葡萄糖依赖性反应(图2e)。而肾小球细胞类型显示细胞外基质分子、细胞粘附、细胞增殖等的调节,以及细胞对机械压力、细胞因子和血压的反应等葡萄糖非依赖性反应(图2f)。由此可见,高血糖只对肾小管产生直接的显著影响,肾小球细胞对高血糖并不敏感。
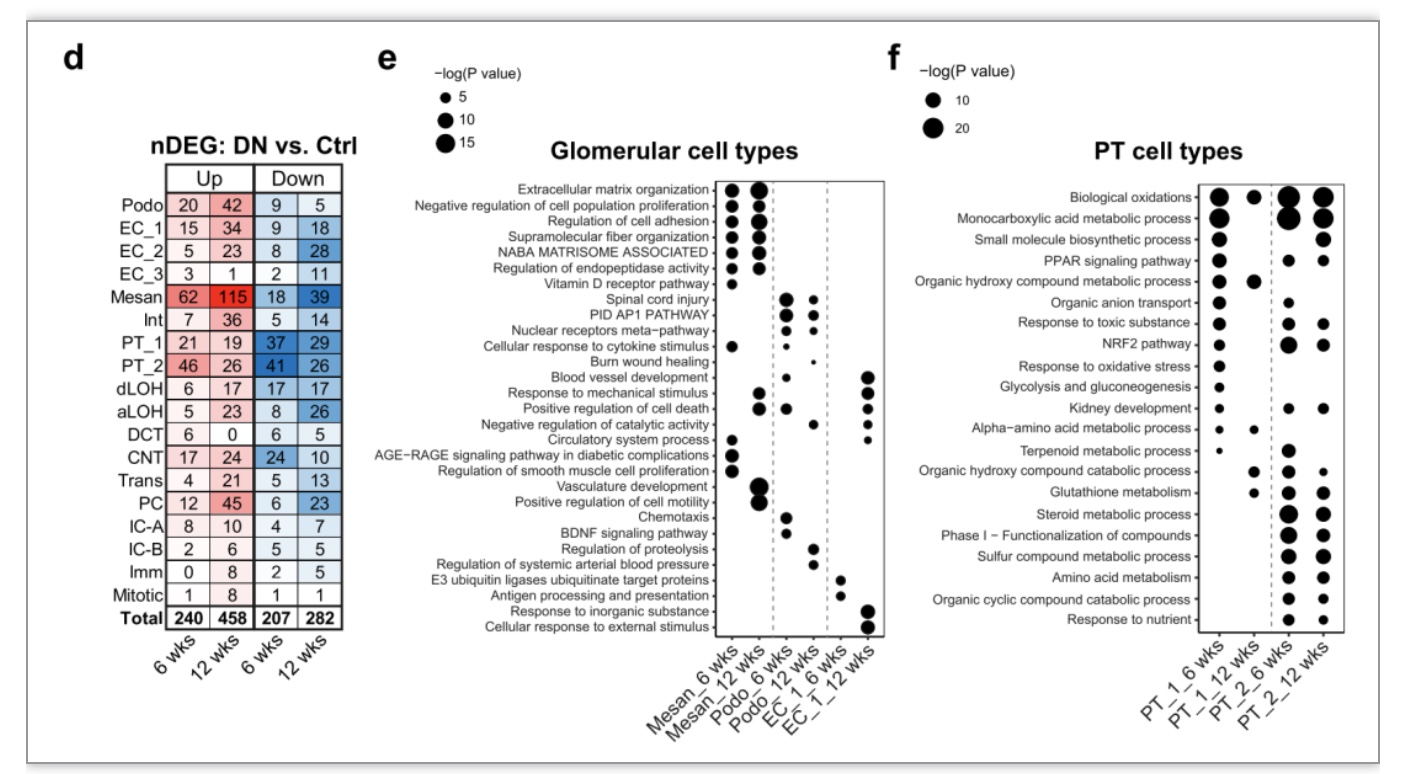
图2d-f. 糖尿病肾病肾脏各个细胞类型中差异表达基因和功能富集分析
(图源:Liu, et al., Genome medicine, 2023)
研究者们利用细胞流式分选仪建立了纯化肾小球三大主要细胞类型的方法,对其进行了bulk RNA-seq深入分析,并将此结果和scRNA-seq结果进行了比较分析,确定了194个基因在两个数据集重叠 (图3左)。研究者们在欧洲肾脏样本库(ERCB)查看了这些基因的表达情况,发现有106个基因也在糖尿病肾病患者的肾小球样本中有着显著的差异性表达。通过对这些保守基因的上游转录调控分析(IPA上游转录调控分析和SCENIC转录因子分析),研究者们发现系膜细胞的转录调控在糖尿病肾病初期占主导地位,其中机械敏感转录调节因子(MRTF-SRF)被显著激活(图3a-b)。
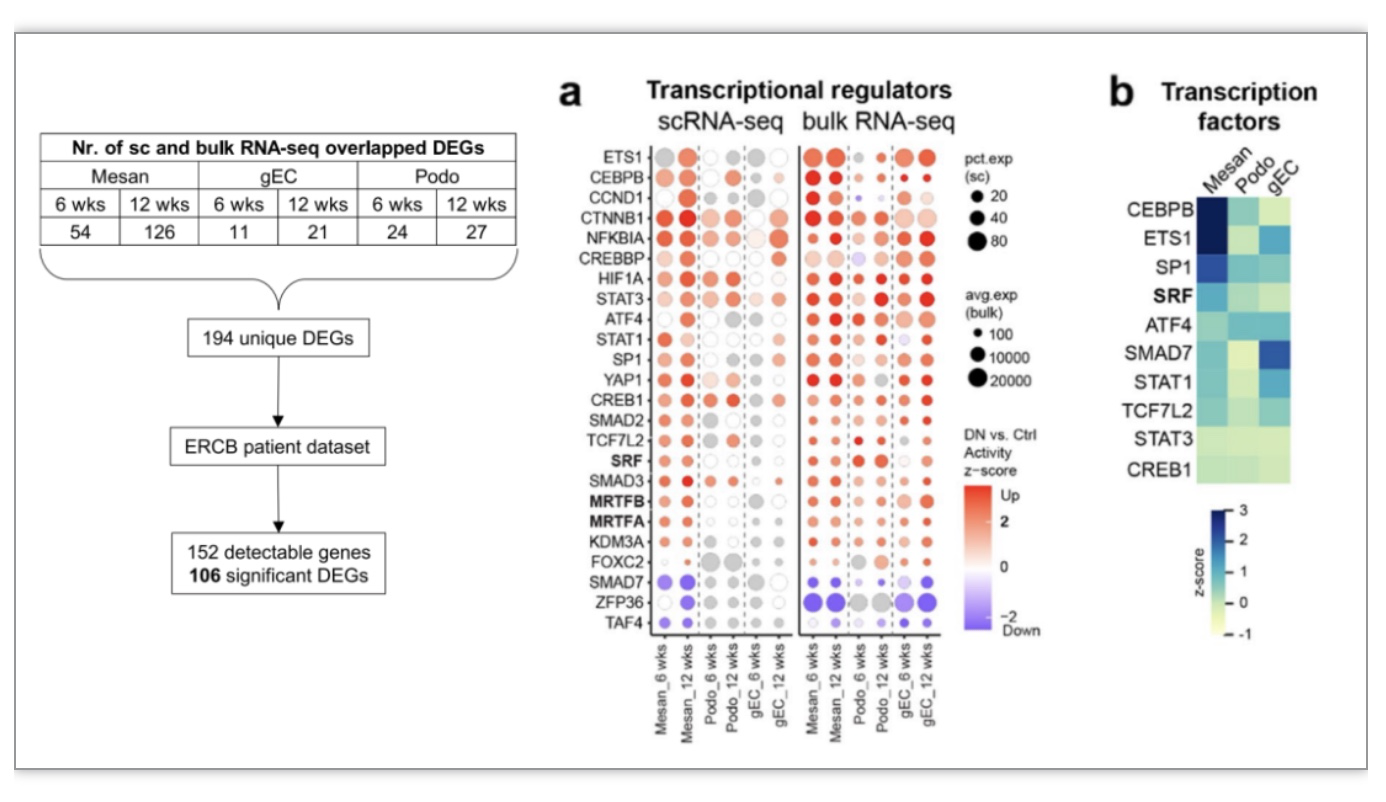
图3. scRNA-seq和bulkRNA-seq联合分析及转录调控富集分析
(图源:Liu, et al., Genome medicine, 2023)
为了确认MRTF-SRF转录调控通路在早期糖尿病肾病患者中的活性,研究者们调查了美国Pima印第安人早期糖尿病肾病队列中MRTF-SRF转录靶基因的表达,发现在小鼠糖尿病肾病中明显变化的靶基因在人类早期糖尿病肾病中也有明显的调节(图4a)。其中一些关键靶基因与系膜体积呈正相关(图4b)。对ERCB数据的进一步分析显示,MRTF-SRF转录靶基因在糖尿病肾病和动脉高血压等机械压力相关疾病,以及狼疮性肾炎(SLE)和IgA肾病等肾小球硬化疾病中也有差异表达,但在Minimal Change Disease(MCD)这种不涉及系膜细胞病变的肾脏疾病中却没有明显变化(图4c)。
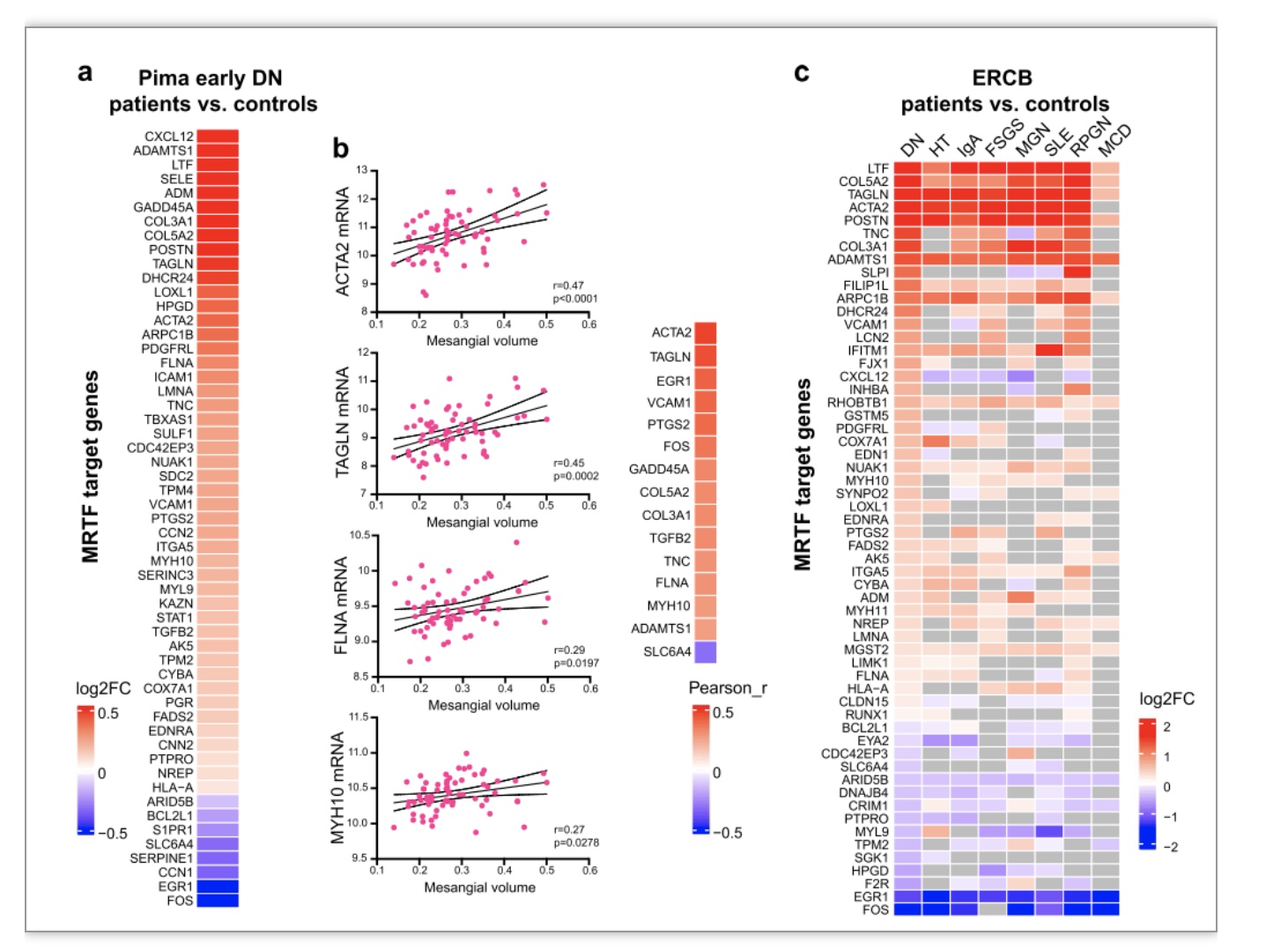
图4. MRTF转录靶基因在糖尿病肾病患者肾小球中上调
(图源:Liu, et al., Genome medicine, 2023)
由于MRTF-SRF转录调节在小鼠和人类糖尿病肾病中都被激活,且主要是在系膜细胞中,研究者们进一步探索了系膜细胞的标记基因。这些基因编码负责感知和转导机械信号的跨膜蛋白,包括机械敏感离子通道、G蛋白偶联受体、整合素和钙粘蛋白等(图5a)。此外,研究者们用CellChat软件分析了糖尿病肾病中细胞间通讯的变化。与对照组小鼠相比,糖尿病肾病肾脏中的间质细胞与所有其他细胞类型的相互作用发生了显著变化(图5b)。
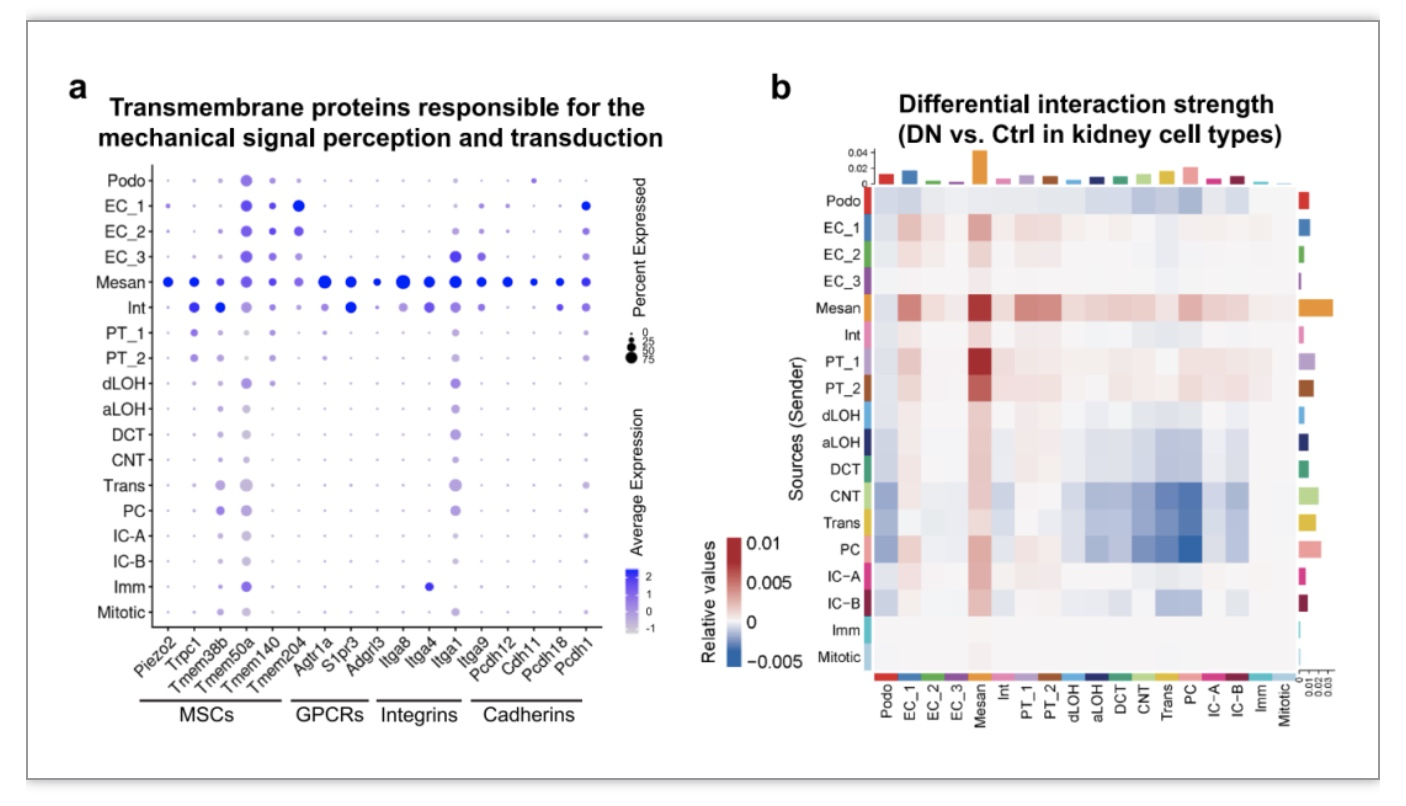
图5. 糖尿病肾病小鼠中系膜细胞与其他细胞相互作用增强
(图源:Liu, et al., Genome medicine, 2023)
肾小球滤过率增加可能是导致慢性肾病的一个常见上游机制[2]。由于机械敏感信号通路MRTF-SRF是纤维化相关机械反应的核心协调者,研究者们推测肾小球高滤过率可能直接激活MRTF-SRF,导致糖尿病肾小球病变相关的细胞变化。重要的是,研究者推测这一反应与糖尿病条件下的高血糖无直接关系。为了验证这个假设,研究者们进行了离体肾脏灌注实验。此模型模拟正常血糖、但肾小球过度过滤的病理条件。研究者们比较了灌注与未灌注条件下的基因表达。在体外灌注的小鼠肾小球中(图6a),差异表达基因的上游分析显示了MRTFA/B、SRF和YAP1这些机械敏感信号通路的激活和一系列相关信号通路的变化(图6b)。研究者进一步在大型动物(猪)上重复了此项实验 (图6d),通过单细胞核RNA测序(图6e)同样发现在单纯的肾小球过度过滤的条件下,MRTFA/B、SRF和YAP1这些机械敏感信号通路在猪的肾小球细胞中被激活(图6h,i)。这些发现支持了上述假设,即机械敏感信号通路的激活是应对肾小球高滤过的一个通用机制。
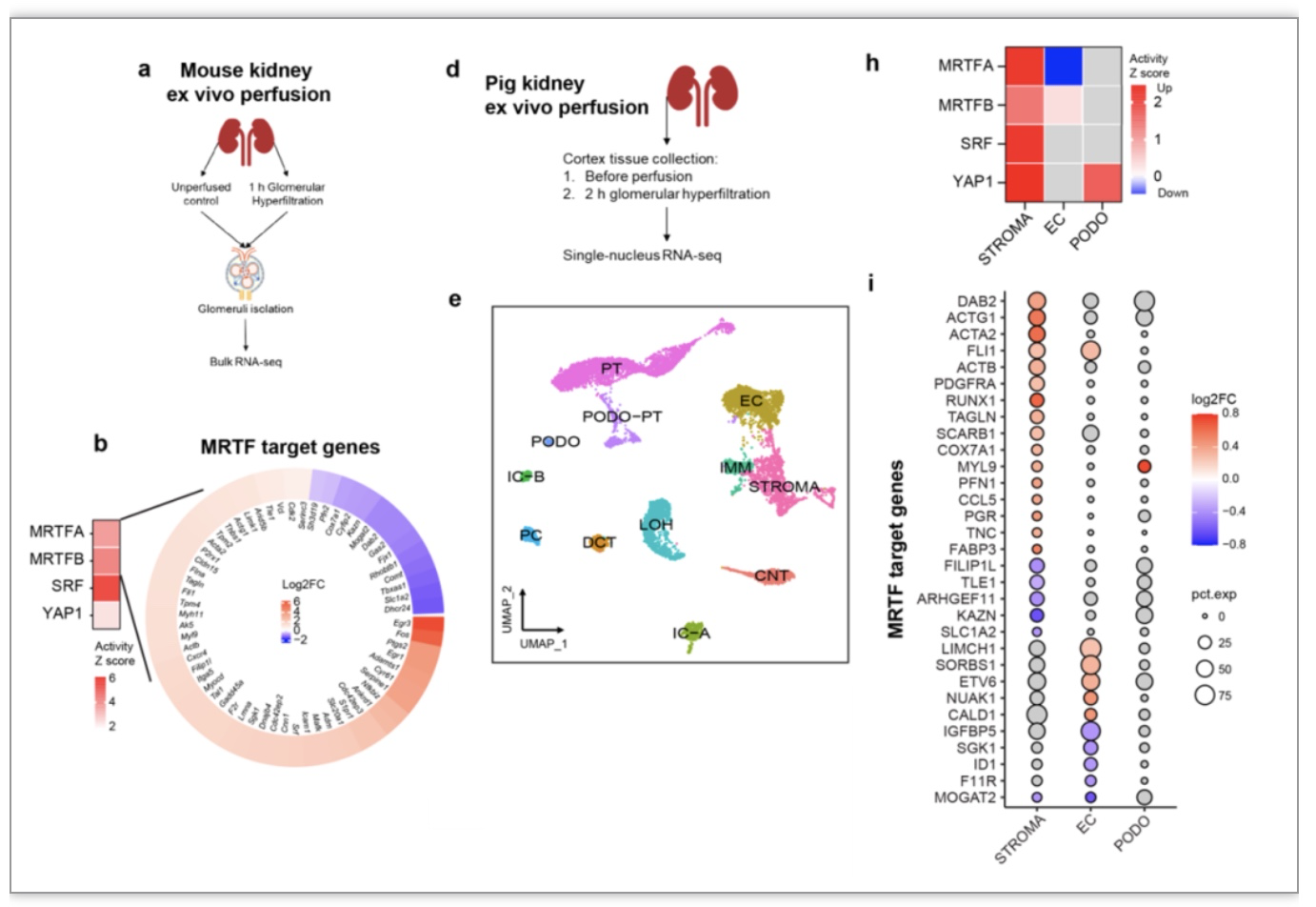
图6. 肾脏离体灌注激活机械敏感信号通路
(图源:Liu, et al., Genome medicine, 2023)

