
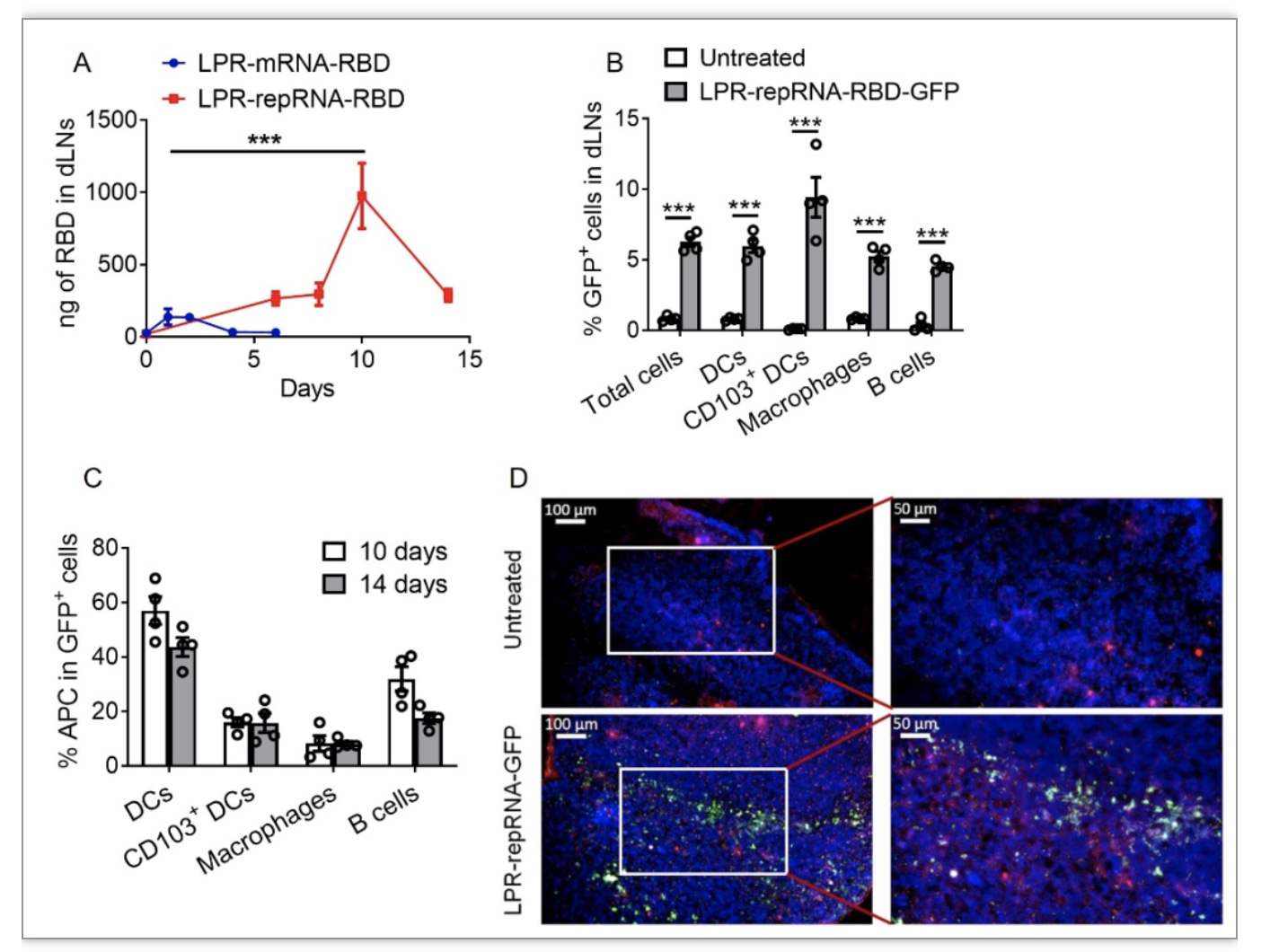
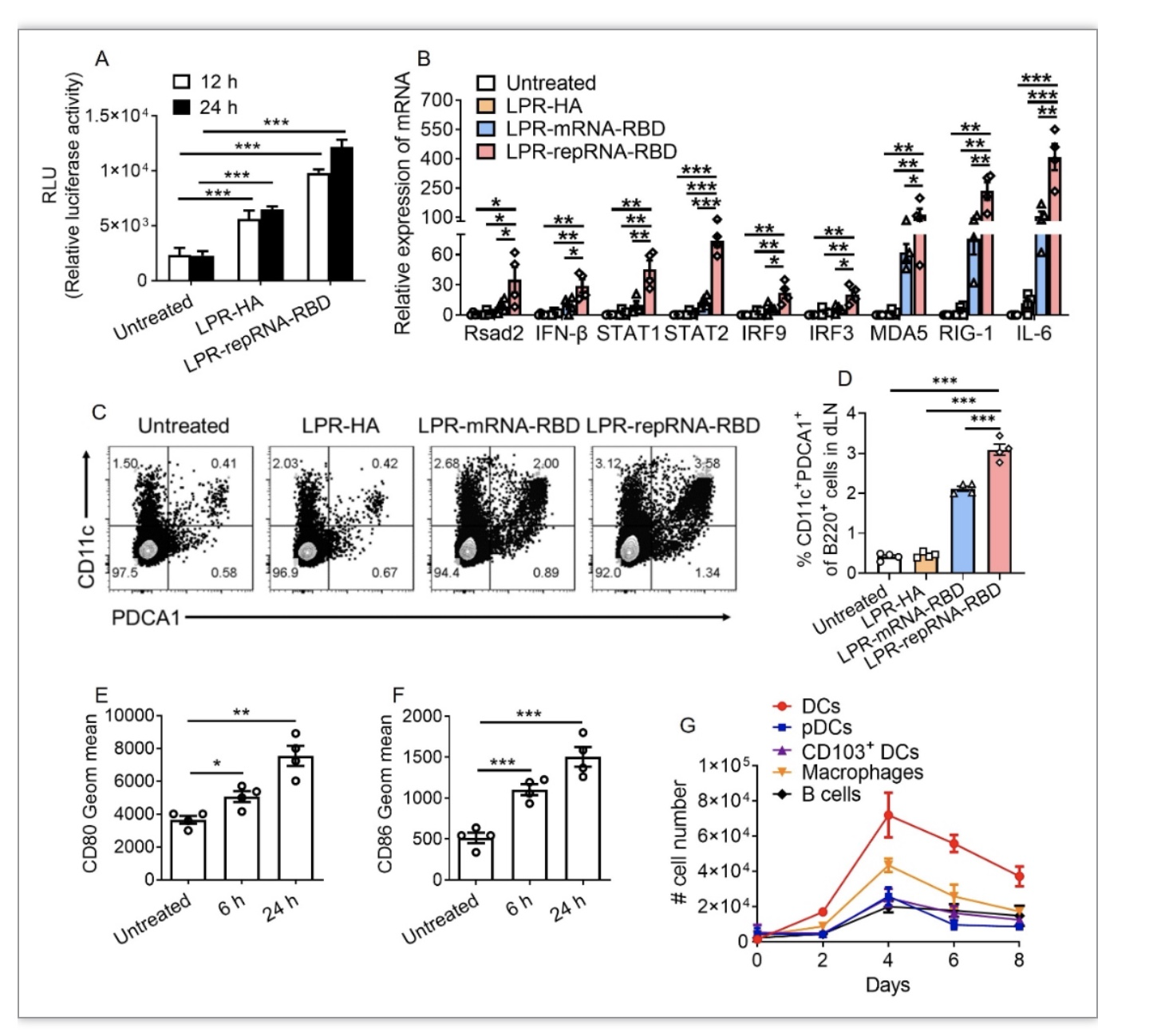
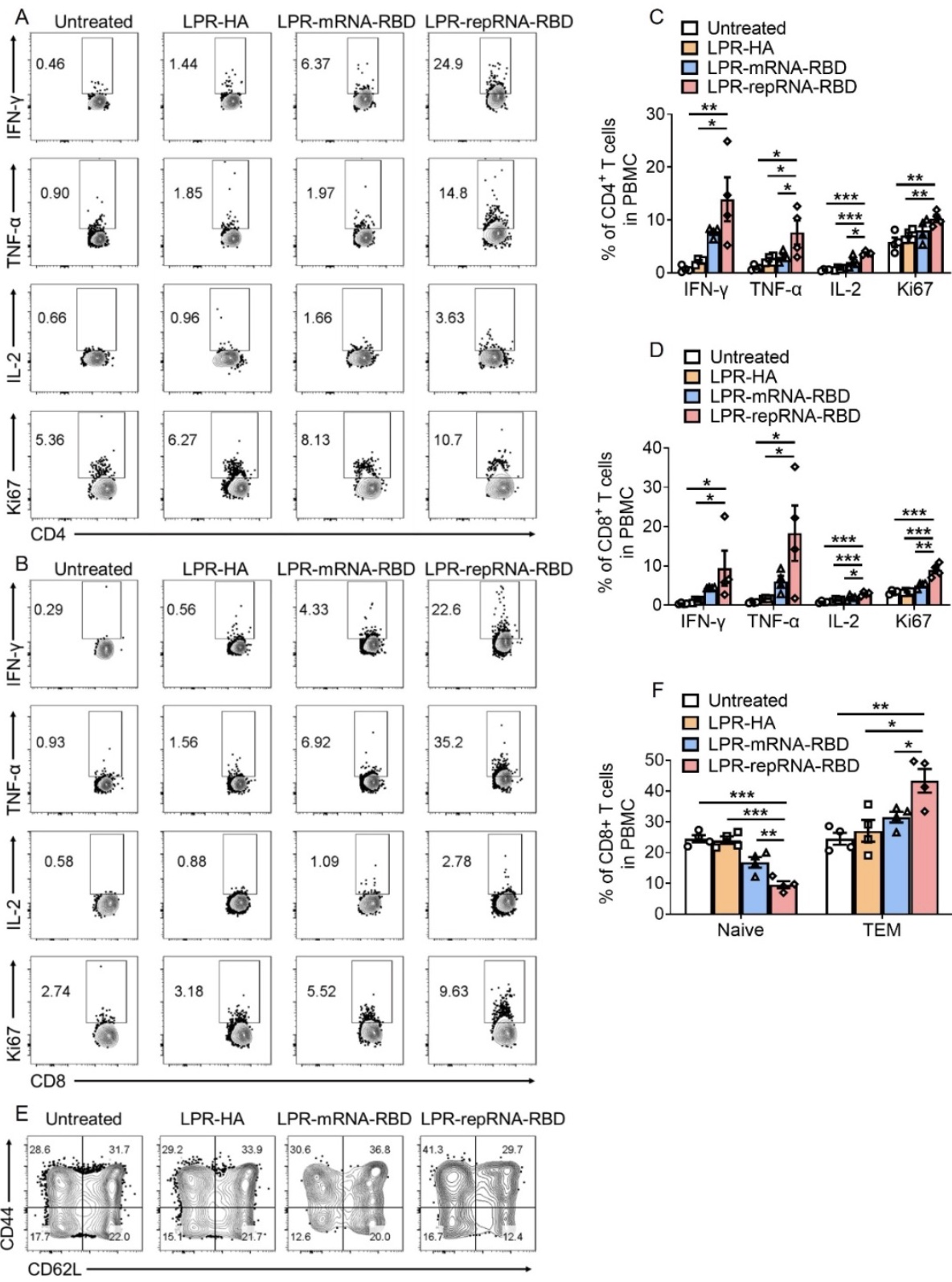
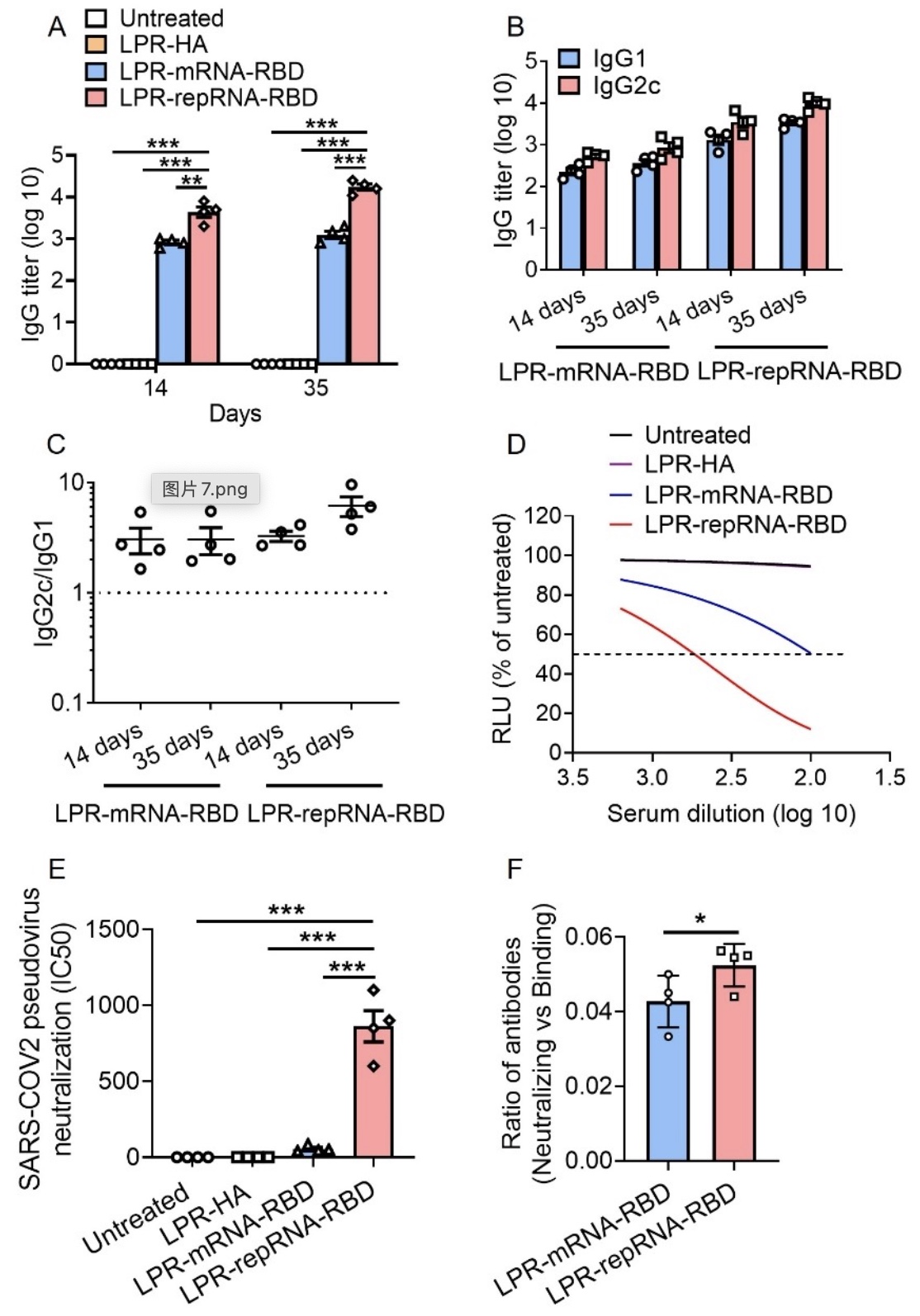

综上所述,该研究基于自我复制型RNA技术编码SARS-CoV-2 RBD,应用脂质体-鱼精蛋白递送系统开发了LPR-repRNA-RBD纳米疫苗。该疫苗能够在引流淋巴结中长时间表达RBD抗原,促进引流淋巴结的先天免疫反应和免疫细胞的浸润,从而激发抗原特异性的细胞免疫反应和体液免疫反应,为小鼠提供在SARS-CoV-2感染过程中的保护作用。该研究也存在一些不足之处,比如与Spike蛋白全长相比较,RBD结构域的免疫表位相对较少,导致其诱导的免疫保护作用相对较弱。此外,LPR系统的递送效率还有进一步改善的空间。研究者将在后续的研究中针对上述问题进行深入探究,以开发更为理想的新冠病毒RNA纳米疫苗。

