异常转化的上皮细胞经历扩增-侵袭前病变(pre-invasive lesion),最终变成不可控制的恶性肿瘤。肿瘤中累积的基因突变会产生新抗原(neoantigens),这些肿瘤抗原能够激活适应性免疫反应帮助机体清除肿瘤细胞保护宿主抵抗恶性肿瘤的发生,但是这种免疫压力也能促进新生肿瘤的免疫逃逸[1,2]。
组织定居型记忆T细胞(tissue resident memory T cells, TRM)在感染发生时会迅速响应抵抗特定病原体的入侵,TRM也被报道能够促进肿瘤-免疫平衡(cancer-immune equilibrium)[3]。肺腺癌(Lung adenocarcinoma, LUAD)在吸烟者(ever-smoker,ES)和非吸烟者(never-smoker,NS)中都经常发生,而吸烟能够引发肺脏慢性炎症,促进上皮细胞中DNA突变[4-6]。但是目前尚不清楚慢性炎症是否影响TRM活性,以及这些在肿瘤发生前组织中预先存在的TRM是否对肿瘤发生后的进化产生影响。
该研究发现吸烟能够促进肺脏中TRM的活化和累积,并且这些TRM能够促进肿瘤的免疫逃逸和抵抗免疫检查点治疗。

通过流式和质谱流式分析肺脏癌旁组织和已故器官捐赠者肺脏组织中TRM-like细胞(CD3+CD45RO+CD45RA-CCR7-CD69+CD103+/-),作者发现有吸烟史的正常肺脏组织中CD8+TRM-like细胞的比例明显增加。早期激活的T细胞主要表达共刺激分子(CD28,CD27,41BB,OX40),在效应最强阶段会同时表达共刺激分子和共抑制分子,随后在免疫反应趋向结束时主要表达共抑制分子(CD57,PD-1,LAG3,TIM3)[7]。作者发现在吸烟者肺脏中CD4+TRM-like细胞高表达CD27、CTLA-4以及ICOS,CD8+TRM-like细胞高表达穿孔素。分选纯化吸烟者和非吸烟者正常肺脏T细胞,在体外用CD3/CD28刺激检测细胞增殖能力,发现吸烟者的肺脏来源的CD4+T和CD8+T细胞的增殖能力显著高于非吸烟者。这些结果说明吸烟者肺脏中的TRM-like细胞处于一种高免疫活化状态。
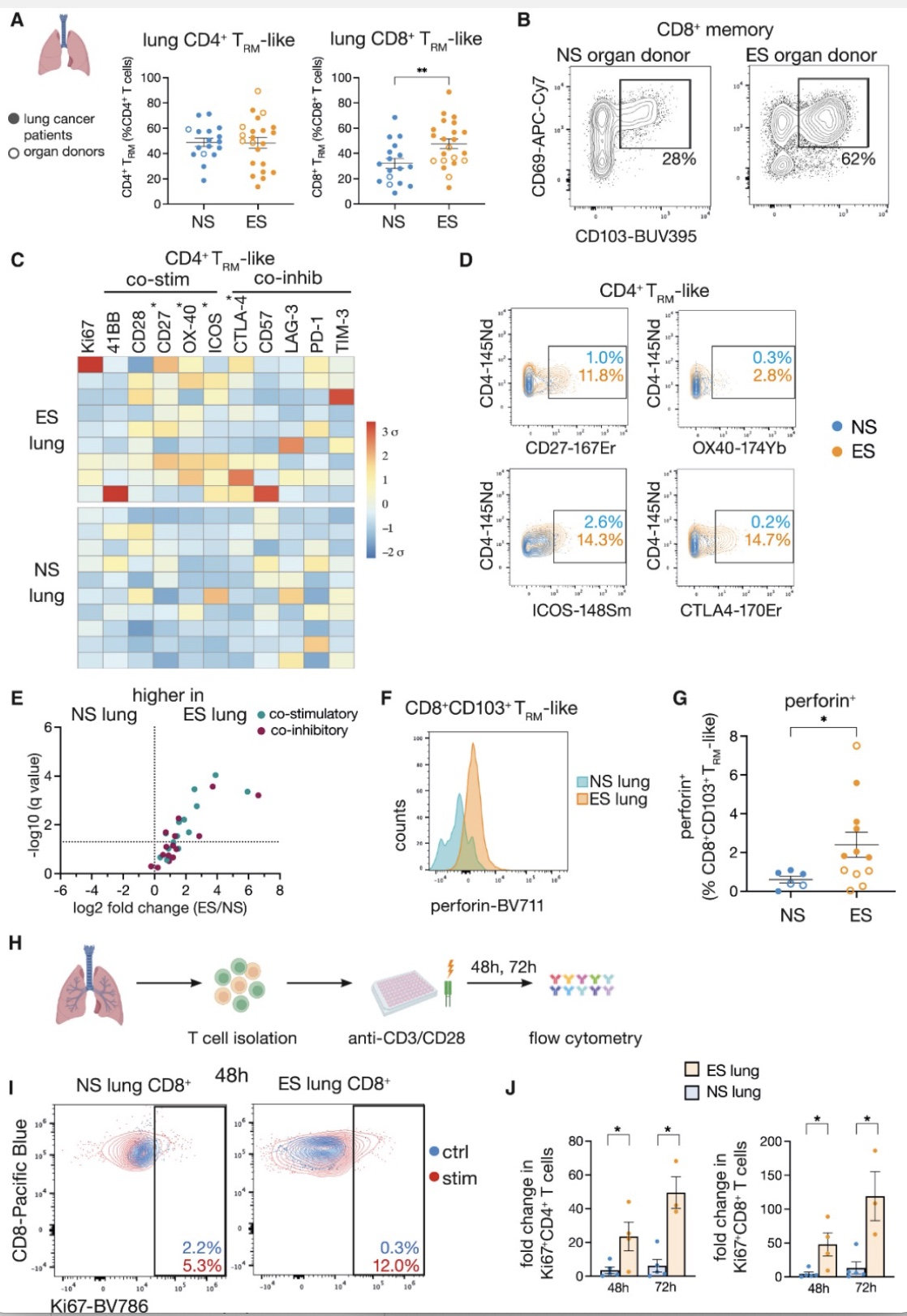
图1. 肺脏TRM-like细胞在非吸烟肺脏中活化程度较低
(图源:Weeden, et al., Cancer cell, 2023)
为评估肺脏中处于不同活化状态的TRM-like细胞是否对肿瘤进化产生影响,作者根据肿瘤分型和淋巴结转移情况将肿瘤分为早期(I-IIIa 期,局限性淋巴结转移 N0-2,M0)和晚期(IIIb-IV期,广泛淋巴结转移N2-N3,M0-1)以代表不同时间肿瘤进化发展过程。作者发现早期肺癌组织中的Treg细胞比例无论患者有无吸烟史均高于正常组织,在非吸烟患者早期肺癌组织中CD8+TRM-like细胞比例高于正常组织,在肿瘤晚期没有差异。在吸烟患者肺脏中CD4+和CD8+ TRM-like细胞表面共刺激分子和共抑制分子的表达在癌旁组织-肿瘤早期组织-肿瘤晚期组织呈现出梯度上调状态,而在非吸烟患者中TRM-like细胞只在晚期肿瘤中呈现出高表达状态。吸烟患者的肿瘤早期组织中TRM-like细胞明显高表达共刺激分子和主要的共抑制分子,提示吸烟患者中TRM-like细胞在肿瘤中处于耗竭状态,在晚期肿瘤中吸烟患者和非吸烟患者均表现出高水平辅助分子包括免疫抑制分子的表达。
CD39是一种细胞膜蛋白能够区别肿瘤反应性T细胞和旁观者T细胞(bystander T cells)[8],作者发现ES和NS病人肿瘤组织中CD39+CD8+TRM-like细胞均比癌旁组织明显增多,但是两组之间并无明显差异,无论患者有无吸烟史肺脏肿瘤中TRM-like细胞都存在克隆多样性。根据CD8+TRM-like细胞转录特征评分,作者进一步利用TCGA和TRACERx数据库中Bulk-RNA-seq数据评估吸烟患者肿瘤中CD8+TRM-like细胞活化情况。与质谱流式结果一致,在非吸烟患者中CD8+TRM-like细胞评分较低。吸烟患者中CD8+TRM-like细胞评分以及TMB与吸烟量并无明显相关性。线性回归分析年龄、性别、疾病分期、肿瘤突变压力(tumor mutation burden, TMB)以及吸烟状态与CD8+TRM-like细胞的相关性,发现只有TMB与CD8+TRM-like细胞明显相关。通常认为非吸烟患者中TMB较吸烟患者低[9],作者进一步比较了TMB相当的NS和ES患者数据,发现在非吸烟患者肿瘤中CD8+TRM-like细胞评分较低。TRACERx数据显示肿瘤不同区域TMB不同,但是这些病人具有高水平TRM-like评分,这些结果说明TRM-like细胞评分可能与TMB无关,在吸烟者中TRM-like细胞的招募和激活很可能发生在肿瘤形成之前。
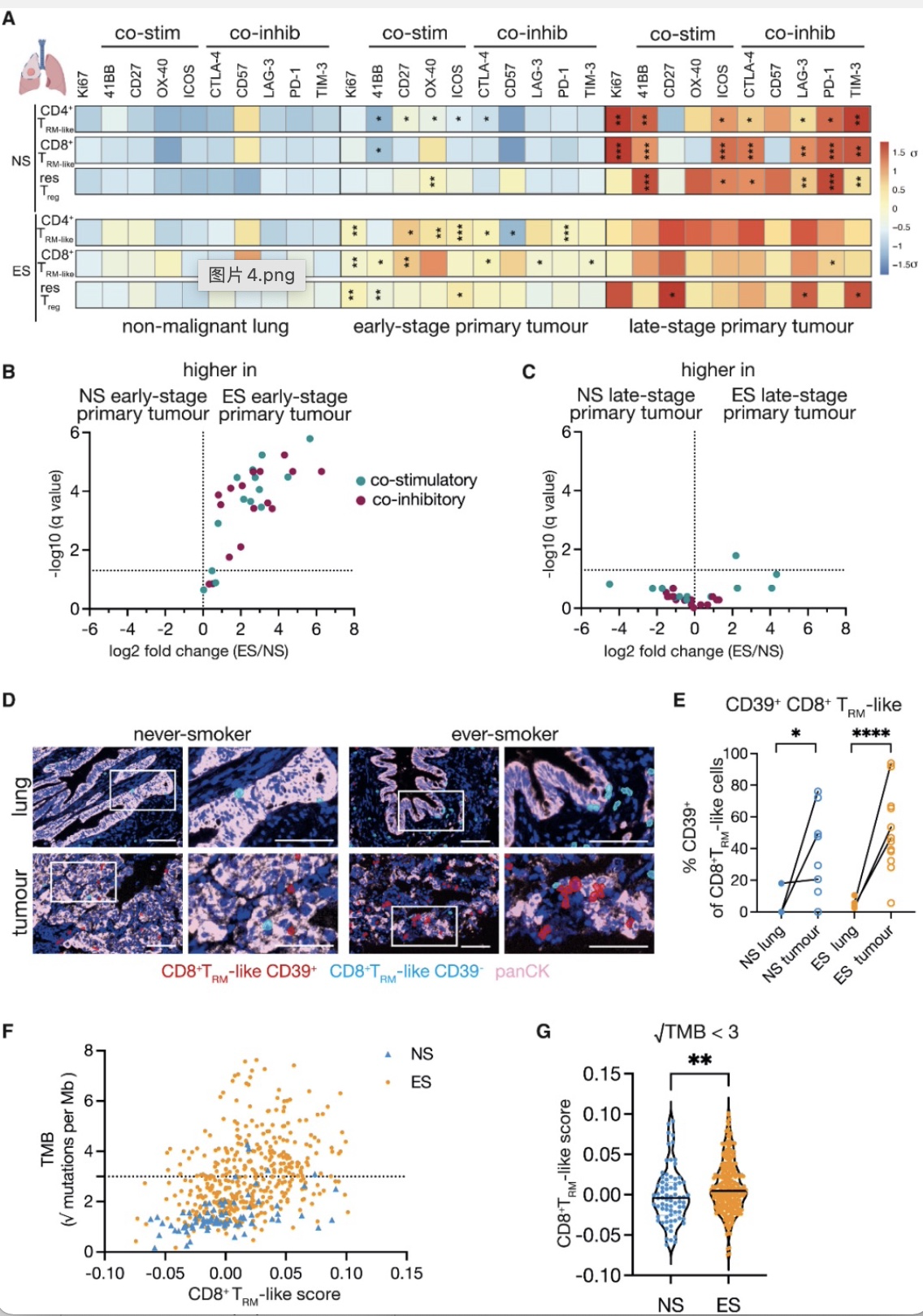
图2.肿瘤相关TRM-like细胞在非吸烟患者早期肺癌组织中活化较低
(图源:Weeden, et al., Cancer cell, 2023)
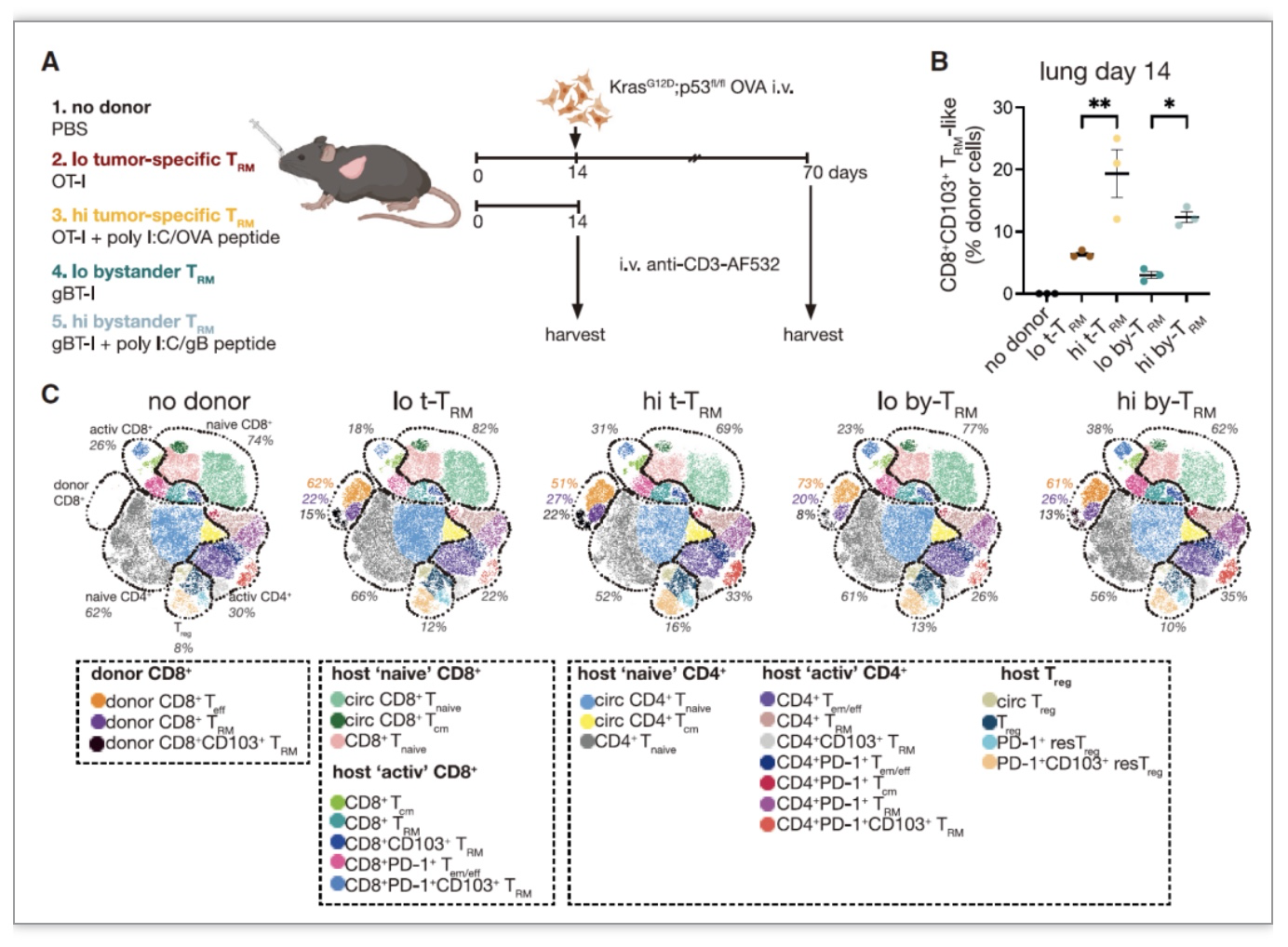
图3.肺脏中预先存在的TRM-like细胞促进了肿瘤微环境中宿主T细胞的招募和活化
(图源:Weeden, et al., Cancer cell, 2023)
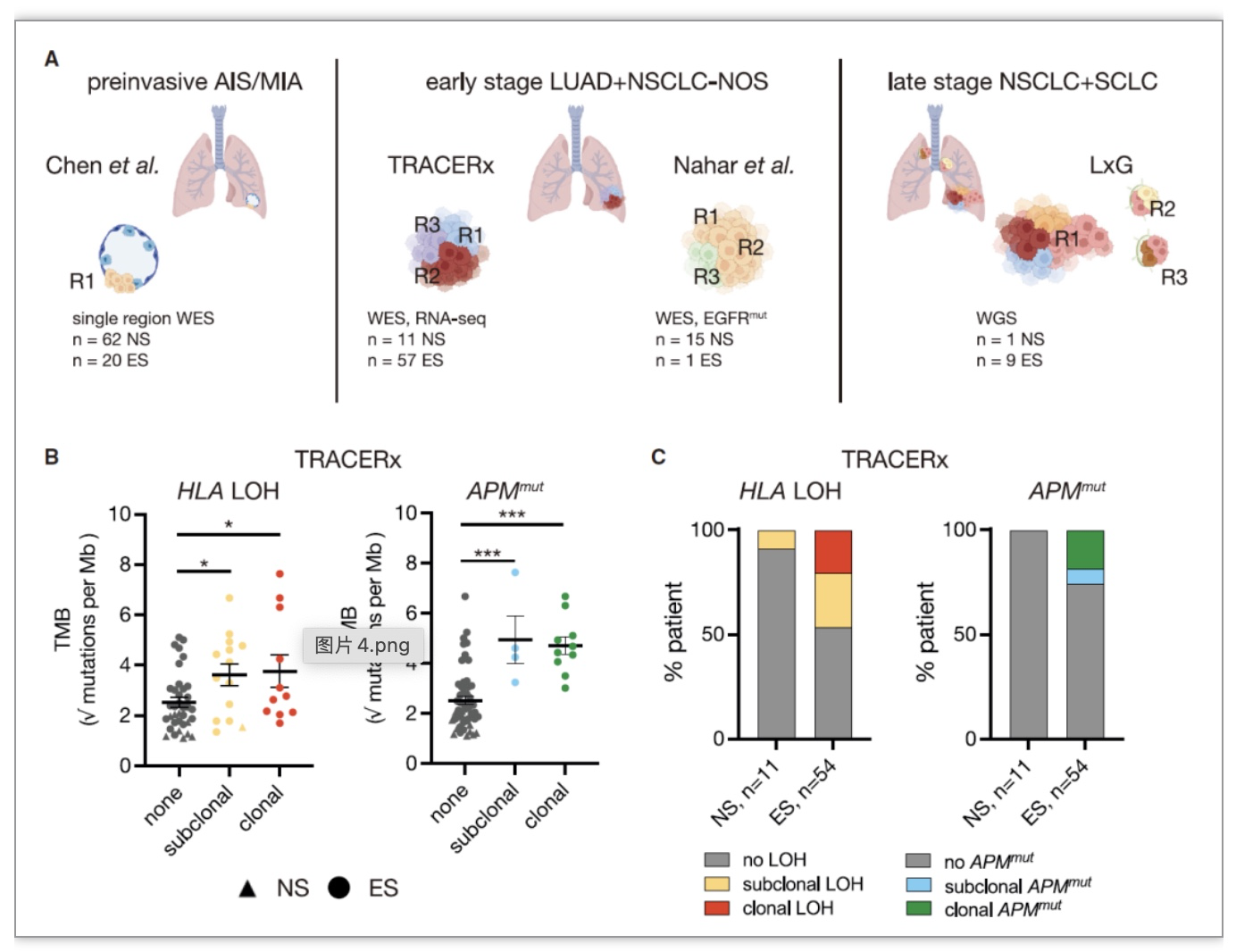
图4. 吸烟患者肿瘤中易发生早期肿瘤免疫逃逸
(图源:Weeden, et al., Cancer cell, 2023)
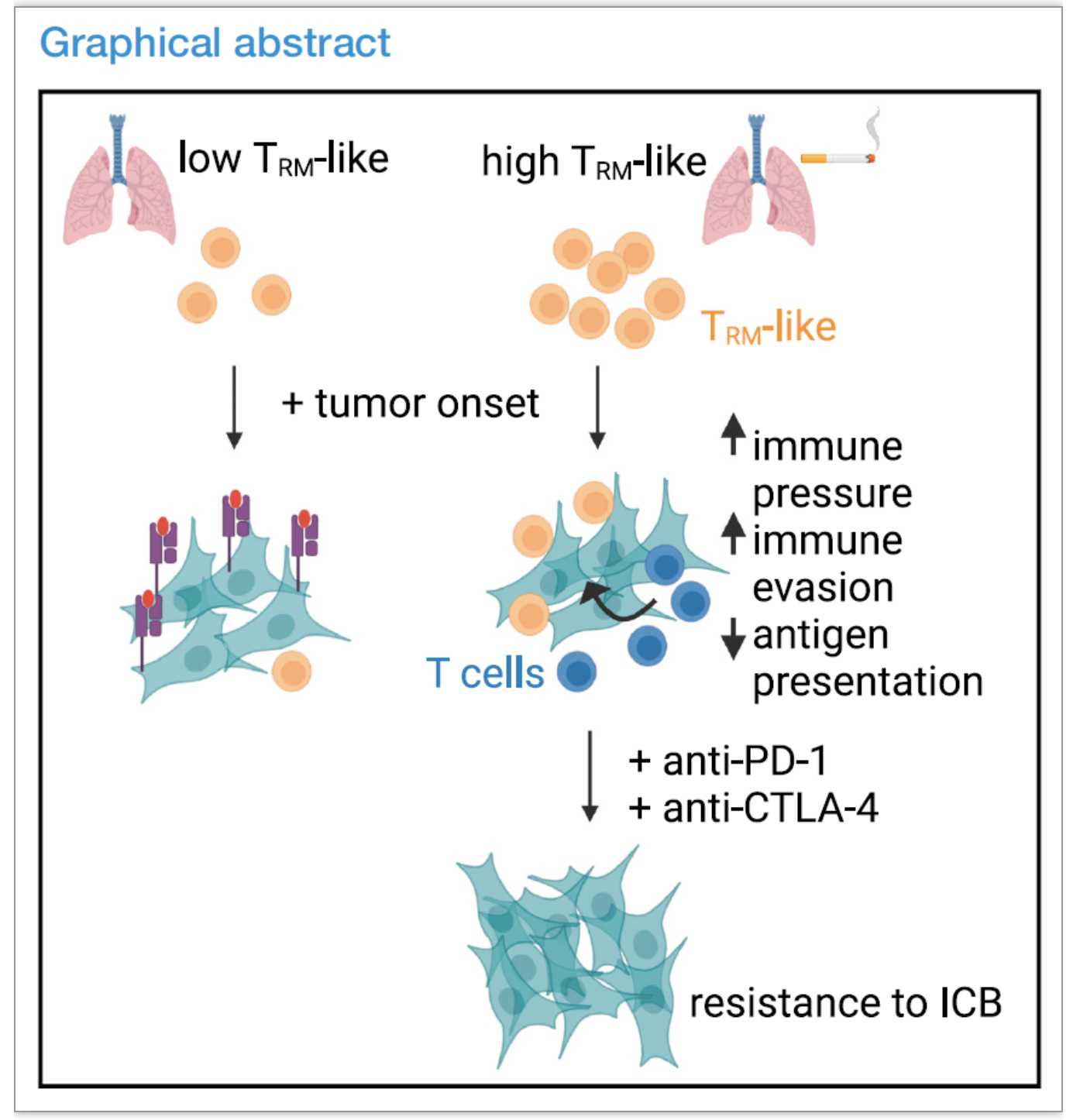
图5.文章总结图
(图源:Weeden, et al., Cancer cell, 2023)

