细胞凋亡(Apoptosis)是程序性细胞死亡中一种主要方式,在组织和器官稳态维持中起到重要作用。在凋亡过程中,细胞将发生皱缩、染色质凝集、细胞膜胀大膨出,最终产生一类包裹细胞内容物的双层脂质结构,即凋亡囊泡(Apoptotic vesicles, apoVs)。作为近年来一类新兴的细胞外囊泡(Extracellular vesicles, EVs)群体,apoVs的发生过程、物理特性、生物学特征和体内生理病理状态下所发挥的生物学效应和分子机制尚未被人们所知。进一步地,作为非细胞制剂,外源性apoVs输注是否具有独特的治疗效应对于临床应用具有重要意义。因此,深入探讨并总结近十年来apoVs发展历史对于指导未来临床组织再生和疾病治疗意义重大。
系统地阐述了其生物发生过程的分子机制、物理学特性和生物学特征;同时讨论了在生理和病理情况下由凋亡囊泡发挥的生物学功能和产生的生物学效应,并总结了凋亡囊泡作为非细胞生物制剂在组织再生和疾病治疗的研究进展。

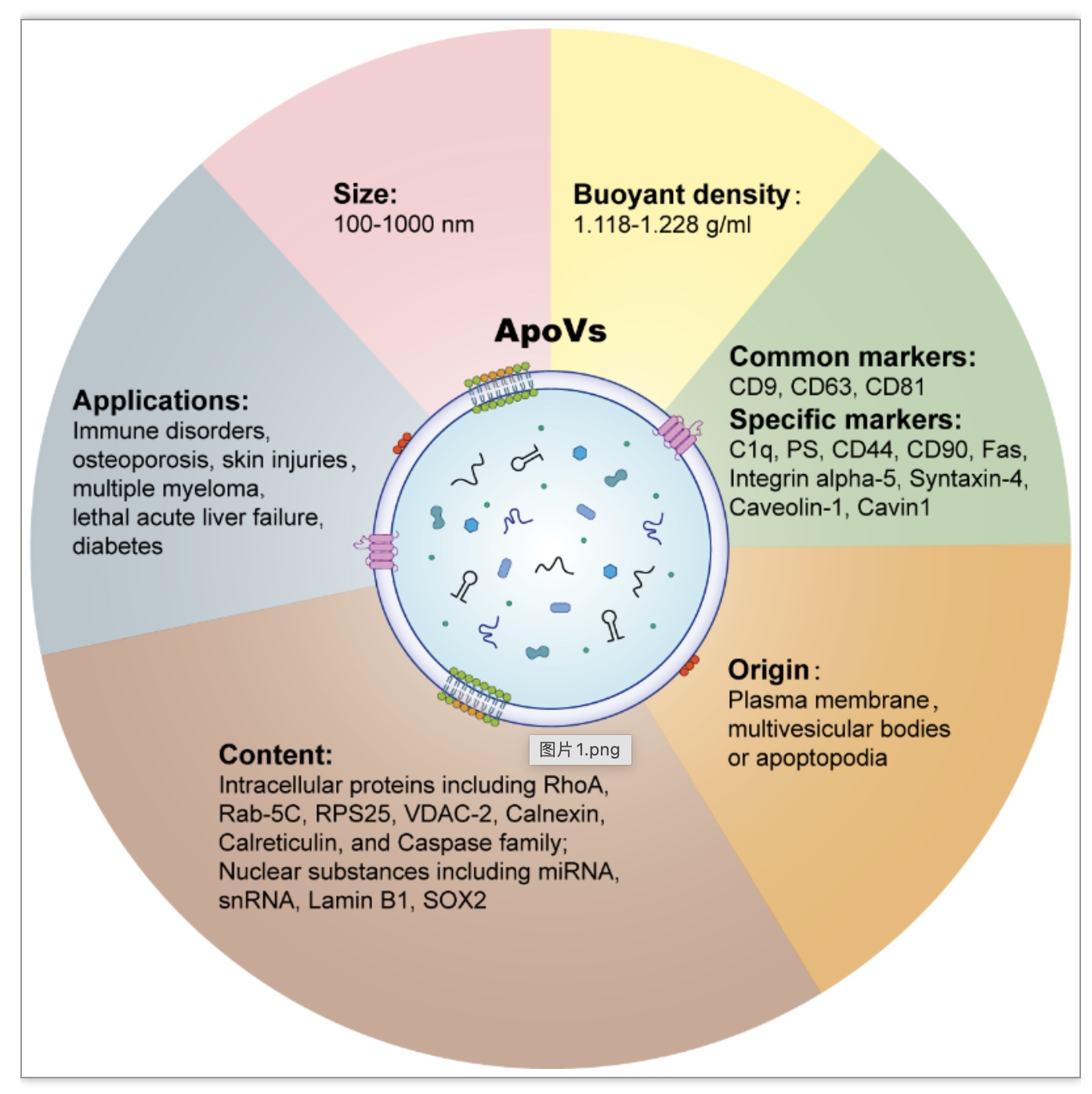
图1 凋亡囊泡的特性
人类机体每日有超过上百亿细胞发生凋亡,所产生的大量apoVs在维持组织和器官稳态具有重要作用。在免疫调控方面,研究表明apoVs通过辅助抗原呈递进行免疫调控,例如,树突状细胞衍生的apoVs携带主要组织相容性复合体(Major histocompatibility complex MHC)来激活CD4+T细胞[7, 8]。另一方面,正常细胞衍生的apoVs利用Fas配体通过Fas途径诱导多发性骨髓瘤细胞凋亡,从而抑制肿瘤发展[9]。在组织稳态维持方面,Brandel等人指出,肝切除术诱导的apoVs可刺激中性粒细胞采用非炎症的再生表型,有助于肝脏再生[10]。apoVs也可通过携带泛素连接酶环指蛋白146(RING finger protein 146,RNF146)和miR-328-3p来促进内源性骨髓间充质干细胞(Bone marrow mesenchymal stem cells, BMMSCs)的恢复[11]。除稳态维持外,apoVs在体内的迁移和清除过程中,皮肤被证明是主要代谢器官;在运动或静息状态下,apoVs在皮肤具有不同程度的富集[12]。简言之,在不同生理病理环境下,机体产生的apoVs是异质性的,发挥不同的生物功能,广泛参与免疫调节、组织和器官稳态维持以及疾病发展。
鉴于apoVs在组织和器官稳态中的系统调节能力,人们很自然地猜想外源性apoVs是否具有治疗效应。实际上,体外培养的MSCs诱导凋亡后获取的apoVs是当前大多数实验研究其性质和功能的主要对象。现有大量研究证明MSCs对于多种疾病具有强大治疗效应,但其分子机制尚未明确。而近期研究表明,外源性MSCs输注后会发生凋亡,这被认为是一种新的MSCs治疗机制[13]。有趣的是,MSCs输注可通过诱导Fas/FasL通路介导的宿主T细胞凋亡以实现免疫平衡[14]。因此,凋亡被认为在MSCs输注中发挥不可或缺的作用。而继承MSCs分子特性和生物学功能的apoVs是否具有治疗效应受到广泛关注。一系列研究已发现外源apoVs输注在机体免疫调节和组织再生、疾病治疗中发挥重要作用(图2)。关于免疫系统的调节,apoVs治疗被认为可刺激巨噬细胞上调转化生长因子-β(Transforming growth factor-β, TGF-β)的产生,从而抑制结肠炎[6]。Wang等人发现MSCs来源的apoVs通过调节CD4+T细胞,可有效改善凋亡缺陷小鼠的狼疮和关节炎[15]。在组织再生和创伤修复方面,外源输注apoVs显著挽救骨质疏松症,其通过携带并递送RNF146和miR-328-3p转移到受体BMMSCs,激活经典Wnt信号通路以诱导内源性BMMSC功能恢复[11]。另外,外源输注apoVs也可激活皮肤和毛囊MSCs的Wnt信号通路,促进伤口愈合和头发生长[12]。此外,基于人类乳髓干细胞(human deciduous pulp stem cells, hDPSCs)的特异性血管生成能力,hDPSCs来源的apoVs能够有效促进血管生成和牙髓再生[16]。总之,迄今为止各项试验已经证明,不同生理背景和发育起源的apoVs具有特异的治疗效果,这是未来临床转化医学不可或缺的基础。
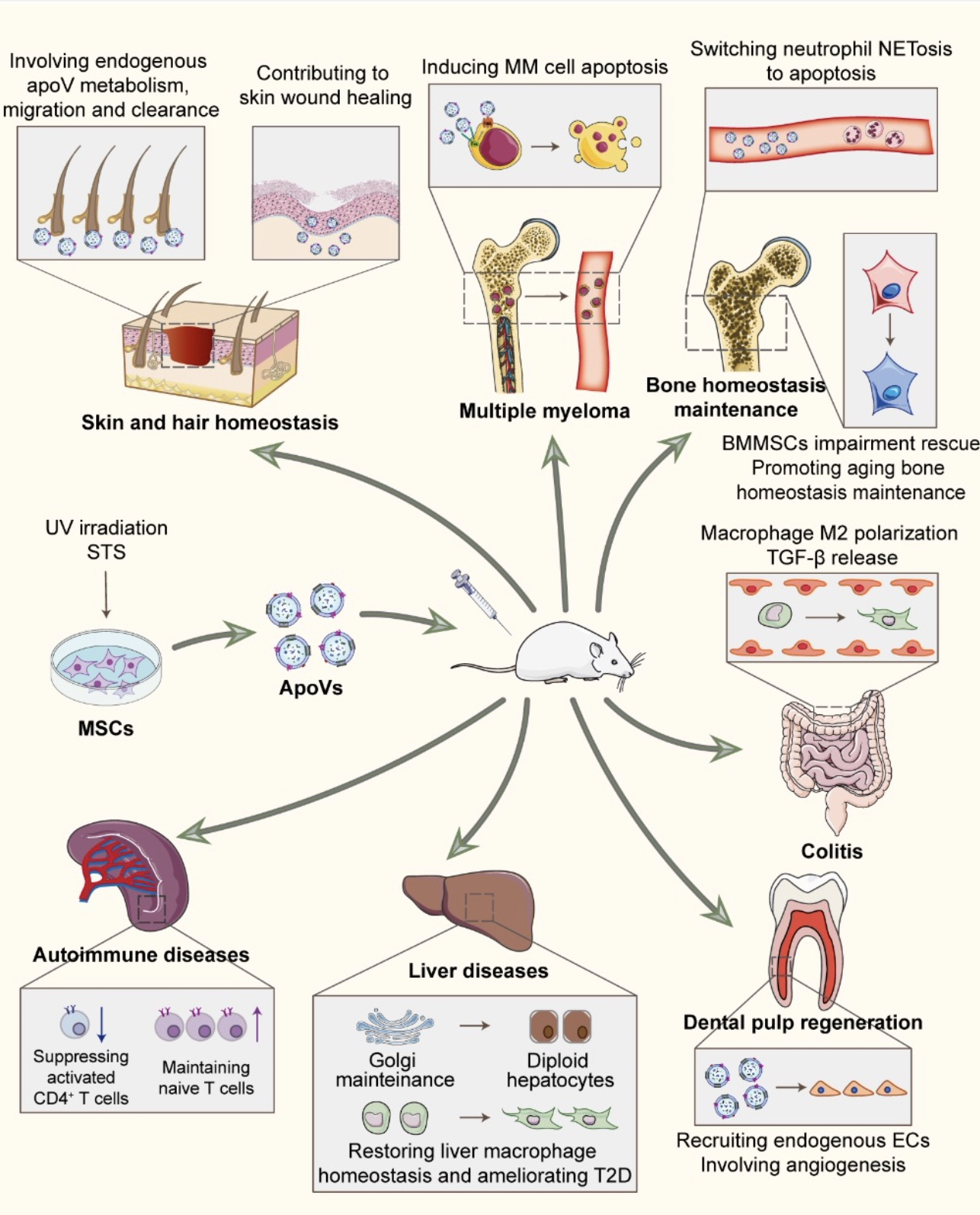
图2 apoVs在多种疾病中的治疗效应
在过去的十年里,人们逐渐认知到细胞凋亡和细胞凋亡产物可介导生理稳态维持和疾病发展。细胞凋亡过程中产生的囊泡,即apoVs,具有独特的物理特性、生物标记物和内容物,是一种新兴的囊泡类型。根据不同的生理和病理环境,apoVs的产生方式多种多样,其内含物和生物学功能也不尽相同。基于apoVs的异质性和复杂功能,其在动物发育以及组织和器官稳态的维持中发挥着多种重要作用。而MSC衍生的apoV输注已被确定为一种有效的生物疗法,可治愈数十种疾病,包括免疫紊乱、骨质疏松、皮肤损伤、肿瘤等。然而,当前领域对apoVs的认知尚未明确,仍需对其进行深入研究。而apoVs作为一种非细胞制剂,其移植治疗具有一系列优势,包括低免疫原性、易于储存、降低凝血风险并可用于工程化和药物递送等,在未来临床应用中具有广泛发展前景。

