2023年5月,由Kasper Karlsson为第一作者,Calvin J. Kuo1 和Christina Curtis为共通讯作者在《Nature》上发表了题为《Deterministic evolution and stringent selection during preneoplasia》的文章,利用强大的实验进化平台揭示了恶性肿瘤的上皮类器官在早期的严格选择、克隆干扰和显著的表型趋同,强调了人源类器官实验进化的力量,以研究潜在的肿瘤前过程和体细胞进化的可重复性,这对肿瘤发生的早期阶段检测和拦截侵袭性、基因组不稳定的肿瘤具有重要意义。
胃癌(GC)是全球第四大癌症死亡原因,缺乏常规筛查,其较长的预诊时间导致诊断晚、预后差和有限的治疗选择。因此,鉴别胃癌及其非特异性前体肠上皮化生的分子决定因素至关重要。癌症产生于一个突变的细胞,在癌前克隆扩增过程中积累额外的突变,这些突变在表型正常的组织中扩散,非整倍体和驱动突变在癌症确诊前逐年发展。其中TP53失活是胃癌中染色体不稳定性(染色体拷贝数变异和染色体结构异常)增强的早期事件。近几年,实验进化对微生物克隆动力学的基本见解已经形成,在人体衰老过程中,基因突变和优势选择的力量推动体细胞克隆扩增,从而导致恶性肿瘤发生,利用类器官的多细胞谱系特征来模拟这种突变进化和克隆优势选择该是一种完美的结合手段。
作者为了模拟胃癌中染色体不稳定的发生,通过CRISPR-Cas9在正常胃类器官中引入TP53双等位基因移码突变,导致基因产物失活,建立了分别从3个独立供体(D)培养的共9个克隆衍生的TP53-/-培养物(C),进行长期繁殖,其中5个被分成3个重复(R)用于细胞条形码研究(图1a)。作者首先探索了TP53缺陷是否引起染色体数量和/或结构染色体结构异常。通过9种培养物的生长不同阶段进行了测序,作者发现缺乏TP53的类器官逐渐获得染色体拷贝数量变异,野生型(WT)胃类器官在长期培养过程中并未出现染色体数量变异(图1b)。而且来自同一供体的培养物表现出不同的染色体拷贝数变异模式,表明遗传背景并不完全限制随后的遗传改变(图1c)。在所有培养物中,基因组改变(FGA)的比例(非整倍体的量度)随时间以不同的速率增加,并在600天左右达到稳定(图1d),D1C1积累了早期臂位改变,在260天表现出超过20%的FGA。在TP53-/- 胃癌类器官中,染色体臂位和局灶CNAs的发生具有一定的时间优先顺序 (图1e)。9号和3号染色体短臂的缺失在200天内反复发生,表明这些改变对类器官早期优势生长特别有利。3号染色体短臂编码的FHIT/FRA3B蛋白的缺失通常发生在TP53-/-胃类器官的早期。基因组看护者FHIT基因在肿瘤进展早期丢失,导致三磷酸脱氧胸腺嘧啶耗竭、复制应激和DNA断裂。CDKN2A和FHIT缺失在体外进化和GCs中反复出现的早期缺失表明它们在肿瘤起始中起作用。其他CNAs包括18号和20号染色体长臂的增加,都发生在较晚的时间,这种晚期的改变可能反映了胃癌类器官对培养环境适应性增强带来的动态选择压力,或者早期改变带来的新的进化路径。这些数据表明,TP53的缺失促进了胃细胞染色体非整倍性变化和组织特异性染色体拷贝数变异按特定顺序的积累(图1e)。

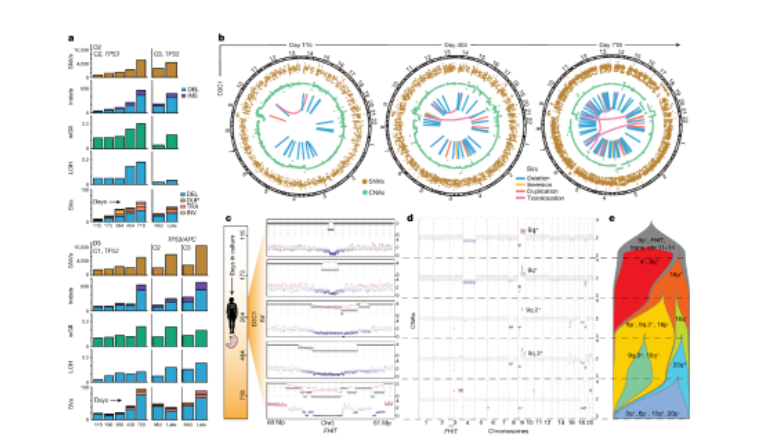
随后,作者通过在多个时间点对TP53-/-类器官进行了全基因组测序,证实了TP53-/-靶点失活,并显示加权基因组不稳定性指数增加,基因组杂合性损失增加,以及在长时间培养过程中染色体局部缺失和扩增,单核苷酸变异和结构变异也随着时间的推移而增加(图2a)。所有类型的改变都在进化的TP53-/-胃类器官中积累,其中染色体结构变异尤其显著,在早期时间点以非聚集性和简单的聚集性重排为主,随后是复杂的聚集性(十个或更多的重排),随着时间的推移,涉及到缺失、倒置和易位(图2a)。D3C1在进化过程中积累了多次染色体间重排(图2b),这种复杂的结构变异在在恶性Barrett食管中很常见,另外,TP53-/-胃类器官的结构变异负担也显著增加。另外,正如胃癌和Barrett食管所报道的那样,FHIT基因座经常包含复杂的结构变异,包括脆弱位点的缺口缺失 (图2c)。
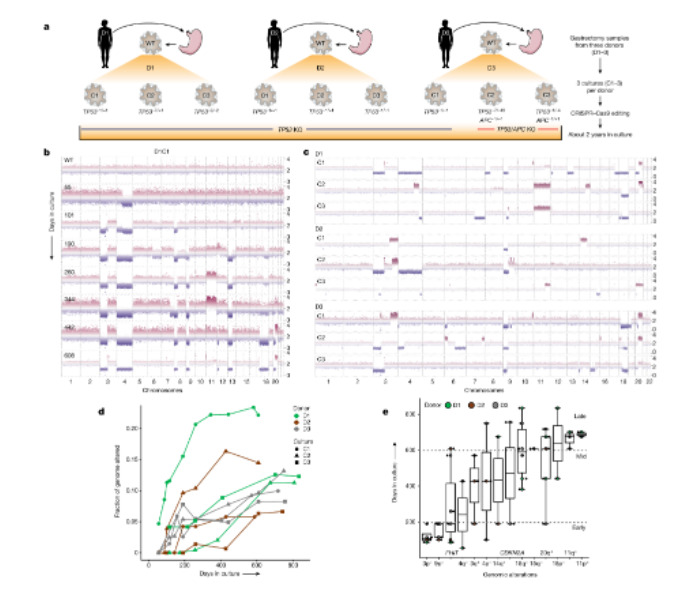
通过追踪D3C1中FHIT重排的起源发现,包含这种重排的亚克隆丢失了(图2d,e),一个具有明显FHIT 缺口的独立亚克隆(蓝色)出现并持续存在,表明TP53-/-胃类器官趋同进化,因此,具有多个连接点的重排经过细胞的多次进化而形成的,而不是一个单一的事件。在其他类器官中也发生了类似的事件,包括3号和9号染色体易位。通过测定D3C1和D2C2在五个时间点上的CNA谱的亚克隆群体,研究了克隆竞争和灭绝。到第115天,D3C1获得了许多缺失(9p,FHIT)和几个结构变异,包括持续的11号和14号染色体易位。超过600天,多个染色体拷贝数定义的亚克隆在灭绝前频率增加(图2d,e)。例如,4号染色体缺失和9号染色体长臂扩增的亚克隆出现较早,在264天消失,被19号染色体短臂缺失的亚克隆取代,后者随即获得8号染色体短臂缺失,9号染色体长臂第二节扩增以及16号染色体短臂的缺失这种改变,直到第404天保持优势,该亚克隆最终被18号和20号染色体长臂缺失的亚克隆打败,这两种亚克隆都是反复发生的晚期事件。因此,一些突变克隆被固定并获得统治地位,而另一些在灭绝之前达到相当高的频率,可能是由于克隆干扰,不同的染色体拷贝数变异亚克隆共存的时间较长(约140天),表明了相似的适应度。这些数据表明上皮细胞群体在癌前病变过程中存在严格的选择和普遍的克隆干扰。
根据TP53-/-胃类器官的生长动态和早、中、晚时间点的单细胞RNA测序结果(scRNA-seq),作者评估体外进化过程中的表型和转录变化(图3a)。作者通过回归模型拟合分析每代细胞数量来研究细胞增殖的变化,使用生长导数和折叠变化作为适应度的替代。与早期相比,在后期和中期时间点观察到更高的生长导数(图3b);使用原始细胞数得到了类似的结果。对12个培养物进行单细胞转录组测序,得到31,606个细胞进行质量控制分析(图3c)。
来自三个供体的WT胃类器官中表达了正常胃组织标记,包括D1中的窝粘膜细胞标记(MUC5AC, TFF1, TFF2, GKN2),D2中的肠细胞标记(FABP1, FABP2, ANPEP, PHGR1, KRT20)和D3中的腺体粘膜细胞标记(MUC6, PGC, TFF2, LYZ),但在TP53-/-胃类器官中是异质性的(图3c-e)。在WT培养中,由粘蛋白和TFF基因表达定义的粘膜样表型在D1和D3中随着TP53双等位基因敲除而消失。在D1中,肠杯状细胞特异性标志物(TFF3、WFDC2、MUC5B)在晚时间点上调,这在肠化生中很常见。胃癌相关基因CLDN3、CLDN4、CLDN7和癌胚抗原家族基因(CEACAM5、CEACAM6)在D1和D3中的表达随时间增加。作者利用scRNA-seq数据,通过交叉分析研究6种培养物早期到晚期的显著差异表达基因,研究了TP53-/-胃类器官转录特征的重叠,共鉴定出13个持续上调的与胃癌相关的基因(CLDN4、TM4SF1、ZFAS1)和40个持续下调的基因(SPTBN1、LYZ、TFF2)(图3e)。

为了确定TP53-/-胃类器官的病理特征,作者首先绘制了胃正常细胞和胃肿瘤细胞的scRNA-seq数据图,利用文献来源的标记基因将待选的6,001个上皮细胞分配到不同的细胞类型簇,并且出现了两个包括粘膜样恶性细胞(MUC5AC, TFF2, TFF1)和非粘膜样恶性细胞(KRT17, KRT7, LY6D)肿瘤细胞簇(图4a),此外,PMCs、GMCs、主细胞、壁细胞、肠细胞、肠内分泌细胞、杯状细胞和增殖细胞也被划分为集群(图4b)。接下来,作者将TP53-/-胃类器官早期、中期和晚期时间点的scRNA-seq数据分别投影到参考数据图上,以识别最相似的胃细胞类型(图4c)。随着时间的推移,细胞状态的变化在所有培养物中都很明显,其中一些与胃炎的转变有关,这种转变可能导致肠道化生并最终导致恶性肿瘤(图4d)。
通过最近邻法鉴定参考群体,胃类器官的细胞类型频率的变化被量化(图4e)。结果显示有3个在后期时间点观察到粘膜样恶性细胞的增加(D3C2、D3C3和D1C1)。相比之下, D2粘膜样恶性细胞减少,而非粘膜样恶性细胞增加(D2C2、D2C3)(图4e),解释了相对于D1和D3的转录差异(图3)。值得注意的是,D2WT中约30%的细胞在肠细胞附近投影,可能导致胃炎样特征,并强调肠细胞和恶性细胞之间的转录相似性。D1和D3的WT培养主要表现为粘膜表型。粘膜基因表达的减少表明,TP53-/-胃类器官在进化过程中正在向肠化生和恶性肿瘤发展,这证实了基于特定标记基因来监督分析组织病变的可靠性。

作者利用细胞条形码标记每个TP53-/-胃类器官细胞,通过高复杂性细胞条形码的前瞻性谱系追踪,在细胞分辨率上来表征肿瘤发生前的亚克隆动力学。作者选择了5个TP53-/-克隆和1个TP53-/-+APC-/-克隆在初始阶段被ECB慢病毒转导进行长期培养,每个ECB亲本系被分成三个重复,以评估克隆动力学的可重复性。在多个时间点对所有培养物进行Sanger测序,以验证TP53/APC缺失的克隆性。作者通过假设同一亚克隆的生长反映了内在的适应度优势,反映不同的亚克隆优势表明其获得的适应度差异(图5a)。在长期培养中,ECB标记的类器官克隆的纵向进化中的浅基因组测序结果在整体基因组水平上表现出显著的可重复性,重复培养物之间具有非常高的相似性CNAs(图5b)。在D2C2中,在所有三个重复中,新的CNAs在258天左右出现;在D2C1中,R2的亚克隆8号染色体长臂扩增在第258天检测到并持续存在。总体来说,相较于重复培养之间的差异(R1/R2/R3),来自同一供体的不同培养的CNAs变化更大(D2C1/D2C2)(图5b)。
通过定期对ECB标记的类器官克隆进行DNA测序,作者评估了亚克隆随时间出现的相对丰度 (图5c)。根据培养物中重复的亚克隆频率为条形码分配颜色,频率最高的亚克隆为红色。D2C1R1中的红色带表示与D2C1R2和D2C1R3中相同的条形码子克隆,红色亚克隆在所有重复中都成为优势(图5c),这与内在适应度优势和确定性生长一致(图5a)。对于D2C1的重复培养物R1和R3,红色亚克隆成为优势,而在R2中,获得8号染色体长臂扩增的绿色亚克隆超过了群体;棕色和绿色的克隆在灭绝之前是同步扩张的,这表明它们是相互依赖的。跨重复的亚克隆频率随时间的相关性很高,反映了培养中相似的亚克隆动态和跨培养的相似模式。通过构建亚克隆特异性生长曲线及对其衍生物的评估,作者发现“获胜”亚克隆具有高初始适应度,并且随着时间的推移增殖能力增加(图5d)。因此,谱系追踪显示了在重复培养中可复制的动态,适应性谱系在ECB转导后144天迅速进入固定状态,优势克隆占据种群主要群体。这些优势群体的克隆模式与同基因型微生物种群在初始变化过程中快速适应繁殖模式有着异曲同工之妙。

