感染期间,抗原特异性CD8+T迅速扩增分化成Klrg1highCD127low末端效应T细胞(Terminal effector cells, TEs)和Klrg1lowCD127hi记忆前体细胞(memory precursors cells, Mprs)。TEs细胞在病原体清除后会迅速死亡,而Mprs会变成长期存活的记忆T细胞[1]。记忆T细胞分为循环记忆T细胞(circulating memory T cells)和组织定居型记忆T细胞(resident memory T cells, TRM)两个大类。TRM由感染早期定植到非淋巴组织中的T细胞分化而来,在再次遇到相同抗原时能够迅速启动,直接杀伤感染的细胞,诱导天然免疫样免疫反应并招募外周记忆细胞和其它免疫细胞到感染部位[2,3]。多种转录因子参与Mpr和TE的分化,调节循环性记忆T细胞和定居型记忆T细胞的分化命运。目前人们对调控肠道CD8+TRM的转录因子知之甚少。
转录因子Bcl11b既能作为转录激活子也能作为转录抑制子发挥功能。之前研究表明Bcl11b在胸腺细胞多步分化和成熟T细胞(包括Th17、Th2和Treg细胞)分化中发挥重要作用[4-6]。也有研究证实Bcl11b调控NK、ILC2和iNKT的分化、发育和维持。作者先前的研究发现在naïve CD8+T细胞中缺失Bcl11b会引起感染后抗原特异性克隆扩增和效应功能受损[7],在本文中作者进一步探究了Bcl11b在调控肠道TRM中的作用。该研究发现在单核细胞增多性李斯特菌(Listeria monocytogenes, Lm)感染模型中,CD8+T细胞缺失Bcl11b,下调Tcf7等多能/多功能程序(multipotent/multifunction, MP/MF)基因,上调Prdm1等效应功能基因表达,引起肠道CD8+TRM及前体细胞数量增加,但是Bcl11b缺失的CD8+TRM再次感染响应能力减弱。

为研究Bcl11b在CD8记忆T细胞中的作用,作者将野生型(wild type,WT)OT-I细胞和激活后即可敲除Bcl11b且同时表达YFP荧光的OT-I细胞(Bcl11bf/fGzmbCre+R26REYFP+)过继回输到受体小鼠体内,随后口服感染Lm-Ova InlAM。感染第3天,肠系膜引流淋巴结中Bcl11bf/fGzmbCre+R26REYFP+OT-I (CD45.2)来源的细胞暂未表达YFP,并且其比例与野生型来源的细胞无明显差异。T细胞激活标志CD69表达水平在两组之间相当,说明感染第3天T细胞暂未明显活化。感染第九天,过继回输Bcl11bf/fGzmbCre+R26REYFP+OT-I细胞的受体小鼠中小肠上皮内淋巴组织(small intestine intraepithelial lymphocyte, siIEL)和脾脏中OT-I细胞均表达YFP,Bcl11b-/-CD44+CD8+T细胞与野生型相比在脾脏中的比例和数量明显减少,而在siIEL中Bcl11b-/-CD44+CD8+T细胞(包含TRM前体细胞,TRM precursors, TRMPs)明显增加。为评估Bcl11b-/-和WT CD8+T细胞在免疫记忆阶段有无差异性,作者分析了感染第30天和第90天脾脏和siIEL中CD8记忆T细胞的变化,同样发现脾脏中Bcl11b-/-CD8+记忆T细胞的数量和比例较野生型显著减少,而siIEL中Bcl11b-/- CD8+记忆T细胞仍然显著高于野生型细胞。这些结果说明Bcl11b在调节记忆性T细胞和记忆前体T细胞在脾脏和组织中的分布中发挥作用。
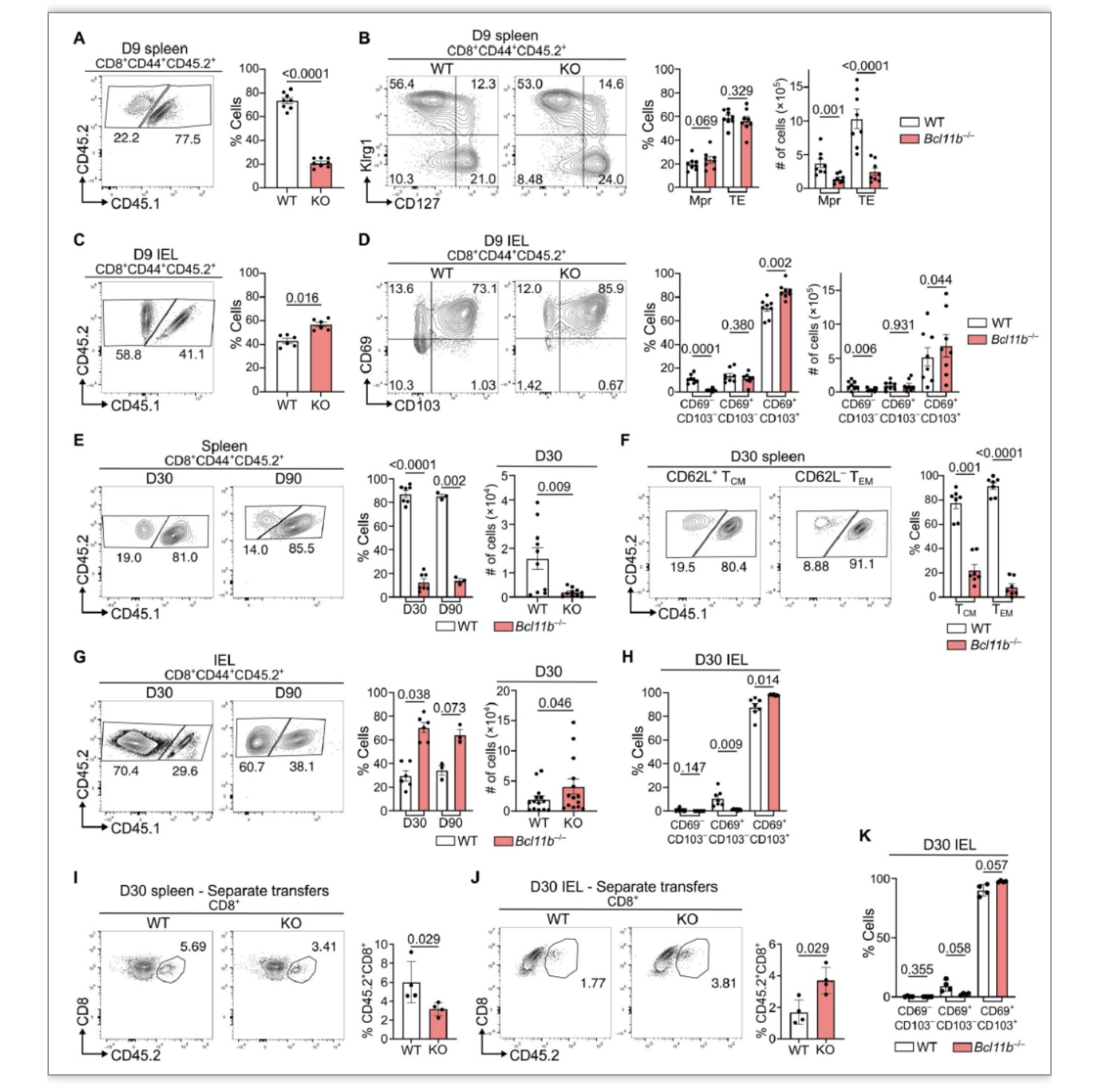
图1. Bcl11b缺失引起肠道中TRM增加而循环记忆T细胞减少
为评估Bcl11b-/-记忆CD8+T细胞在再次感染中的作用,作者在感染第30天再次感染Lm,发现再次感染第三天过继回输Bcl11b-/- OT-I细胞的小鼠肝脏细菌明显比过继回输WT细胞的小鼠多,并且脾脏和siIEL中的Bcl11b-/- CD8+T细胞明显减少。过继回输WT OT-I细胞的小鼠siIEL中出现新招募的CD69+CD103-CD8+T和CD69-CD103-CD8+T细胞,而在过继Bcl11b-/-细胞的小鼠中这些细胞只有极少比例,并且过继回输Bcl11b-/-细胞的小鼠外周循环中Bcl11b-/-CD8+记忆T细胞同样减少。此外作者还发现siIEL中Bcl11b-/- IFN-γ+TNFα+ CD8+ T显著减少,IFN-γ和TNFα被报道在激活和招募外周记忆细胞和其它免疫细胞中发挥作用,作者发现过继回输Bcl11b-/- OT-I细胞的小鼠与过继回输WT细胞的小鼠相比,siIEL中NK1.1+细胞明显减少。这些结果说明Bcl11b调节记忆性T细胞和记忆前体细胞在脾脏和组织中的分布发挥作用。
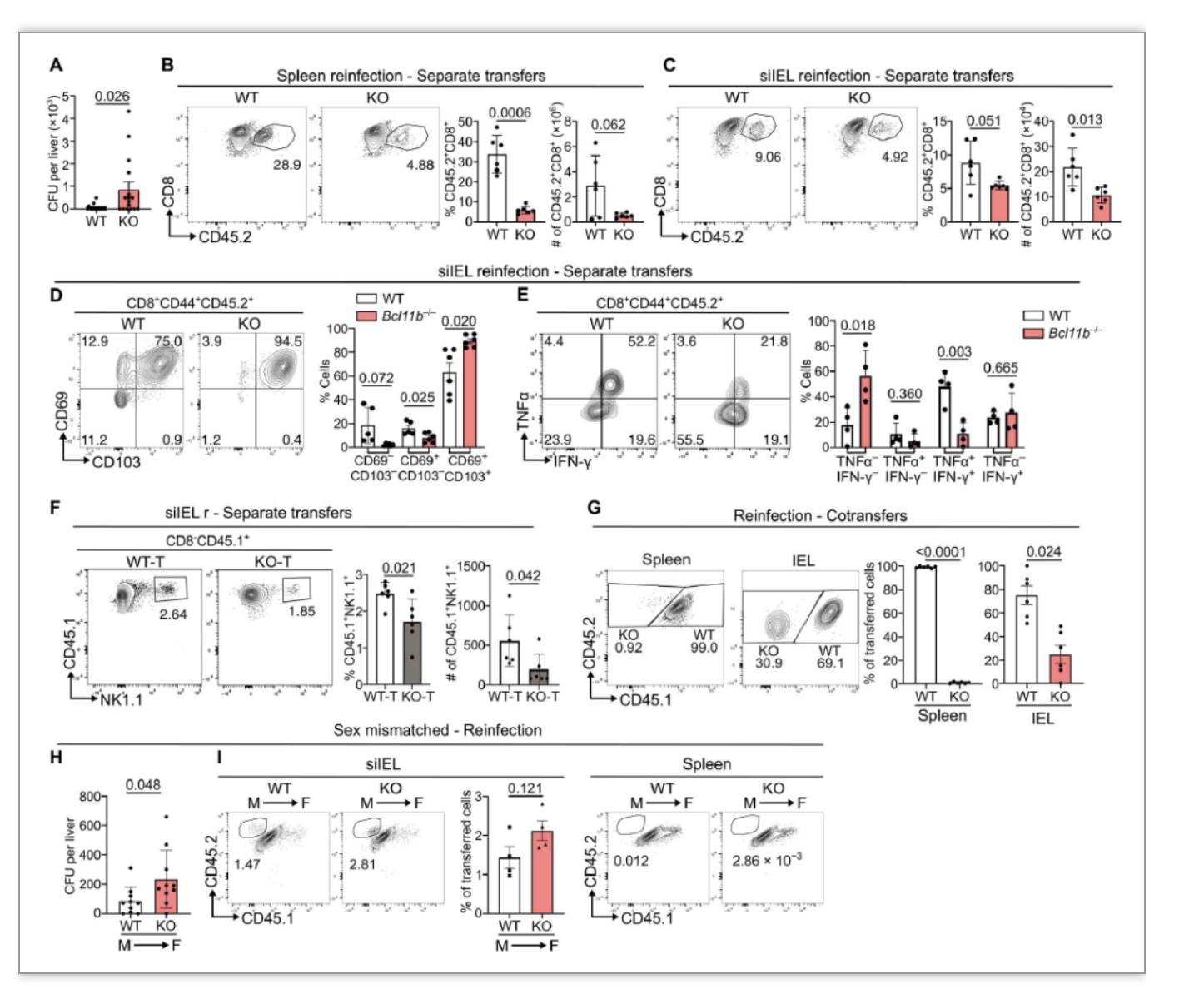
图2. Bcl11b-/- 记忆T细胞再次应答能力受损
通过转录组测序分析siIEL中Bcl11b-/-和WT TRM差异,发现在感染早期、免疫记忆阶段以及再次应答阶段Bcl11b缺失的T细胞中调控MP/MF编程(MP/MF program)相关的基因表达明显下调,而调控效应编程(effector program)相关的基因表达明显上调。这些结果说明Bcl11b调节TRM细胞MP/MF基因以及效应基因表达,参与TRM早期分化、免疫记忆形成以及再次应答过程。
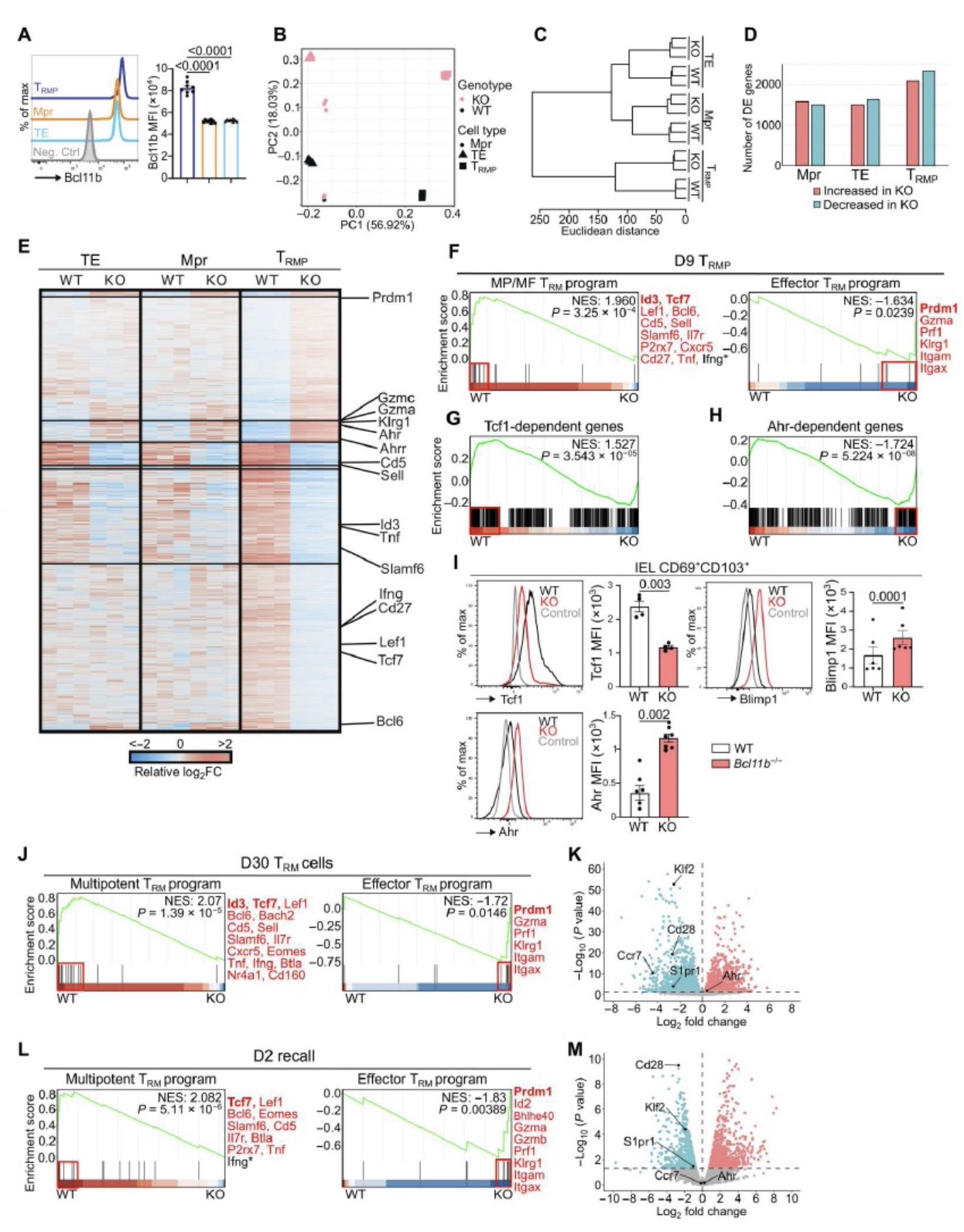
图3. Bcl11b调节效应和记忆阶段TRM编程基因
作者进一步通过RNA-seq分析Bcl11b在Mprs和TEs中的作用,结果显示Mprs和TEs特征相关基因在WT和Bcl11b-/-细胞中无明显差异,而调节肠道归巢相关基因Itga4、Itgb7、Ccr9在Bcl11b缺陷细胞中表达明显上调。通过anti-α4β7抗体DATK-32阻断α4β7(由Itga4和Itgb7基因表达)能够显著提高脾脏中Bcl11b-/-/WT细胞的比例,但是siIEL中Bcl11b-/-/WT没有改变。说明脾脏中Bcl11b-/-Mprs和TEs细胞减少的部分原因可能是Bcl11b缺陷引起肠道归巢相关因子上调导致的,但是siIEL中仍然存在其它因素调控Bcl11b-/-TRM细胞的增多。
为探究Bcl11b对记忆T细胞的调控机制,作者进一步通过ATAC-seq、CHIP-seq、H3K27ac CHIP-seq等染色质测序实验,发现Bcl11b缺失导致Tcf7基因上游区域、内含子区域染色质可及性减少,同时H3K27ac和H3K4me3在Tcf7基因上游区域以及启动子区域的修饰减少。说明Bcl11b能够维持H3K27ac和H3K4me3在Tfc7基因相关位点修饰从而增加了Tcf7基因区域的染色质可及性。作者在人记忆性CD8+T细胞中同样发现BCL11B能够结合TCF7基因区域,说明在小鼠和人中Bcl11b的调控具有一定保守性。作者还发现缺失Bcl11b后只引起小鼠siIEL TRMPs和TRMs细胞下调Tcf7表达,而不影响Mprs和TEs细胞中Tcf的表达,说明Bcl11b的调控特异性发生在siIEL TRM及其前体细胞中。进一步通过Tcf1 CUT&RUN实验发现Bcl11b通过调控Tcf7的表达或直接调控MP/MF相关基因区域的染色质可及性实现对T细胞MP/MF相关编程基因的调控。
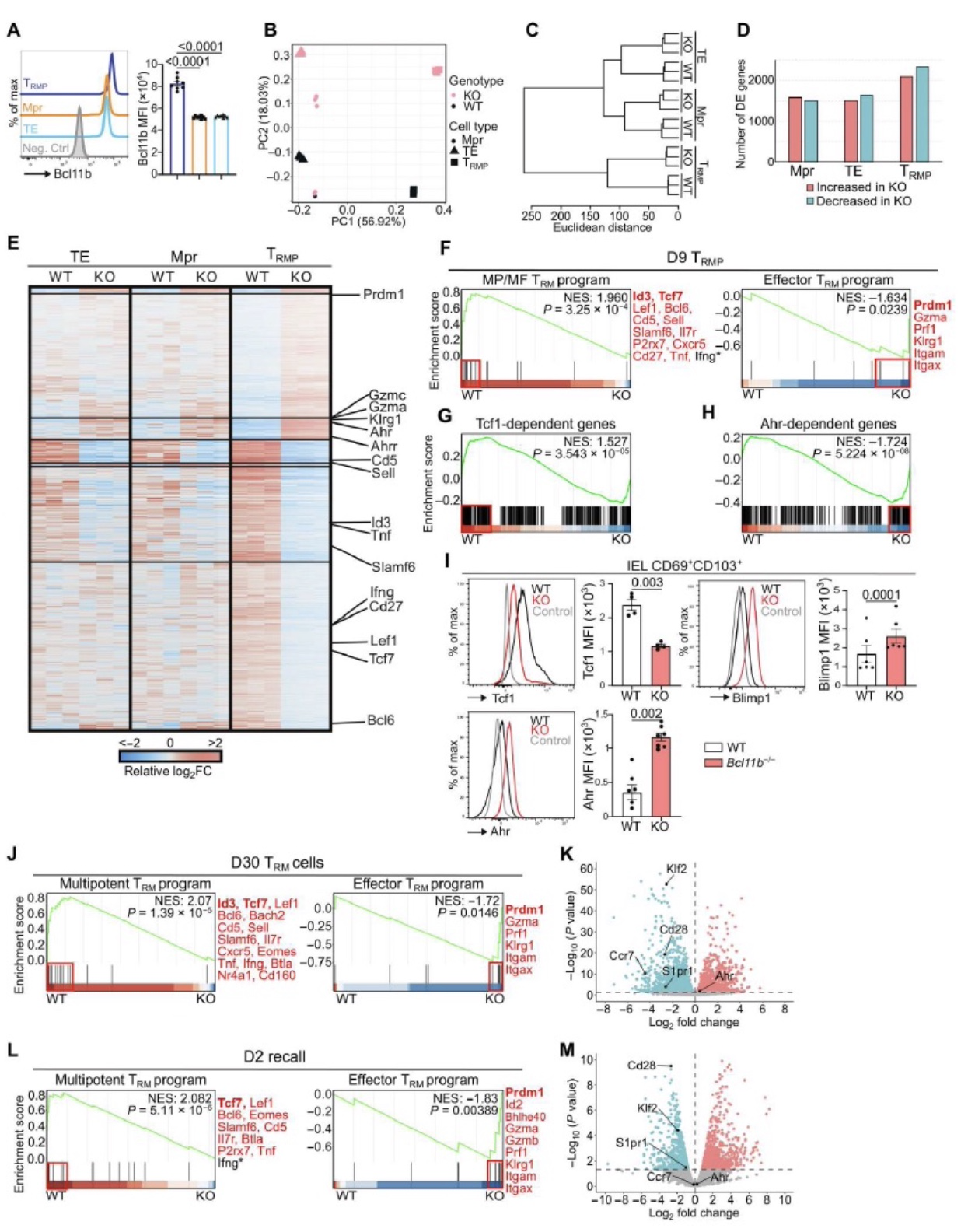
图4. Bcl11b结合并调节Tcf7的表达
Bcl11b通过结合MP/MF编程相关基因调控其表观遗传修饰从而调控的TRM的多潜能性和多功能性,同时Bcl11b能够抑制效应编程基因的表达。在Bcl11b-/-CD8+T细胞中回补Tcf1能够限制TRM细胞的分化,但是Tcf1在调节和维持肠道Id3hiBlimp1loTRM多潜能性/多功能性方面的具体机制还不清楚。此外作者还发现Bcl11b抑制Prdm1的表达并不依赖于已知的调控CD8+TRM分化的转录因子Ahr,但是Bcl11b似乎能够限制Ahr的激活,因此需要设计进一步实验探究Ahr在调控MP/MF中的作用。该研究的一个不足之处为作者在研究TRM基因组调控中使用的TRM细胞为体外培养体系,只能部分模拟体内条件,这种肠道中的TRMs调控机制在其它器官或不同病原体感染中是否具有相似性有待进一步研究。综上所述该研究揭示了Bcl11b在调控肠道CD8+TRM及其前体细胞中的重要作用,Bcl11b能够促进MP/MF编程,抑制效应编程,拓展了我们对转录因子调控肠道TRM细胞分化和多样性进程的理解。

