肿瘤发生是正常细胞积累足够遗传改变并转化为恶性细胞的过程。相同地,急性髓系白血病(AML)被认为是正常造血干细胞和祖细胞经过多个阶段改变进展为白血病细胞的过程。目前的研究表明正常克隆性造血(CH)可进展为低危骨髓增生异常综合征(MDS)和高危 MDS 或骨髓增殖性肿瘤(MPN),最终导致全面爆发急性髓系白血病。然而,AML是突变负荷最低的人类恶性肿瘤之一[1],并且有越来越多的证据表明大多数遗传改变存在于CH和MDS等白血病前期疾病中[2,3]。因此,探究白血病发生过程中除突变外的分子调控改变至关重要,有助于理解白血病的发生机制并提供新的治疗手段。
该研究对AML成瘤过程中多时间取样进行单细胞转录组测序,鉴定AML发生过程中干性细胞逐渐增多,增殖细胞逐渐增加的分子演进路径,并发现可变剪接通路在成瘤早期发挥核心作用。鉴定了NPM1、PHGDH基因在AML形成早期的关键作用,确定了TMEM134可变剪接异常导致白血病异质性产生和疾病恶性演进。对深入理解非基因突变对白血病发生的调控机制和新的治疗方式提供了理论依据。

研究通过Myc诱导的小鼠AML模型,利用单细胞组学研究解析AML发生发展全过程的细胞与分子路径。通过对AML发生进程中5个时间节点分别是Tn(健康小鼠的骨髓细胞)、T0(获得致病突变的造血干细胞)、T1(带有致病突变的造血干细胞移植到小鼠体内两周)、T2(移植到小鼠体内四周)、T3(移植到小鼠体内八周左右,白血病肿瘤末期)的小鼠骨髓细胞转录组进行单细胞精度的分析(图1 A-B)。鉴定了AML发生过程中干性增加,分化受阻,并且增殖细胞逐渐增加,其分子演进特征与发生AML转化的临床患者的分子特征高度相似(图1C-F)。
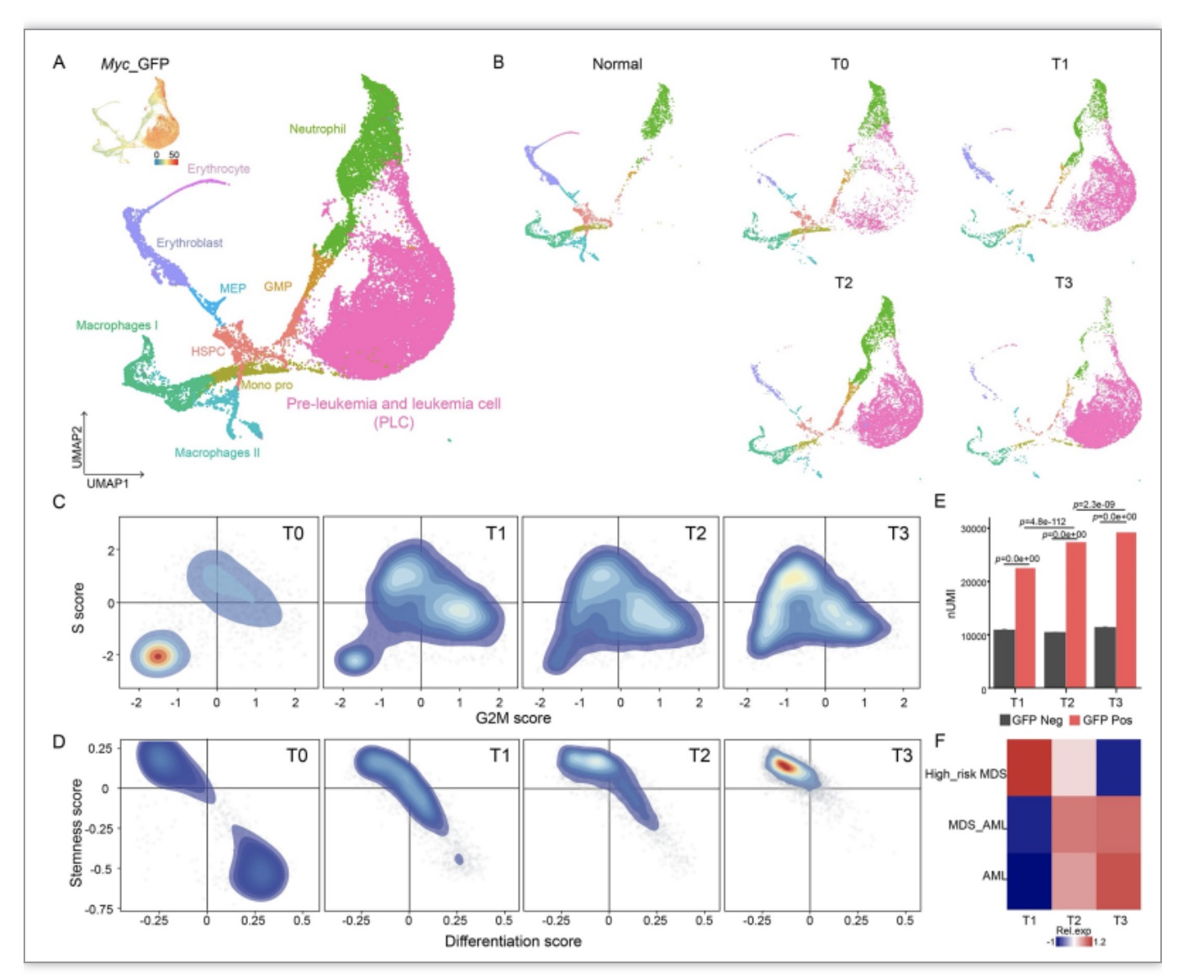
图1 AML肿瘤演进路径多时间点单细胞转录组图谱
(图源:Wu B, et al., PLOS Biology, 2023)
研究进一步发现起始细胞向AML恶性转化的临界点(tipping point)。通过分析该临界点的基因表达谱和蛋白互作网络,筛选出临界点上影响细胞恶性转化的关键基因NPM1和PHGDH(图2A-B)。利用CRISPR/Cas9基因编辑技术对基因进行靶向敲除,结果发现Npm1、Phgdh的缺失能够有效阻碍小鼠AML的发生发展。此外,Npm1、Phgdh缺失的造血干细胞的组学数据也显示细胞分化相关基因表达增加,干性相关基因表达减少(图2C-G)。
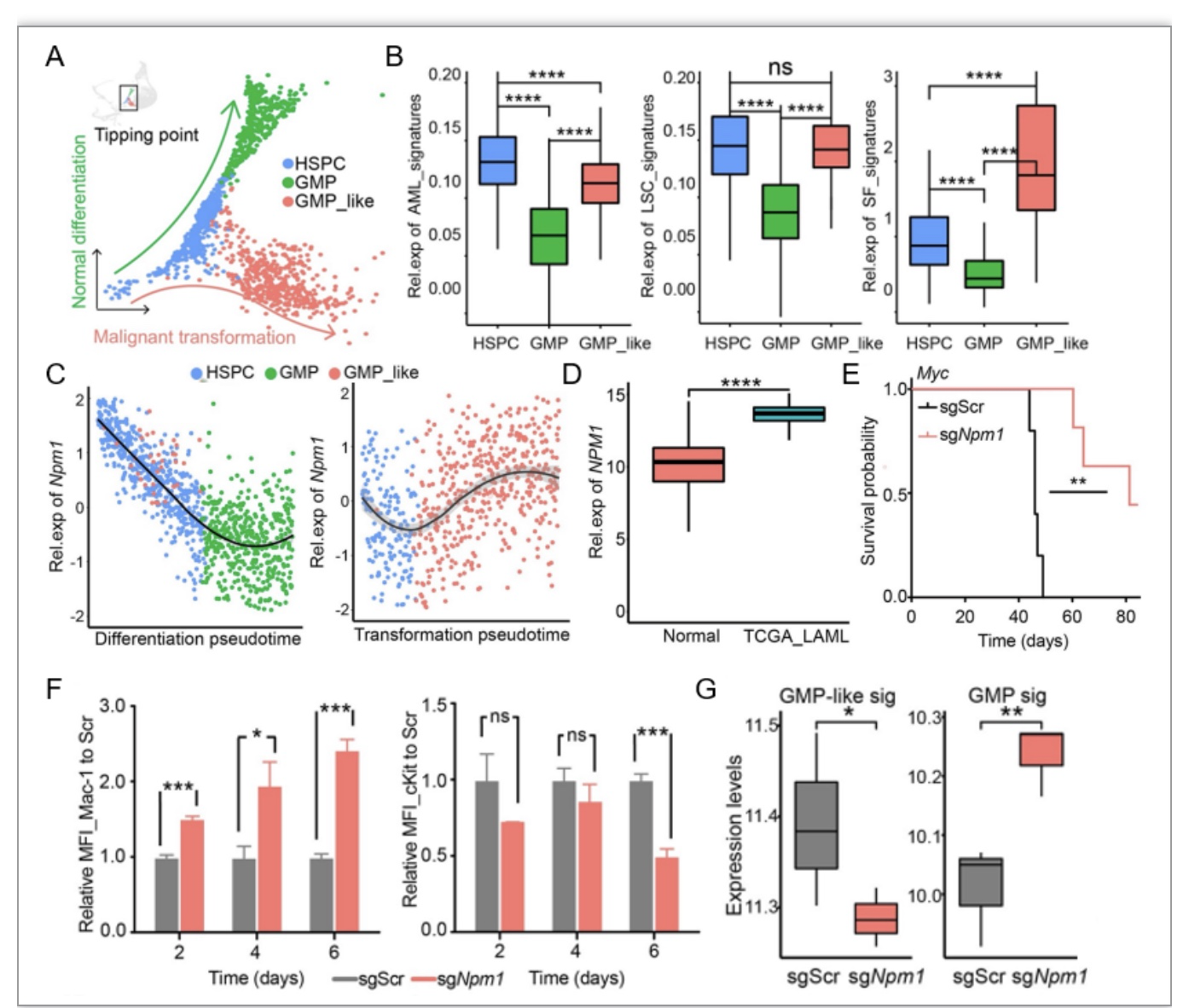
图2 NPM1在AML发生关键阶段高表达促进AML演进
(图源:Wu B, et al., PLOS Biology, 2023)
进一步对肿瘤细胞进行异质性探究,其中 HSP90AA1hi亚群是患者和小鼠AML中共同存在的肿瘤细胞亚群,并与预后不良密切相关,并且可变剪接相关通路在HSP90AA1hi亚群中异常活化(图3A-C)。于是对其可变剪接进行深入探究,对AML细胞进行Smart-seq2 单细胞全长转录本测序,鉴定出HSP90AA1hi亚群中保守的TMEM134的6号外显子跨越(SE)事件(图3D-E)。进一步在多种AML细胞系和病人来源的细胞均检测到TMEM134的6号外显子跨越(SE)事件(图3F)。为验证Tmem134的SE事件能在AML发生发展中的作用。本研究将Tmem134的长、短转录本分别过表达导入到小鼠造血干细胞中并移植到体内,结果证明该SE事件能够显著促进白血病的恶性增殖,而全长的Tmem134阻碍了小鼠AML的发生(图3G)。体外实验证明Tmem134的长转录本Tmem134a能够促进造血干细胞的分化并抑制其生长,而短转录本Tmem134b能促进增殖(图3H)。为了进一步探究Tmem134剪接体对AML细胞的维持作用,本研究构建了内源Tmem134缺失的Myc过表达的小鼠AML单克隆细胞系,并分别过表达Tmem134的长、短转录本,发现该SE事件能够显著促进白血病细胞的生长,而全长Tmem134过表达的小鼠AML细胞生长缓慢(图3I-J)。此外,用同样的方法在内源TMEM134缺失的HL-60、THP-1等多个人AML单克隆细胞系上也证明了TMEM134的异构体对AML细胞生长的作用(图3K)。
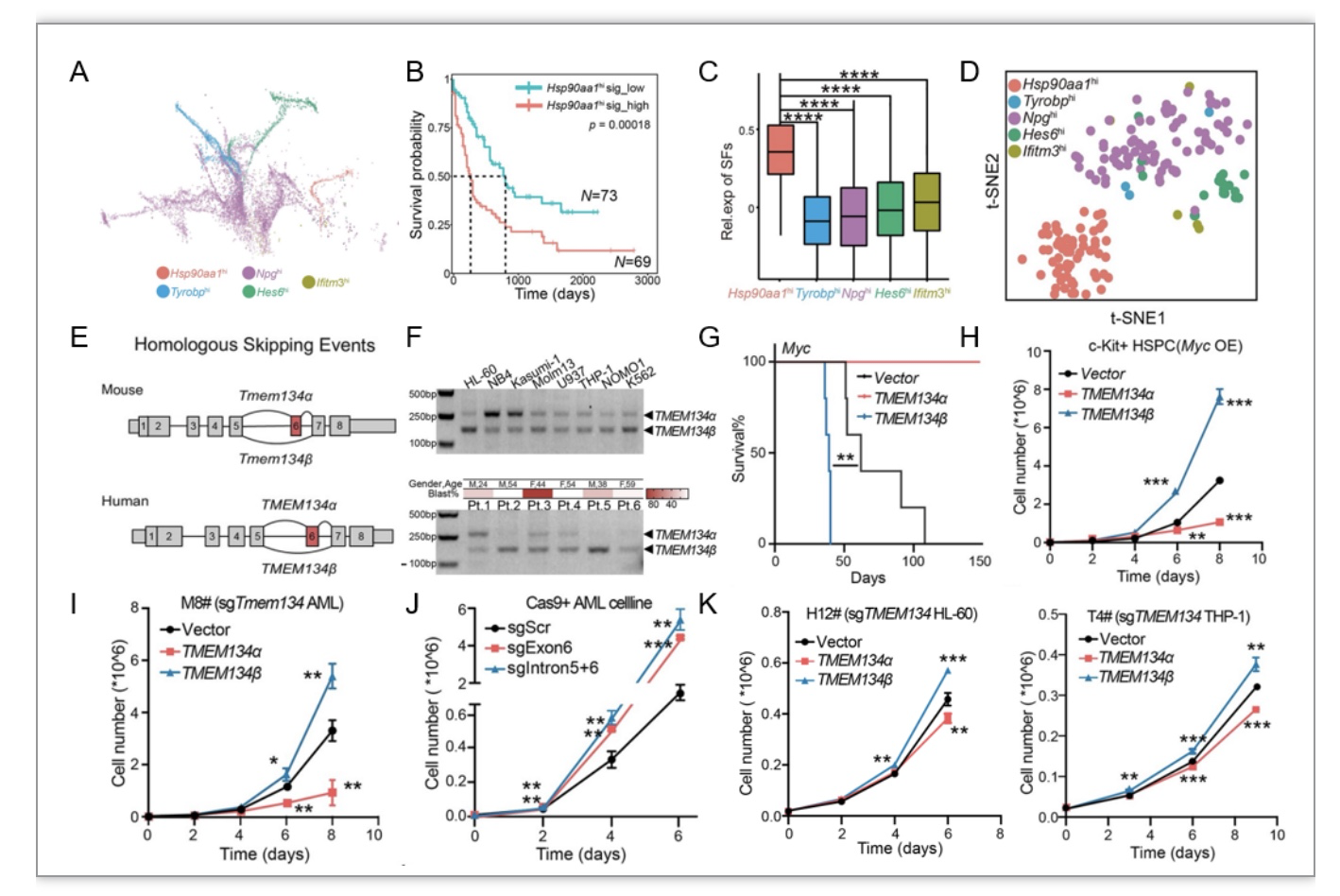
图3 TMEM134剪接异构体促进白血病异质性产生和疾病恶性演进。
(图源:Wu B, et al., PLOS Biology, 2023)
综上所述,本研究在单细胞精度上对AML发生发展全过程的细胞与分子演进路径进行了深入研究,强调了RNA选择性剪接在AML恶性转化的临界点和异质性产生中的重要作用,并探讨了肿瘤特异性的可变剪接事件及它们的作用机制。该工作有助于深入理解AML的发生机制,为AML的早期诊断和干预提供理论基础。







