胸腺源的淋巴细胞(即T细胞)是人的获得性免疫系统的重要组成部分,参与对抗感染和肿瘤等疾病的免疫反应。T细胞的激活、分化、增殖和各种在免疫过程里的功能,都需要由T细胞对造成感染或引起癌变的抗原的识别来启动。如果识别错了,T细胞被无病变的自体抗原激活,就会造成自身免疫性疾病。如果识别不足,T细胞缺乏对特异性抗原甄别,则无法组织起有效的免疫防线。而负责识别抗原的,就是一个叫T细胞受体(TCR)的蛋白分子。识别的过程,需要TCR和一个叫抗原多肽与主要组织相容性复合体(pMHC)的蛋白分子相互作用形成非共价键。
多年来,科学家们一直在测量TCR-pMHC键的各种性质并试图用这些实验观测和理论推理来解释TCR迅速精准的识别。这种高效的敌我识别具备特异性及灵敏性:TCR能察觉在抗原多肽上出现的仅是一个氨基酸的突变极小差别,同时也能在浩如烟海的自体抗原多肽中(>1018)锁定寥寥无几的外敌特征。然而,特异性识别的分子机制和动力学基础仍有待探索,这也是免疫调节领域的核心问题之一,掌握了T细胞抗原识别机制就能有的放矢的对感染和肿瘤进行免疫控制。

通过建立结构弹性物理模型来分析TCR-pMHC键在机械力作用下的逆锁-滑移键的性质,解释了为什么机械力能增加抗原的敏感性,并放大了TCR区分不同抗原的能力。如图1所示,逆锁键,是指在外力作用下,配体受体间非共价键键的解离速率非但不加速,反而减缓。或者说,键的寿命非但不缩短,反而延长。这种行为和直觉相反。依据人们的直觉,外力对键起的作用是破坏性的,会加快解离速率,而不是减缓。或者说,外力应该缩短键的寿命,而不是延长。后面这种行为称之为滑移键。它之所以符合直觉,是因为这种行为正是经常可以被观测到的。通常逆锁键仅在一定的力的范围出现,因为无限增加的外力,总会压倒各种可能的逆锁机制,使得所有的逆锁键在外力足够大时转变为滑移键,也即逆锁-滑移键(图1)。
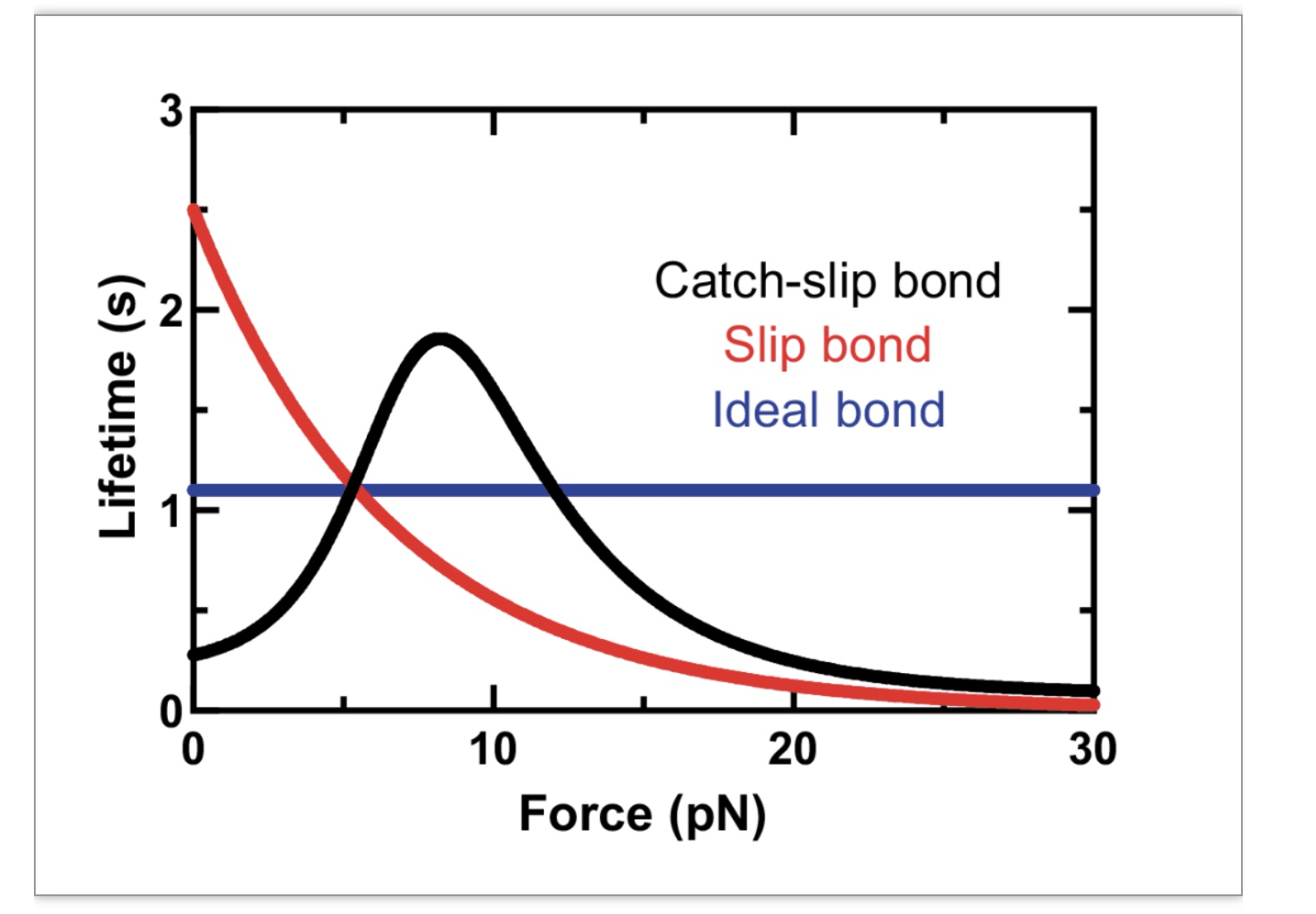
图1. 几类已观测到的键谱
实验上发现TCR与生物活性强的激动剂形成逆锁键(PMID: 24725404),而与生物活性弱的拮抗剂却形成滑移键。这个发现,与其他实验室工作一起,让T细胞研究领域里的工作者们,逐渐认识到机械力对免疫特异性识别的重要作用,特别是力通过TCR-pMHC逆锁键对T细胞激活的调控作用。
作者们观测到肿瘤病人身上的一些pMHC分子的基因突变,会抑制TCR-pMHC逆锁键的形成。去年发表在科学杂志(Science)上的斯坦福大学Christopher Garcia实验室的一篇文章,用筛选逆锁键的办法,寻找对肿瘤产生免疫反应的TCR(PMID: 35389803)。因为作者提示了逆锁键在肿瘤及其他疾病的免疫治疗上可能的应用,该文进一步增加了TCR-pMHC逆锁键的热度。但是,TCR-pMHC逆锁键与被激活的TCR的信号强度及T细胞的反应烈度之间的关系及作用机制仍有待进一步阐述。
本文为上述核心问题的解决做出贡献,作者们开发了基于TCR和pMHC分子结构-弹性物理原理及化学反应动力学速率理论的数学模型,刻画了在不同结构-弹性参数下TCR-pMHC特异的逆锁-滑移键形成。图2A展示了该模型的分子构型变化及相应的一维自由能级图,以及机械力驱动下构象变化产生的不同过渡状态δ*。当力低于最佳值(Fopt)时,由于熵的作用,柔性区域收缩,机械力使势垒高度(红色)相对于零力构象(黑色)升高,相应于逆锁键;当力高于Fopt是,机械力不再有柔性缓冲,而直接拉伸大分子结合面,降低其势垒高度(蓝色),相应于滑移键。可见,正是由于外力对分子相互作用的能量调控的这种非单调行为产生了逆锁-滑移键。与一般的两态模型相比,该模型利用独特的结构特征及弹性分布(图2B)可区分I类和II类MHC分子。
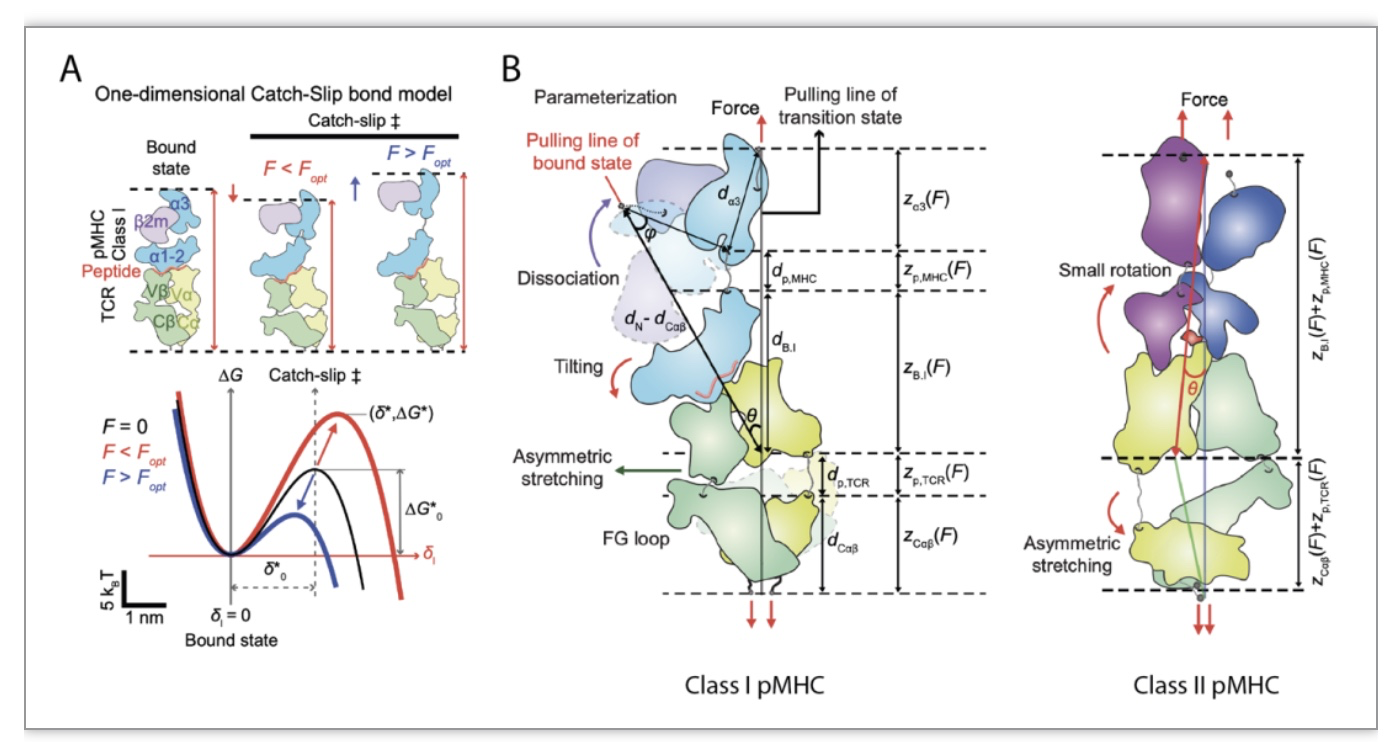
图2. TCR-pMHC逆锁-滑移键理论模型
(图源:Choi, et al., Nature communication, 2023)
该文进一步运用以上模型分析了在作者们写文章时已发表的所有TCR-pMHC逆锁键与滑移键实验数据集。这些分析展示出新建的模型定量地整合和分类广泛TCR-pMHC逆锁-滑移键的行为的能力,并成功地将其结构参数与TCR-pMHC触发T细胞激活的能力联系起来。为了减少数据的表述纬度,并从力依赖性成键的寿命的数据中定量地提取更多的信息,我们定义了一个比例参数,称之为逆锁键强度(I),它是两个长方形的面积比:Dt × Fopt除以tpeak × Frange。值得注意的是,这个组合的参数,逆锁键强度,与不同TCR系统的配体效力有最好的相关性(图3)。
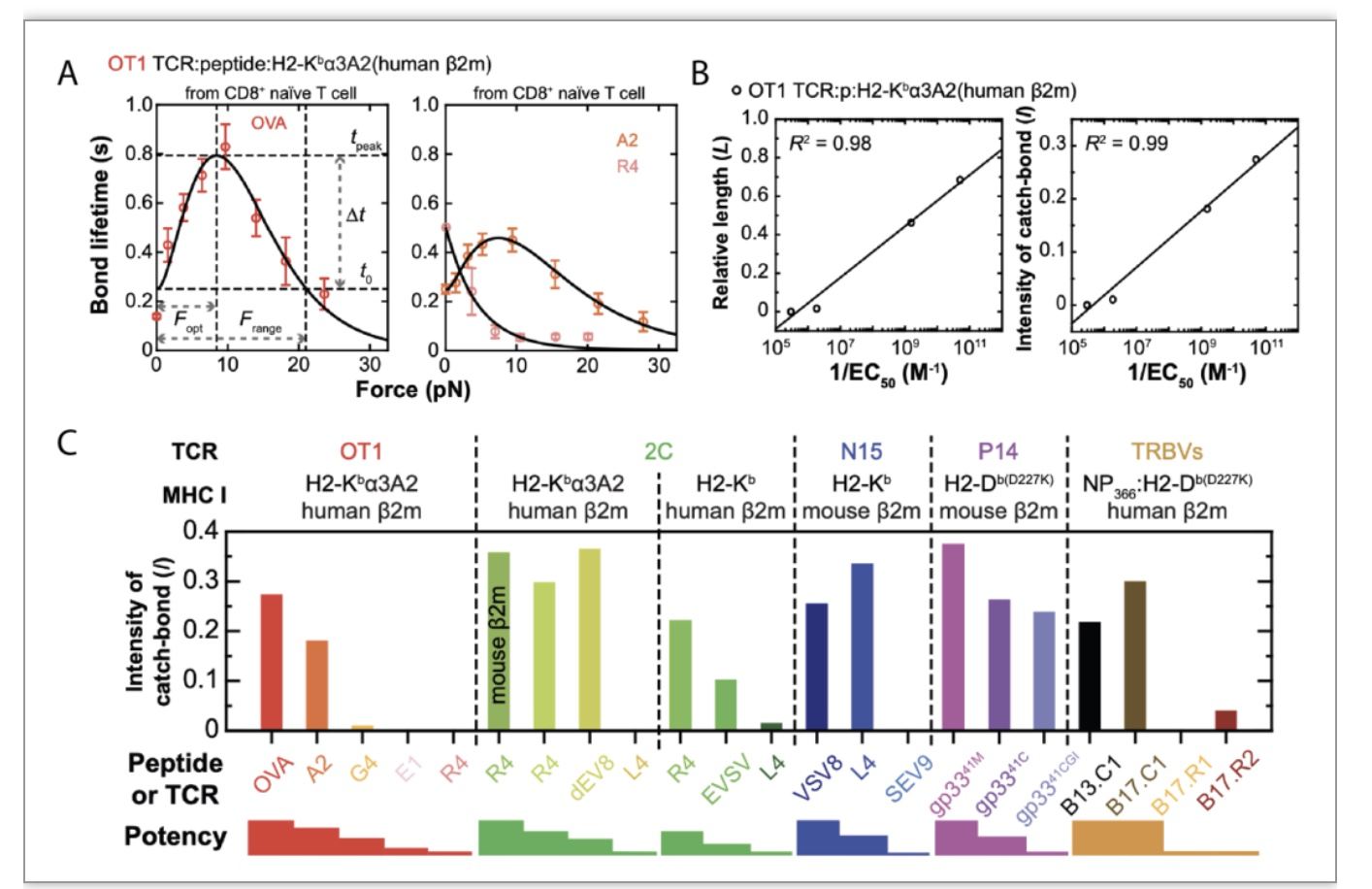
图3. 逆锁键强度与T细胞效力相关性
(图源:Choi, et al., Nature communication, 2023)

