
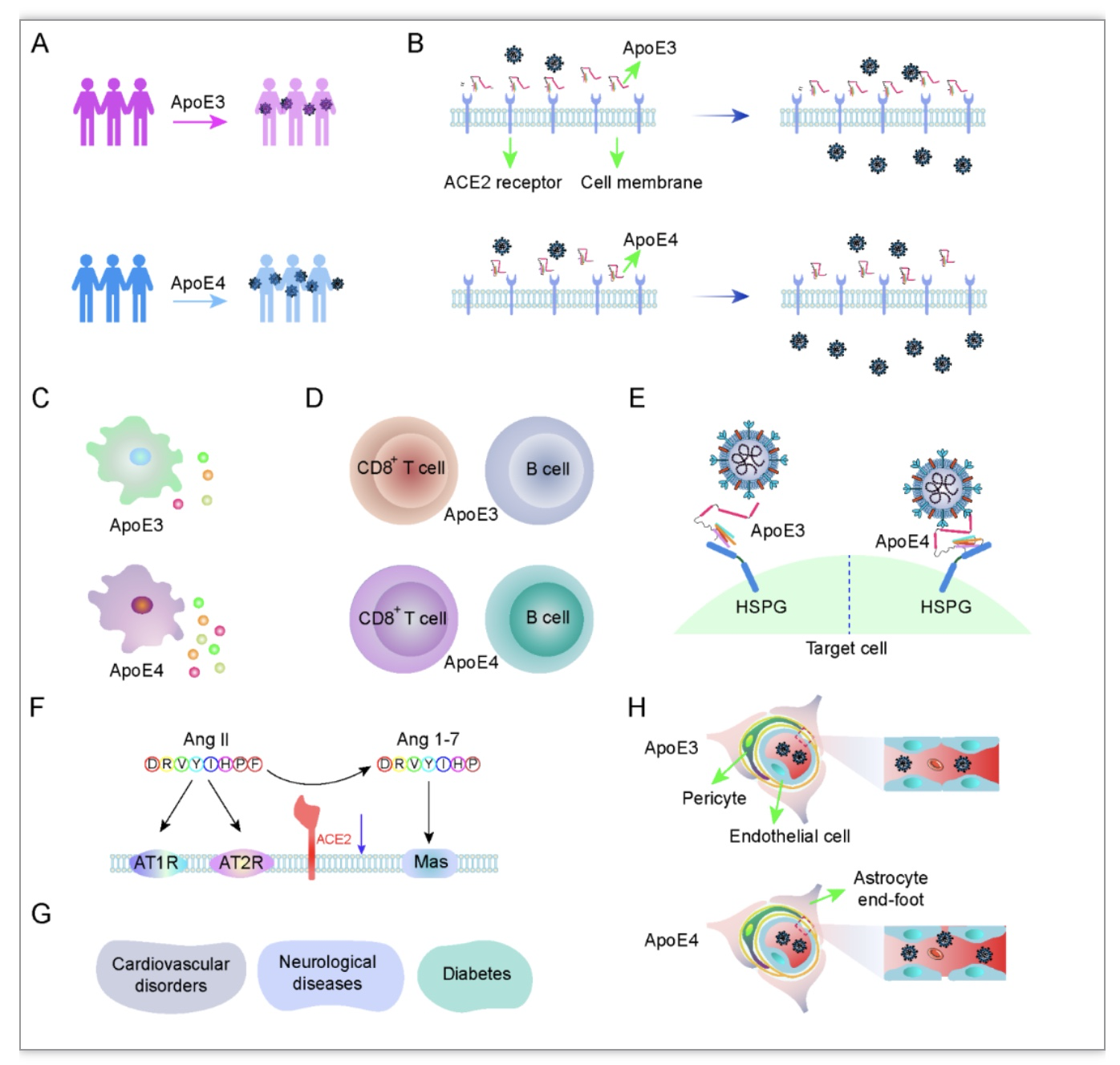
一、ApoE4是SARS-CoV-2重要遗传易感基因
SARS-CoV-2的Spike蛋白受体结合结构域(RBD)通过与血管紧张素转换酶2 (ACE2)受体相互作用入侵宿主细胞。Kuo等人发现ε4/ε4纯合子个体患SARS-CoV-2的风险和因COVID-19致死的风险与ε3/ε3纯合子相比明显增高[1, 2],ApoE4增加COVID-19易感性和疾病严重程度的潜在机制陆续被报道(图1)。将不同ApoE基因型的人源可诱导多能干细胞诱导成星形胶质细胞和神经元,结果发现,相较于ApoE3细胞, ApoE4星形胶质细胞和神经元更容易受到SARS-CoV-2感染,并且感染后病毒对细胞的毒性更强 [3]。值得注意的是ApoE4小鼠表现出COVID-19加速进展和更差的生存预后,这可能是因为病毒感染增强和适应性抗病毒免疫抑制[4]。Xu和同事发现,相对于ApoE3, ApoE4轻度阻碍了Spike与ACE2受体的结合,这可能是由于ApoE4的结构比ApoE3更紧凑,仅能较轻微的减少Spike/ACE2介导的SARS-CoV-2假病毒感染[5]。ApoE4与HSPGs之间较高的结合亲和力可能会促进病毒感染。ApoE4与神经退行性疾病、糖尿病和心血管疾病的发病有关,这些合并症可能会影响COVID-19的发生发展[6-8]。除了作为SARS-CoV-2的主要受体外,ACE2被认为是肾素-血管紧张素系统(RAS)的拮抗剂,在心衰、高血压、心肌梗死、阿尔茨海默病(AD)、糖尿病和急性肺损伤等多种疾病中发挥多重保护作用[9, 10]。ApoE4与ACE2表达降低有关[11],这也可能是ApoE4导致COVID-19严重程度的原因之一。综上,ApoE4可通过多种潜在机制介导SARS-CoV-2感染和疾病进展,还需要通过更多的实验进一步证实。此外,ApoE基因多态性是否影响SARS-CoV-2的生命周期目前尚不清楚。
二、 ApoE4协同HSV-1增加AD风险
HSV-1在正常人和AD患者的大脑中普遍潜伏,可被多种刺激重新激活,如压力、炎症等[12]。AD的病因假说有多种,如tau假说、Aβ级联假说、ApoE级联假说等。长期以来,AD的“感染理论”并没有得到足够的重视。随着AD的感染病因实验证据的积累,引发了研究者从主流假说到病原体感染和抗菌保护假说转变的思考。特别是HSV-1,由于其能够引起复发性、终生感染而引起广泛关注。感染HSV-1可触发神经炎症、Aβ产生和磷酸化tau的积累。尸检证据已经证实在AD的脑组织中存在HSV-1 DNA。与健康对照组相比,HSV-1 DNA在AD患者大脑中出现的频率更高[13],病毒DNA在Aβ斑块附近尤为明显[14]。
三、ApoE4促进HIV感染
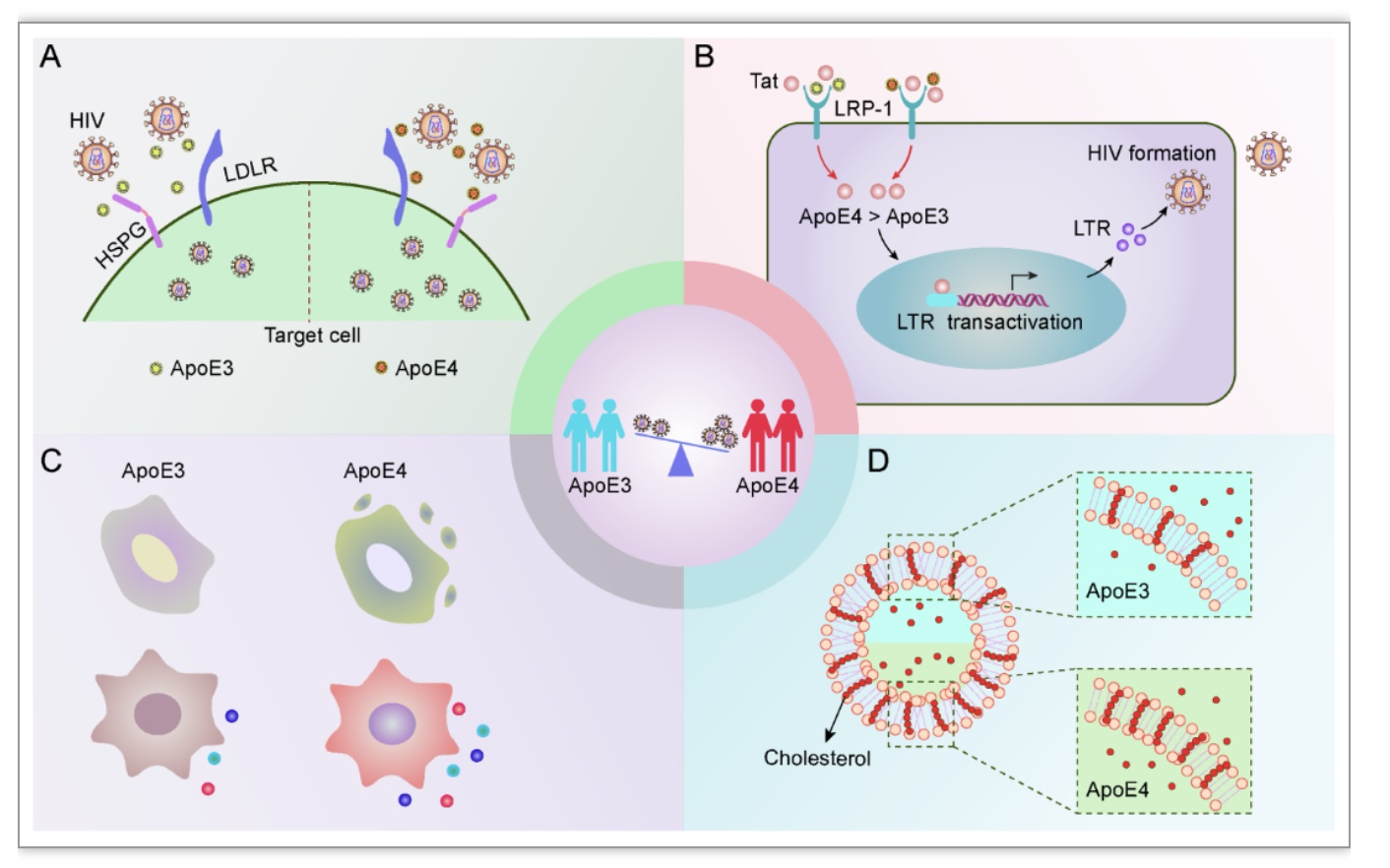
目前还没有治愈AIDS的方法,需要进一步探索AIDS的发病机制。胆固醇是HIV包膜的重要组成部分。ApoE在胆固醇转运中发挥重要作用,越来越多的证据强调ApoE与HIV感染之间的相关性。尽管还存在争议,研究报道ApoE4与HIV-1感染增强、疾病进展以及HIV相关神经认知障碍发生率增加相关(图2)。ApoE亚型如何差异性调控HIV-AIDS发病?Tat是HIV-1复制所必需的蛋白,并作为LRP1的配体。研究发现,ApoE4与Tat竞争LRP1结合的能力不如其它ApoE亚型,阻碍了Tat的内化和Tat介导的LTR的转录激活[19]。因此,ApoE模拟肽可能是一种潜在的治疗HIV-1感染的候选药物。ApoE亚型的差异效应也可能在HSPG的附着水平上发挥作用,这是HIV感染的限速步骤[20]。此外,病毒包膜上的ApoE可将HIV颗粒靶向LDLR以促进病毒的进入细胞[21]。此外,ApoE4在促进胆固醇从细胞流出方面不如ApoE3有效,造成ApoE4纯合子中质膜筏相关胆固醇的积累,从而增强病毒感染[22, 23]。ApoE不同亚型差异性调控免疫功能也可能会加速AIDS进展。综上所述,进一步的纵向随访研究和更大的样本量以阐明ApoE亚型依赖性对HIV感染的影响是必要的。此外,ApoE基因多态性与HIV-1不同亚型之间的关系有待进一步明确。
四、ApoE4预防HCV感染
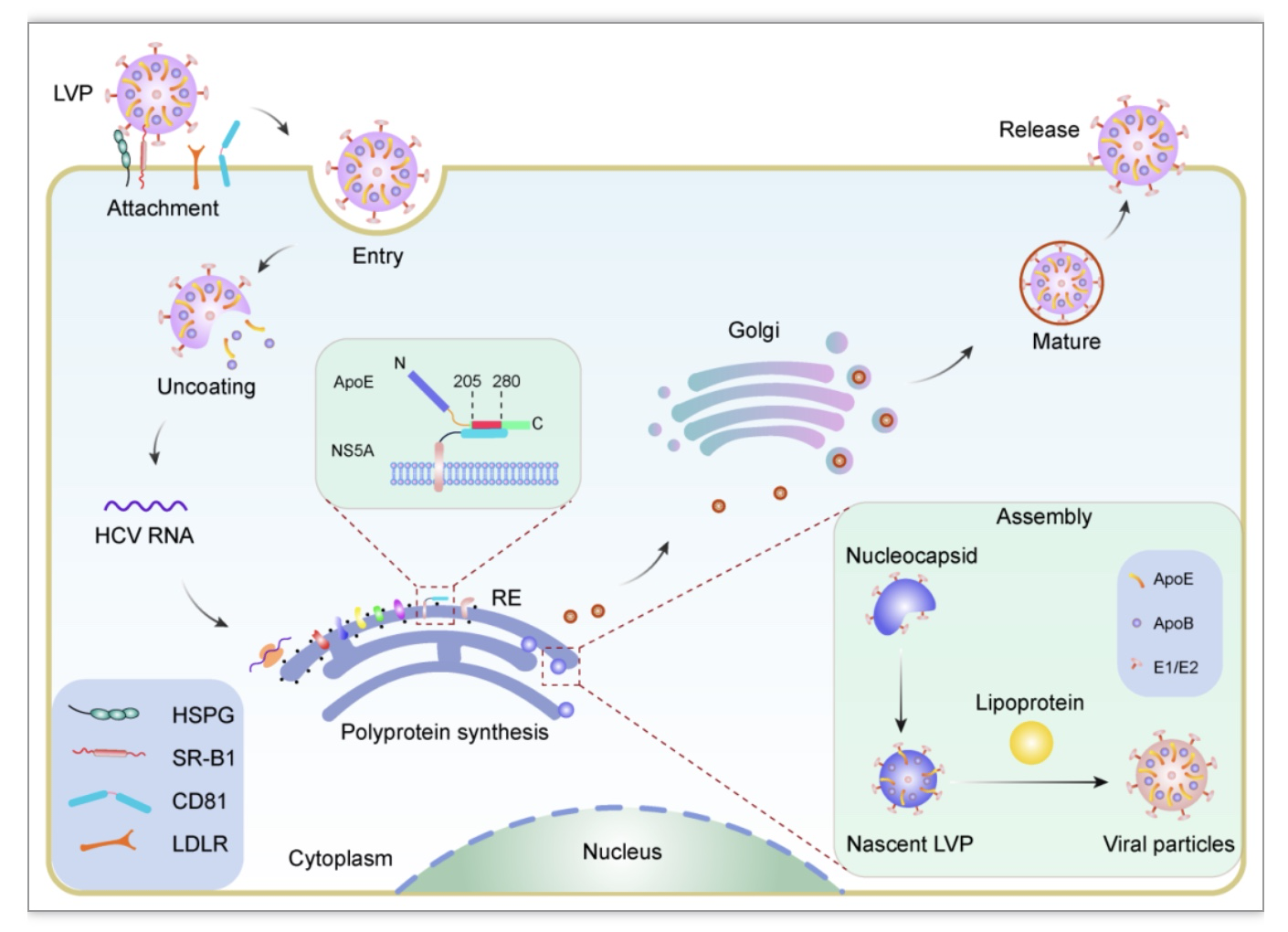
ApoE参与HCV的进入、复制、组装和释放,可能是控制HCV感染的潜在候选治疗靶点(图3)。ApoE通过与HSPG相互作用促进HCV的附着,其中syndecan-1和syndecan-4是介导病毒附着的主要HSPG[24, 25]。此外,ApoE通过与肝细胞表面LDLR和SR-B1相互作用增强HCV进入细胞[26]。ApoE的缺失减少了细胞外HCV颗粒的形成,而不影响细胞内病毒核衣壳或病毒包膜的数量[27],表明ApoE可能参与了HCV的后期组装步骤,如颗粒成熟。然而,内质网中检测到HCV的ApoE和E2糖蛋白之间的直接相互作用,表明ApoE与HCV的关联也发生在组装的早期阶段[28]。下调ApoE表达显著抑制HCV颗粒的产生,而外源性过表达ApoE的C端结构可以恢复HCV颗粒的产生,表明ApoE在HCV的产生中起着重要作用[29]。ApoE与病毒的结合也使病毒具有逃避抗体的能力,为开发预防性丙型肝炎疫苗提供了重要指导。研究报道,在HCV感染患者中,ε4等位基因的出现频率明显较低。与ε3等位基因相比,ε4等位基因对HCV感染具有保护作用,可减缓HCV引起的肝纤维化。ApoE4如何预防HCV感染和疾病病理?首先,ApoE4诱导的高β-脂蛋白血症能够影响LDLR介导的病毒摄取,这是因为游离β-脂蛋白蛋白和病毒-脂蛋白颗粒在游离LDLR位点上的竞争性结合[30]。此外,ApoE4个体中较低的LDLR浓度可能会减少HCV在肝细胞之间的传播[31]。综上,作为病毒颗粒的一部分,ApoE不仅参与了HCV在细胞表面的附着和进入,还参与HCV病毒颗粒在细胞中的组装和释放过程。更好地了解HCV的生命周期,建立合适的体外模型来模拟HCV进入细胞的复杂过程,有助于阐明ApoE及不同ApoE亚型在HCV感染中的作用。
五、ApoE对HBV的感染和产生有重要作用
六、 总结与展望

