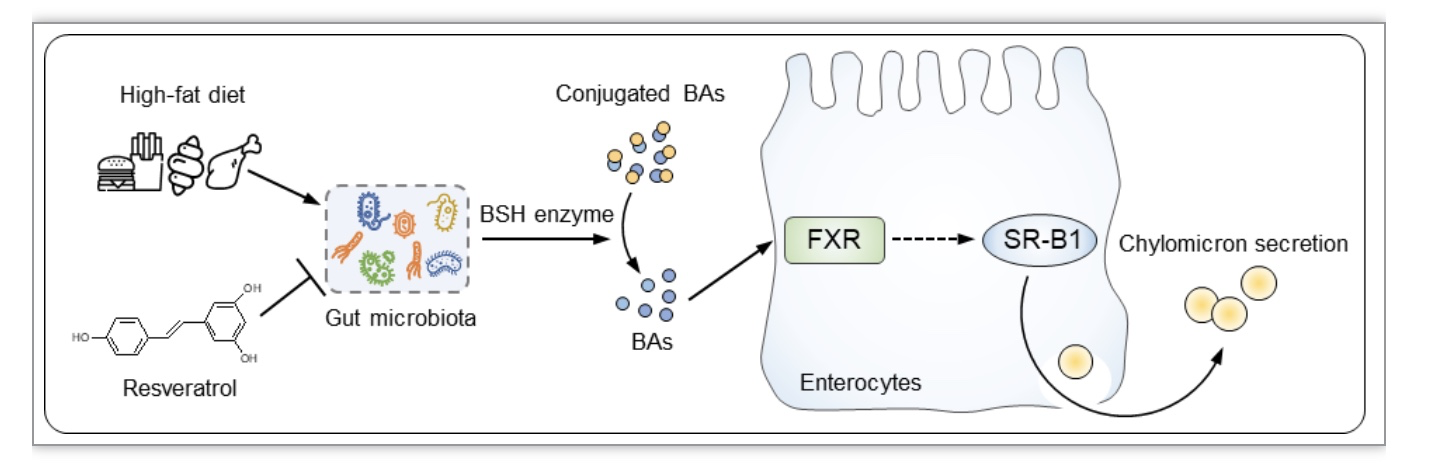
以白藜芦醇(Resveratrol,REV)为代表的多酚类植物化学物在动物模型和人群试验中均显示出改善胰岛素敏感性和能量稳态的作用[1]。但是,一方面,这些植物化学物没有明确的受体,通常能够调控多个器官的代谢和多条信号通路。另一方面,它们的生物利用度极低,无论摄食多少,血浆中的浓度不会超过1 μM。因此,这些植物化学物发挥作用的机制一直困扰着广大生物医学、药学和营养学研究者们。因为这些多酚类化合物通常在肠道以高浓度蓄积[2],人们推测其可能通过与肠道菌群相互作用来调控机体代谢[3, 4]。
该研究利用肠道菌群测序、粪菌移植和代谢组学分析等方法,揭示肠道菌群是REV的直接作用靶点,并阐明REV通过调控肠道菌群及其胆汁酸代谢物的组成,抑制肠道FXR诱导的SR-B1蛋白表达,从而减少肠道乳糜微粒分泌的新机制。

肠道过度产生乳糜微粒是胰岛素抵抗的一个重要表现。乳糜微粒中富含甘油三酯(TG),是所有脂蛋白(包括VLDL、LDL和HDL等)中体积最大的,其标志性载脂蛋白为ApoB48[5]。在给予高脂膳食喂养的C57BL/6J小鼠中,每日REV(0.5%,w/w)拌饲喂养8周可显著抑制餐后血浆脂质蓄积(图1a, b)。在分离出的富含TG的脂蛋白(TRL,主要是乳糜微粒)中,TG和ApoB48蛋白的水平也在REV干预后显著降低(图1c, d),提示REV可减少肠道乳糜微粒的分泌。从肠道基因表达水平来看,REV干预显著降低了乳糜微粒分泌相关蛋白SR-B1的表达及其在顶侧细胞膜的分布,同时增加了脂肪酸β氧化相关基因(包括Acadm,Ehhadh和Cpt1a)的表达(图1e-g)。
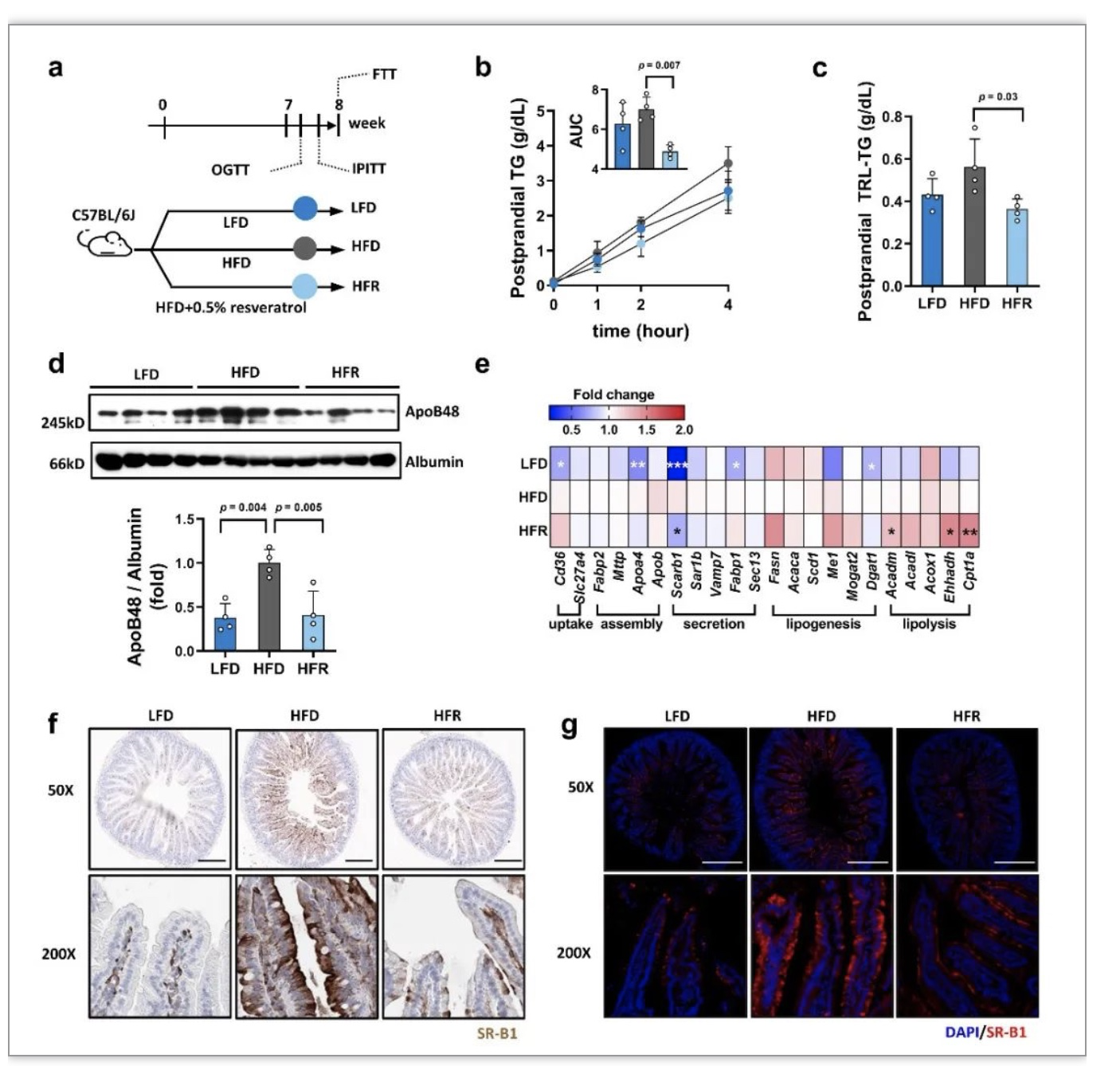
图1 REV干预对乳糜微粒分泌和肠道SR-B1蛋白表达的影响
(图源:Pang et al., Nat Commun, 2023)
为进一步验证REV抑制肠道乳糜微粒分泌的作用是否主要依赖于抑制肠道SR-B1蛋白的表达,研究人员利用Cre-Loxp系统构建了肠道特异性SR-B1敲除(iScarb1-/-)小鼠(图2a)。相对于野生型(Scarb1fl/fl)小鼠,高脂膳食喂养的iScarb1-/-小鼠本身餐后脂质蓄积和乳糜微粒分泌减少,而REV干预未能进一步抑制iScarb1-/-小鼠肠道乳糜微粒分泌和刺激脂肪酸β氧化相关基因的表达(图2b-e)。接下来,研究人员采用另一种策略来验证REV的作用是否依赖于抑制肠道SR-B1蛋白,即利用REV与SR-B1特异性抑制剂BLT-1共同干预高脂膳食喂养的小鼠(图2f)。结果表明,REV或BLT-1单独干预均可抑制餐后血浆脂质蓄积和肠道乳糜微粒分泌,但两者共同干预没有叠加的效应(图2g-l),提示REV与BLT-1均依赖于抑制SR-B1蛋白发挥作用。
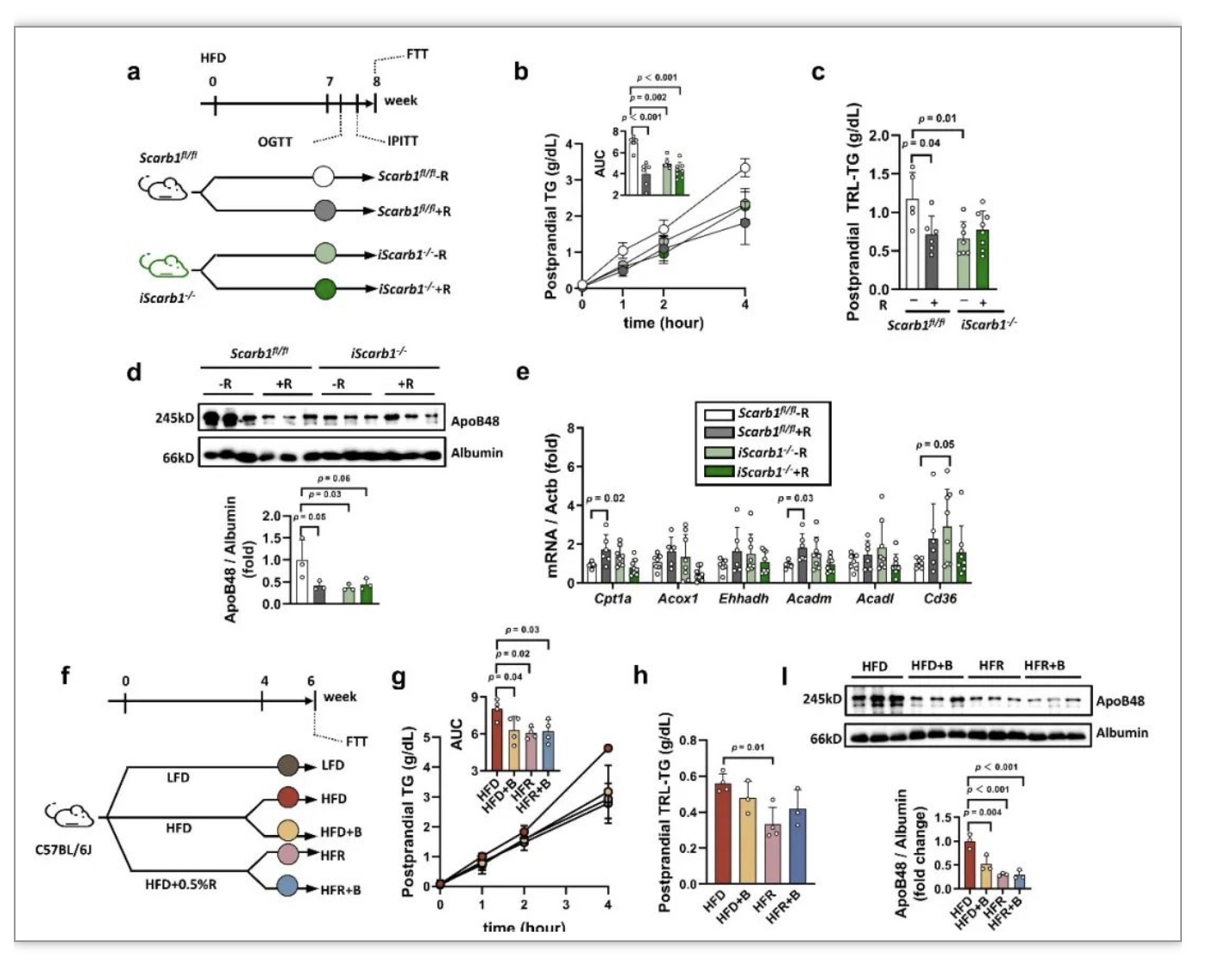
图2 REV减少乳糜微粒分泌的作用依赖于抑制肠道SR-B1蛋白
(图源:Pang et al., Nat Commun, 2023)
为了进一步探索白藜芦醇抑制SR-B1蛋白表达的上游分子机制,研究人员在体外对人结肠腺癌细胞系Caco-2细胞给予REV原型干预4-8小时,结果表明REV原型对NF-κB和SR-B1蛋白表达无影响(图3a, b)。体外和体内研究结果的差异提示,REV应通过仅存在于体内环境的物质(如肠道菌群)来发挥作用。接下来,研究人员进行了粪菌移植试验(图3c)。在高脂膳食喂养4周的受体小鼠中,移植REV干预后的小鼠粪便3次,即可显著抑制受体小鼠餐后血浆脂质蓄积、肠道乳糜微粒的分泌和肠道SR-B1蛋白的表达(图3d-g)。这些结果表明,REV通过作用于肠道菌群来抑制肠道SR-B1蛋白的表达。
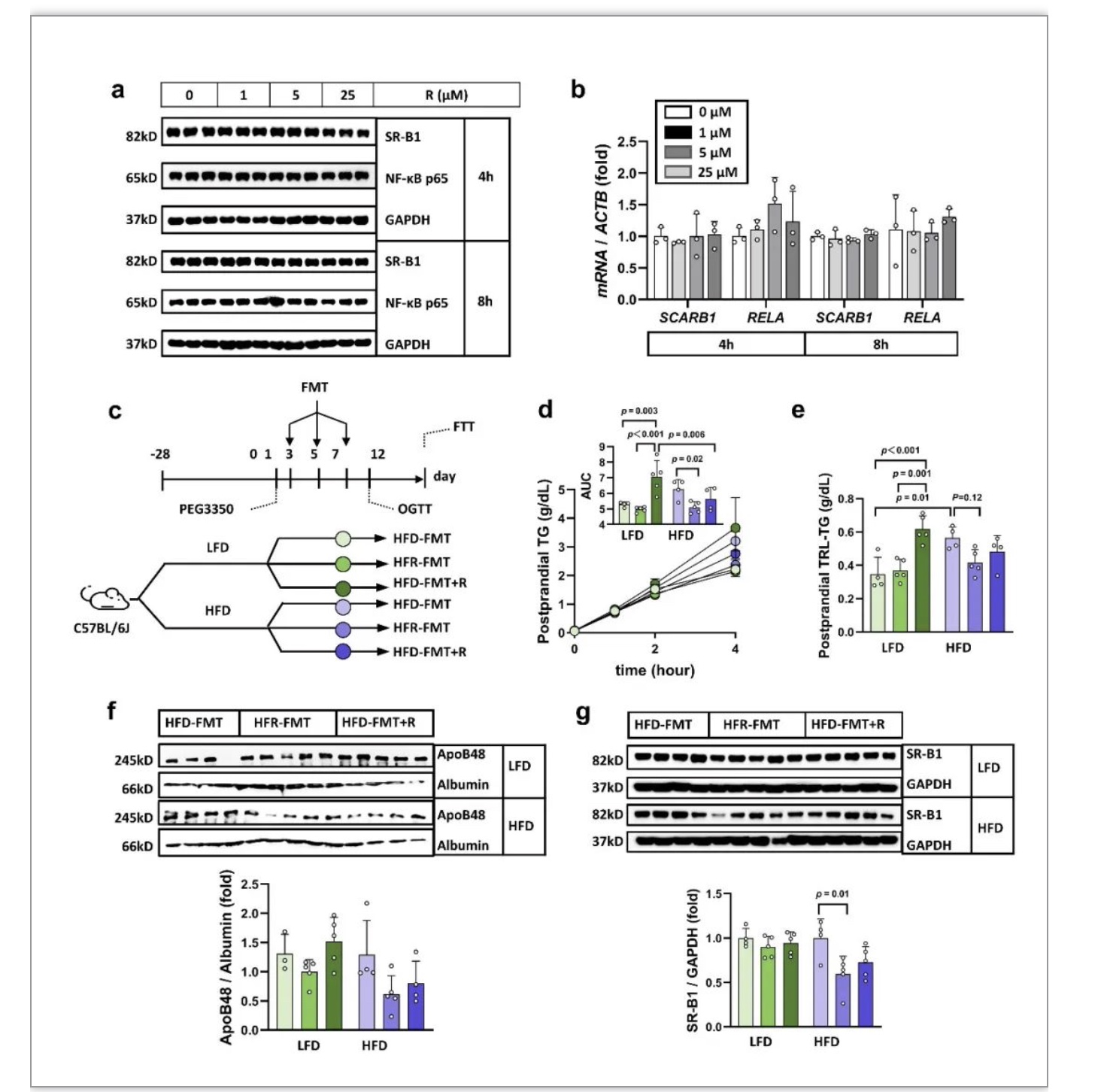
图3 REV的直接作用靶点是肠道菌群
(图源:Pang et al., Nat Commun, 2023)
那肠道菌群的改变如何影响肠道SR-B1蛋白的表达呢?肠道菌群的代谢可产生许多小分子代谢物,包括短链脂肪酸,胆汁酸,氧化三甲胺和色氨酸衍生物吲哚等[6]。研究人员对小鼠粪便提取物进行了代谢组学检测,发现REV干预后的小鼠粪便中胆汁酸包括鹅去氧胆酸(CDCA)和去氧胆酸(DCA)的水平显著降低(图4a),且REV干预组的差异代谢物主要富集在鞘脂和胆汁酸代谢相关通路(图4b)。那REV对肠道菌群的影响如何导致小鼠粪便中胆汁酸CDCA水平降低呢?研究人员利用16S rRNA测序技术对REV干预后的小鼠粪便肠道菌群组成进行了分析,结果发现REV显著抑制了生成胆盐水解酶(BSH)相关菌属的水平,包括乳酸杆菌属、双歧杆菌属和肠球菌属等(图4c)。相应地,REV干预也降低了小鼠粪便中BSH酶的活性(图4d)。BSH酶可将结合型胆汁酸转变为游离型[7],REV干预则抑制了粪便中牛磺酸结合型CDCA(TCDCA)向CDCA的转变,使得血清中结合型胆汁酸水平升高,而游离型胆汁酸水平降低(图4e-f)。
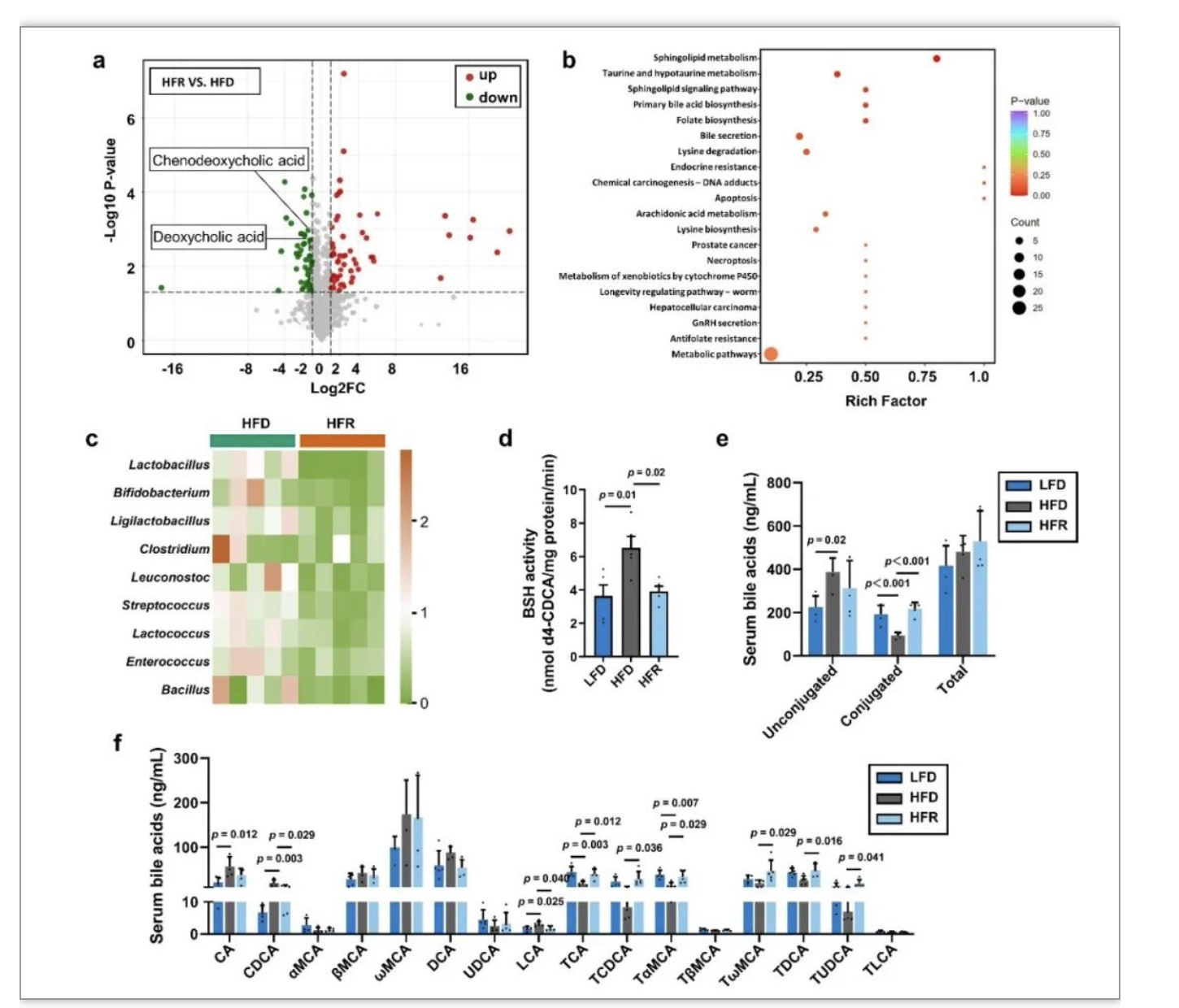
图4 REV干预抑制了肠道菌群BSH酶活性和粪便中胆汁酸水平
(图源:Pang et al., Nat Commun, 2023)
CDCA是目前已知天然存在的FXR核受体最强激动剂,而以往研究提示FXR可以正向调控SR-B1的表达[8]。接下来,研究人员利用CDCA在体外干预Caco-2细胞,发现CDCA可以刺激FXR和SR-B1的表达(图5a)。最后,为了验证REV抑制肠道SR-B1的作用是否依赖于抑制FXR,研究人员利用GW4064(FXR合成激动剂)与REV一起干预C57BL/6J小鼠。结果表明,在GW4064干预后,REV抑制餐后血浆脂质蓄积和肠道SR-B1表达的作用消失(图5b-e),表明REV通过抑制胆汁酸-FXR轴减少肠道SR-B1蛋白的表达。
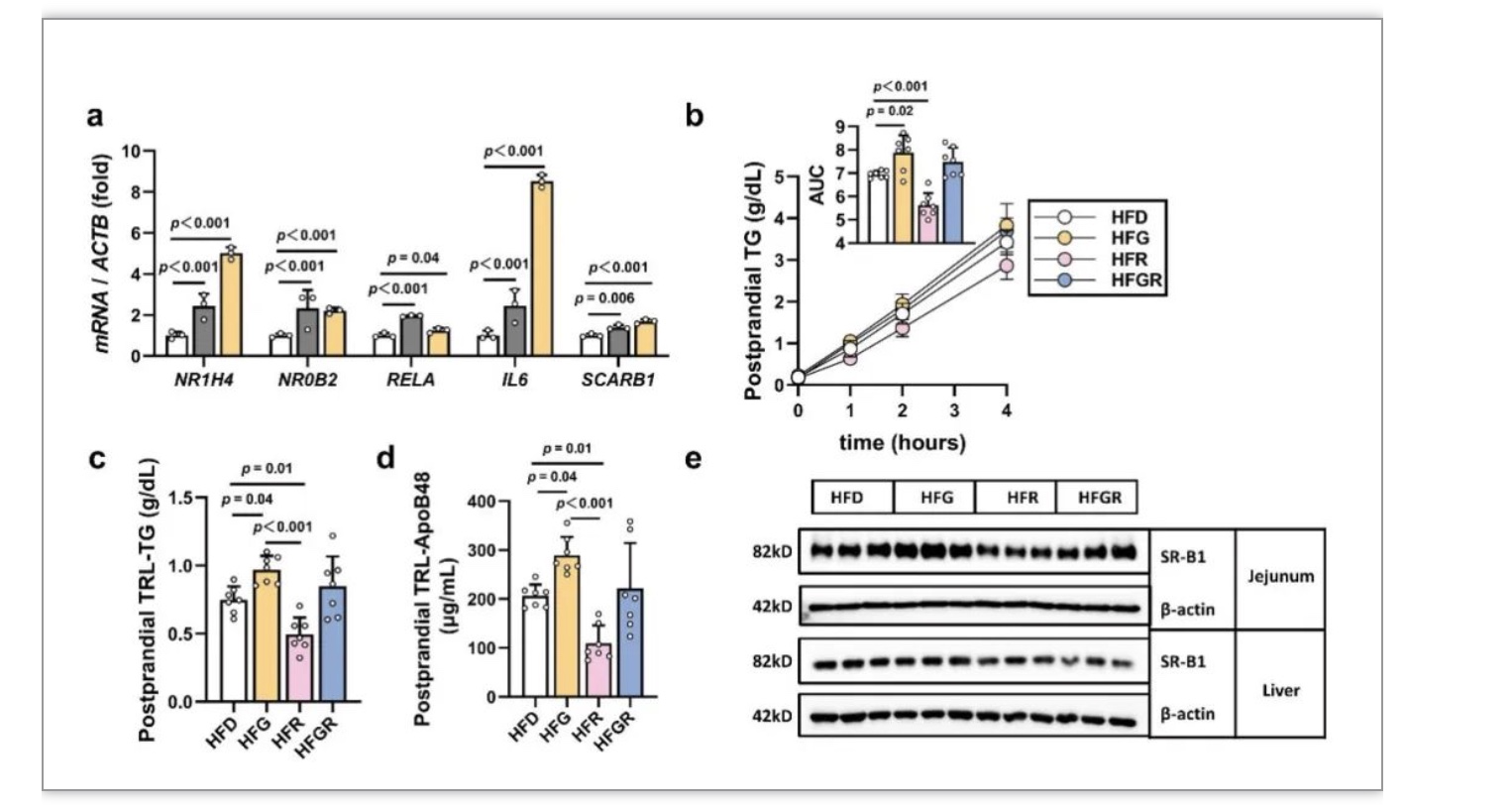
图5 REV通过抑制FXR活性减少乳糜微粒分泌和肠道SR-B1蛋白表达
(图源:Pang et al., Nat Commun, 2023)