三阴性乳腺癌(triple-negative breast cancer,TNBC)约占所有乳腺癌的15%,恶性程度高,容易复发和转移,预后较差,平均生存期是13个月,严重危害女性的身体健康。尽管在过去20年针对TNBC治疗策略付出了努力,其治疗策略有限,并且死亡率没有明显改变。因此,当前科研的重点之一是研发针对TNBC的靶向药物。
Notch信号与调控多种癌症发生,转移和耐药有关。靶向Notch信号通路是当前药物研发的热点。已知在NIH登记注册的9个Notch抑制剂治疗乳腺癌的临床实验中(ClinicalTrials.gov),已有5个泛Notch抑制剂临床研究终止,另外2个泛Notch抑制剂MK-0752自从2012年完成II期临床研究后没有继续开展新的临床研究。主要原因可能是不同的Notch蛋白在不同癌症以及癌症不同亚型中的生物学功能不同。泛Notch抑制剂抑制所有Notch蛋白功能后,导致药物临床疗效减弱和引起严重副作用,不得不终止临床实验。研究不同Notch蛋白在不同亚型乳腺癌中作用对于乳腺癌的靶向药物研发有重要意义。
该研究探讨了Notch4在三阴性乳腺癌中的作用,发现沉默Notch4通过上调胚胎干细胞的多能性因子Nanog表达,进而增强三阴性乳腺癌细胞的成瘤能力。研究发现沉默Notch4通过下调细胞极性形成的关键分子Cdc42表达进而抑制三阴性乳腺癌细胞转移。Cdc42表达下调使波形蛋白Vimentin在细胞核周围呈弥漫性分布,而不是减少Vimentin的表达来抑制上皮间质转换(epithelial-mesenchymal transition, EMT)。这一研究结果表明,沉默Notch4虽然可以抑制三阴性乳腺癌转移,却增强三阴性乳腺癌的肿瘤成瘤能力,提示靶向Notch4可能不是三阴性乳腺癌药物研发的潜在靶点。

本研究首先探讨沉默Notch4对三阴性乳腺癌成瘤的影响。结果发现Notch4主要在三阴性乳腺癌细胞中表达,提示Notch4可能是三阴性乳腺癌的关键调控因子。临床数据发现在淋巴结转移的三阴性乳腺,低表达Notch4的患者总生存率差,无病生存期短,提示淋巴结转移的乳腺癌低表达Notch4更容易复发。实验结果也说明三阴性乳腺癌干扰Notch4后克隆形成能力增强,提示低表达Notch4增强三阴性乳腺癌成瘤能力。考虑到三阴性乳腺癌是基底细胞癌,本研究推测三阴性乳腺癌细胞干扰Notch4后向多潜能干细胞跃迁。本研究检测了5种调控胚胎干细胞调控因子Oct4, Sox2, Nanog, Klf4和C-myc,发现三阴性乳腺癌细胞干扰Notch4后Nanog表达增加。Nanog表达增加也会增强三阴性乳腺癌的成瘤能力。Notch信号主要是激活下游基因的表达,而下游的靶蛋白Hes/Hey家族主要发挥转录抑制作用。本研究检测了HES/HEY家族成员,结果显示三阴性乳腺癌细胞干扰Notch4后Hes3表达降低。在三阴性乳腺癌高表达Hes3抑制Nanog表达和成瘤能力。综上,本研究研究结果说明三阴性乳腺癌沉默Notch4后,下调靶基因Hes3,解除对胚胎干细胞调控因子Nanog抑制作用,导致Nanog表达增加和成瘤能力增强。
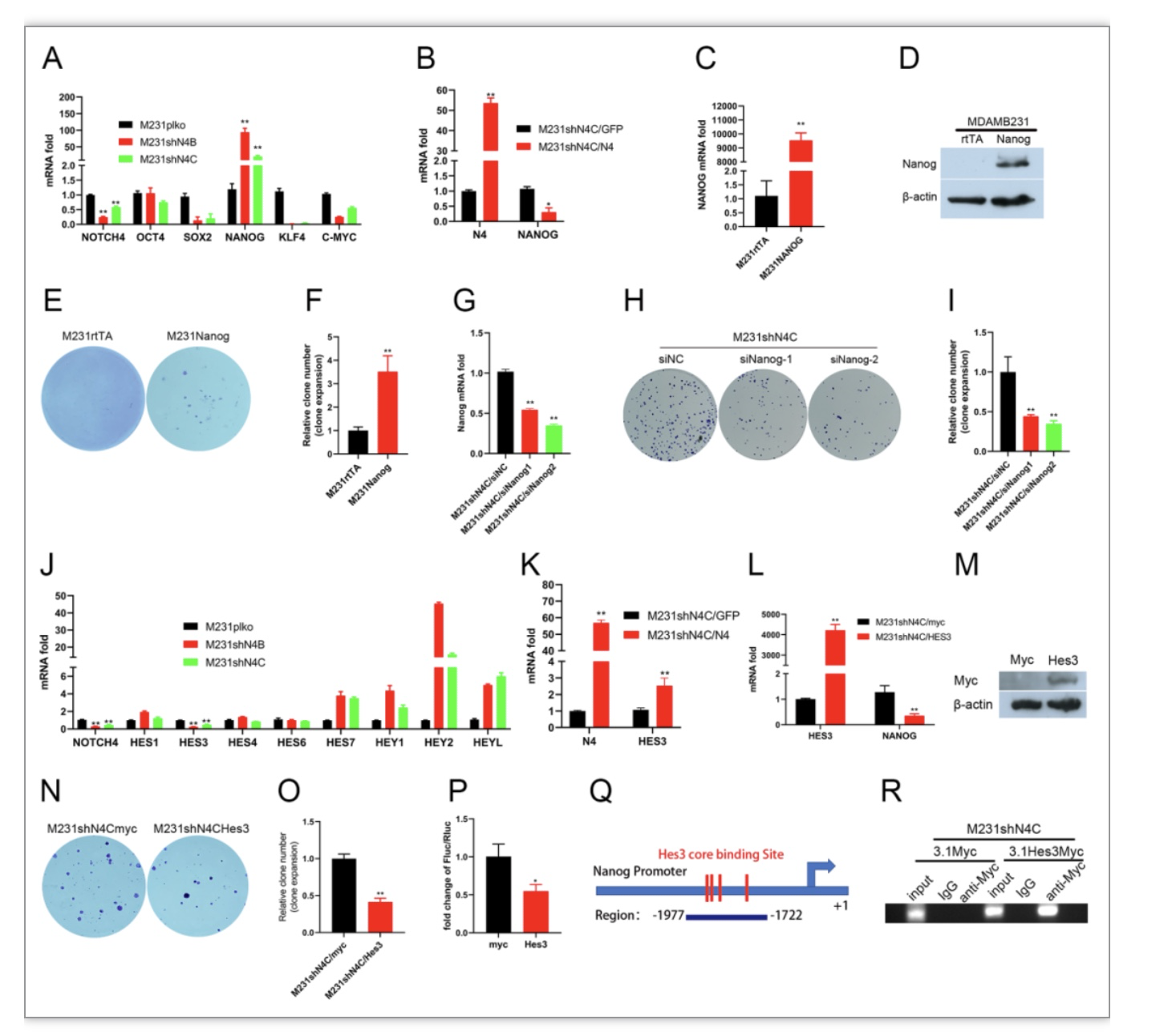
图1 沉默Notch4通过Hes3上调Nanog的表达促进TNBC成瘤
然后课题组研究沉默Notch4对三阴性乳腺癌转移的影响。结果发现三阴性乳腺癌沉默Notch4后转移能力降低。上皮间质转换是癌症的关键步骤。考虑到沉默Notch4后转移能力降低,推测三阴性乳腺癌沉默Notch4后EMT标志分子Vimentin表达降低,E-cadherin表达升高。然而困惑的是,三阴性乳腺癌细胞沉默Notch4后EMT标志分子Vimentin表达升高。而神奇的是,三阴性乳腺癌沉默Notch4后Vimentin从细胞核周边极性分布转变成在细胞核四周分布。考虑到Vimentin主要是影响细胞极性和运动,课题组认为三阴性乳腺癌沉默Notch4后通过影响Vimentin极性分布抑制三阴性乳腺癌转移。Notch4如何调控Vimentin分布和乳腺癌转移呢?Cdc42是调控细胞极性和癌症转移的关键因子。结果发现三阴性乳腺癌沉默Notch4后Cdc42表达降低。上调Cdc42表达发现Vimentin分布从细胞核四周分布转变成在细胞核周边极性分布。因此,课题组认为三阴性乳腺癌细胞沉默Notch4后,Cdc42表达下降导致Vimentin从细胞核周边极性分布转变成在细胞核四周分布是转移能力下降的原因。

图2 沉默Notch4通过Cdc42控制Vimentin的位置从而抑制TNBC细胞转移

图3 Notch4敲低影响TNBC细胞肿瘤发生和转移的模型
本研究说明沉默Notch4导致三阴性乳腺癌细胞转移能力下降,但成瘤能力增强。机制研究表明三阴性乳腺癌沉默Notch4后,下调靶蛋白Hes3表达,解除对胚胎干细胞调控因子Nanog抑制作用,导致Nanog表达增加是沉默Notch4导致三阴性乳腺癌成瘤能力增强的原因。三阴性乳腺癌细胞沉默Notch4后,Cdc42表达下降,导致Vimentin从细胞核周边极性分布转变成在细胞核四周分布是沉默Notch4导致三阴性乳腺癌转移能力下降的原因。该研究结果提示靶向Notch4可能不是三阴性乳腺癌药物研发的潜在靶标。本研究没有开展动物实验和分析Notch4表达和三阴性乳腺癌预后关系,这是该项目的不足之处。继续深入研究Notch4在三阴性乳腺癌成瘤和转移中的作用,阐明Notch4在三阴性乳腺癌的下游的调控蛋白,是下一步Notch4研究的重点。

