作为继锌指核酸酶(ZFNs)、转录激活因子样效应物核酸酶(TALENs)之后出现的第三代基因编辑工具,CRISPR/Cas9凭借其简洁高效的工作特点,一跃成为如今最炙手可热的生物研究工具。众多研究者基于临床应用性和转化性对其不断优化和改进,希望解决其脱靶,难递送和不可控性等弊端,发展出多种CRISPR应用形式[1,2]。其中,为了实现CRISPR的时空可控性,科学家们分别在效应蛋白如Cas9[3], sgRNA[4]和递送材料[5]上不断创新,开发出了一系列小分子依赖的可控性CRISPR系统。然而这些外源小分子的加入可能会引起机体内稳态的破坏。因此,除了关注组织特异性启动子外,探索生物体病理过程中释放的重要生物因子是否可以作为CRISPR系统开关的方法是非常值得期待的。炎症反应是多种疾病的重要病理过程[6],同时各种研究表明慢性炎症与癌症密切相关[7],NF-κB核转录因子是炎症信号通路下游中至关重要的一员,直接调节着大量炎症相关基因的转录与表达,在多种炎症相关疾病发生发展中均被显著激活[8]。因此,将炎症反应下游NF-κB活性引入到CRISPR系统中作为开关,用于CRISPR/Cas9系统对炎症通路上游重要蛋白进行基因编辑的时空控制,有望实现和建立治疗炎症相关疾病的可控性基因编辑系统。
该研究团队将炎症信号通路中的NF-κB转录活性与CRISPR/Cas9系统相结合,构建了基于炎症病理启动的、用于抑制炎症反应治疗炎症性疾病的基因编辑环路系统,并在细胞和动物水平验证了时空可控性的抗炎效果。
该研究团队将与NF-κB结合的DNA序列(称为NBS)作为启动子置于Cas9基因的上游,同时将TLR4-NFκB信号通路中重要的上游衔接蛋白,myeloid differentiation primary response 88(MyD88,TLR4激活后直接募集的、转导炎症信号的衔接蛋白)作为该系统的基因编辑靶点,从而构建了炎症(NF-κB)启动的CRISPR/Cas9功能质粒,称为NBS-CRISPR体系。
在概念验证阶段,以绿色荧光蛋白(GFP)和荧光素酶基因作为报告基因,将其转染至HEK293T细胞中并给与TNFα刺激以模拟炎症环境后,细胞荧光成像可以看到GFP阳性细胞大大增加,表明NBS-CRIPSR功能质粒可以被已发生的炎症(活化的NF-κB)成功激活并表达。刀豆蛋白诱发急性肝损伤的活体成像结果进一步表明该系统可稳定表达和工作,且主要定位于炎症发生的部位(图1)。
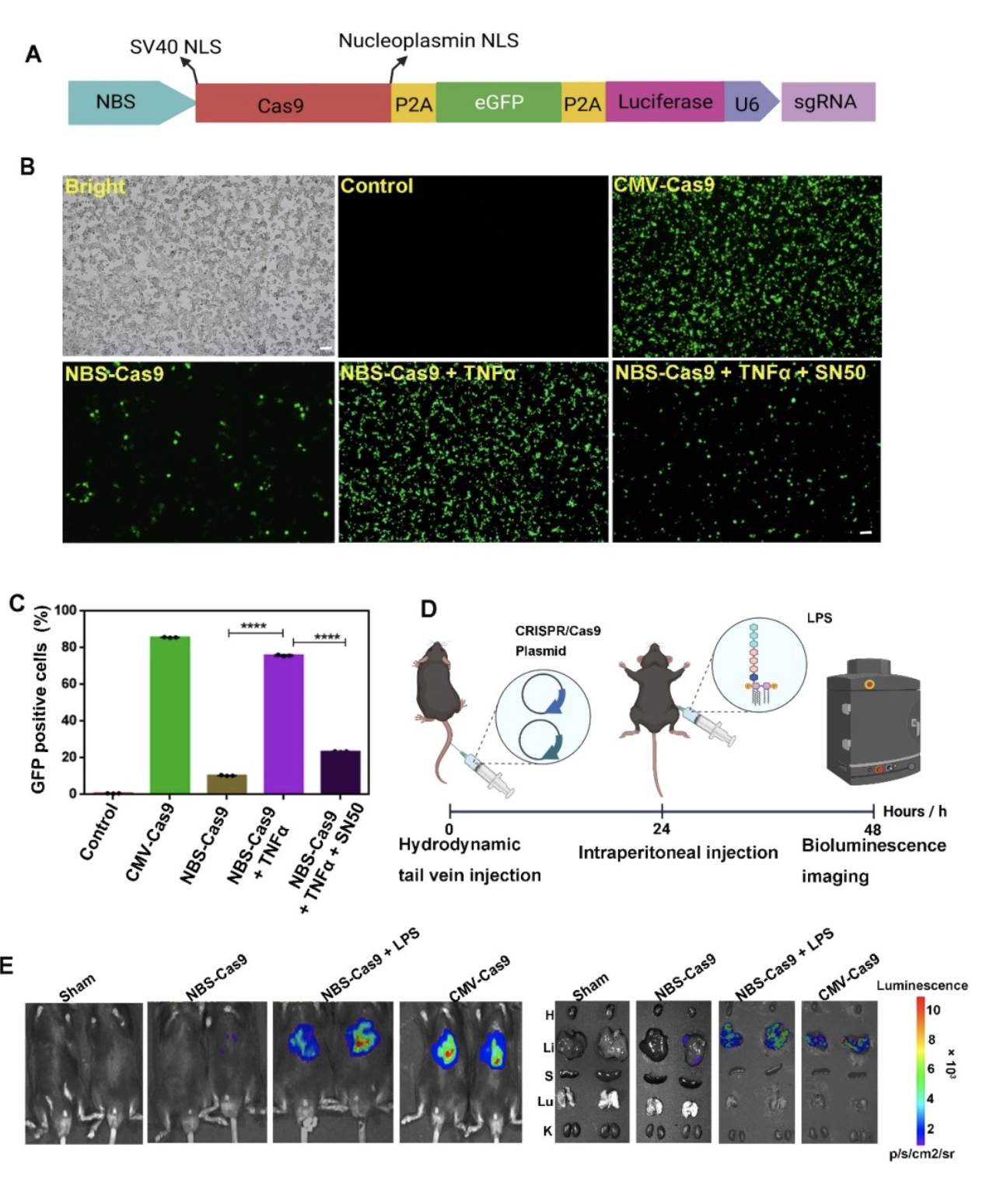
图1 体外和体内概念验证
在巨噬细胞验证阶段,深度测序结果表明,NBS-CRISPR系统对于MyD88基因的编辑效率与经典启动子CMV介导的相当(NBS-CRISPR:29.19%; CMV-CRISPR:31.18%)。伴随着启动后NBS-CRISPR系统对MyD88基因的敲除,细胞的炎症反应减弱(图2)。同样该结果在小鼠的原代肝细胞中得到验证。
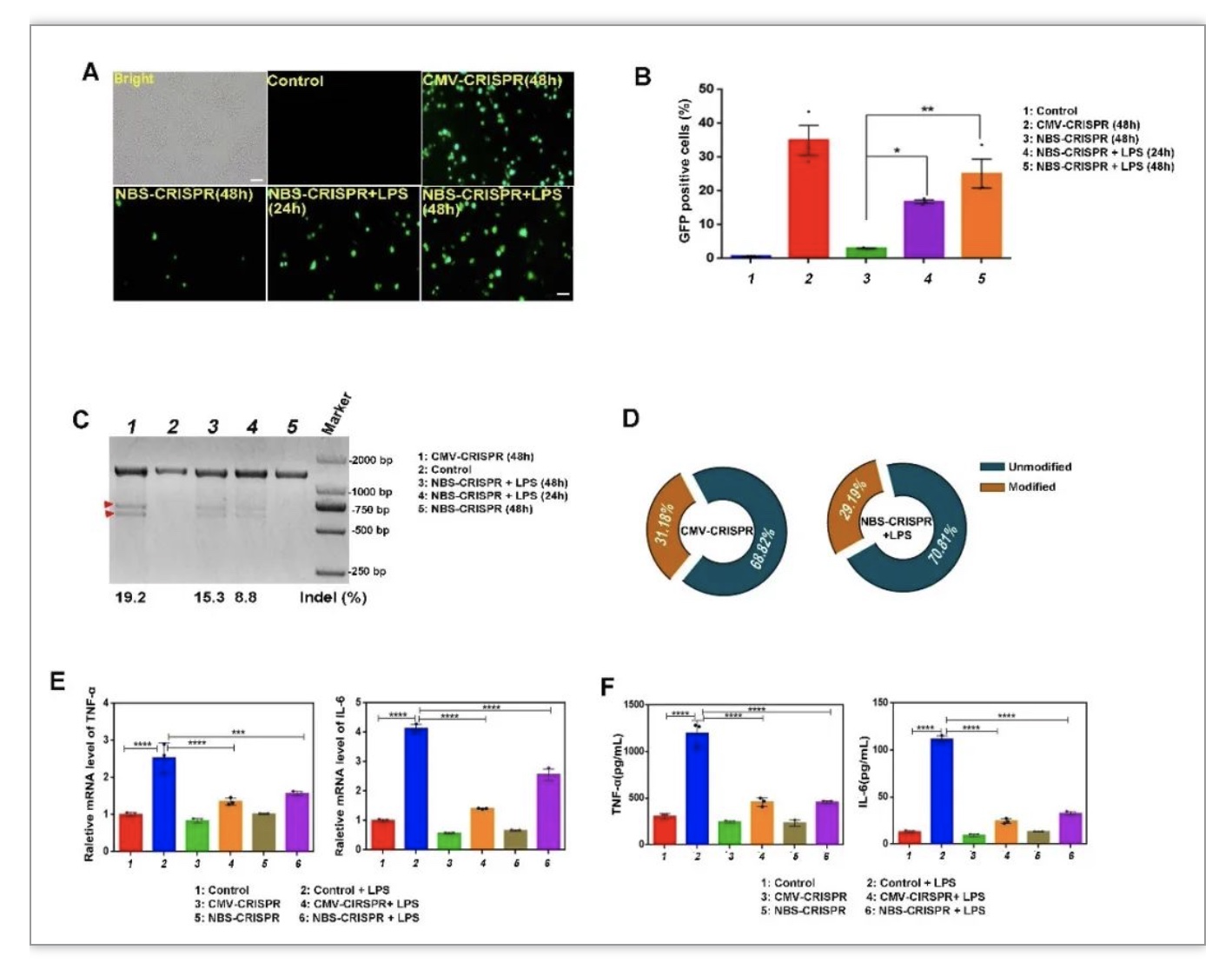
图2 巨噬细胞中NBS-CRISPR系统对炎症的响应和干预
紧接着作者又将该体系与AAV递送系统结合构建了AAV9-NBS-CRISPR体系,并在刀豆蛋白诱导的肝损伤动物模型中进一步证实了这一概念。活体荧光成像表明,AAV9载体所携带的NBS-CRISPR主要在炎症攻击的肝脏中富集表达(图3)。
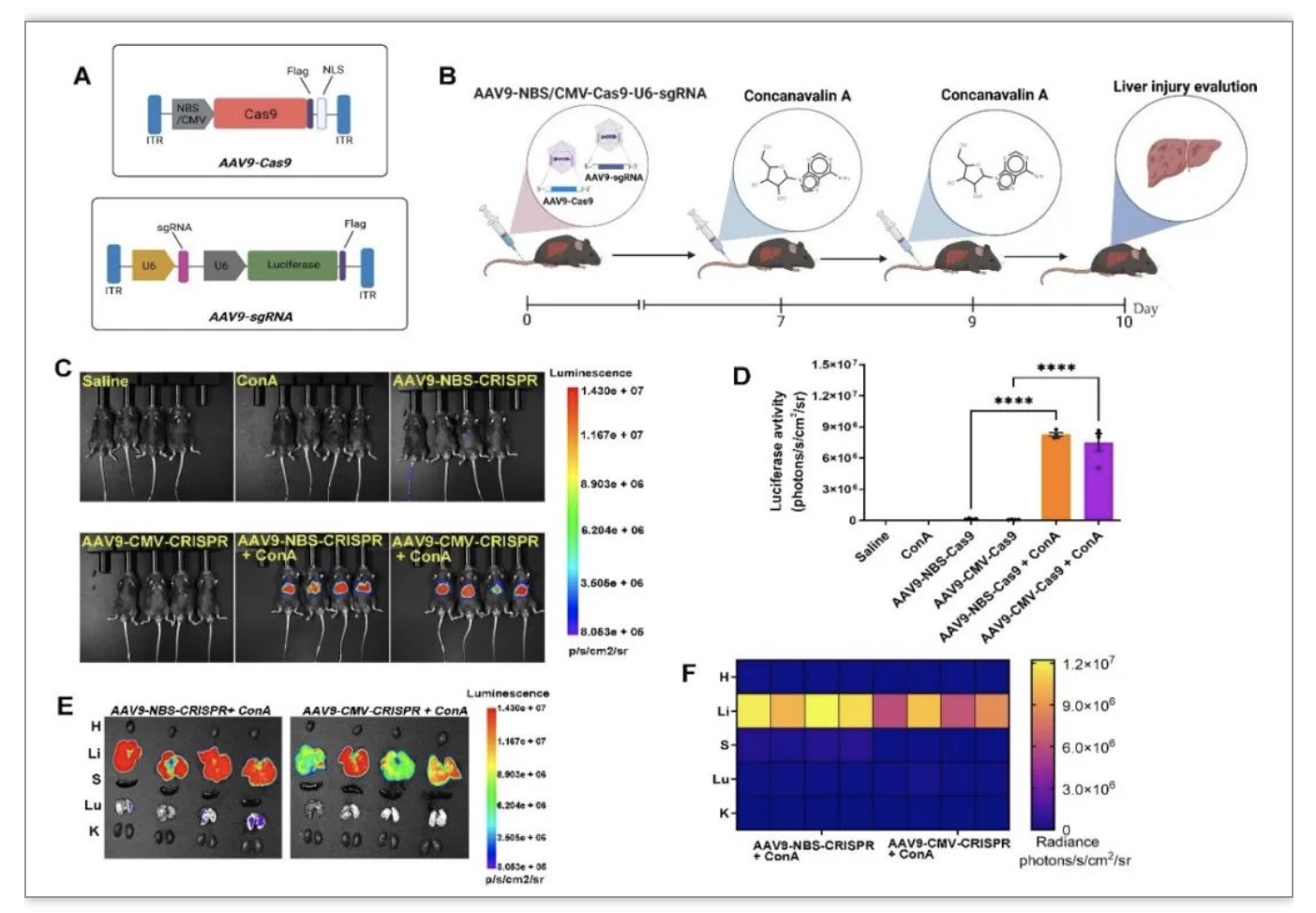
图3 AAV9-NBS-CRISPR系统对急性肝损伤的响应
最后,为了降低Cas9的目标基因切割泄露,作者进一步优化并构建了表达Cas9-P65融合蛋白的体系,称为NBS-P65-CRISPR系统。细胞共聚焦荧光成像结果表明,在非炎症状态,少量泄露表达的Cas9蛋白被禁锢在目标细胞的胞质中;而在炎症状态下,NF-κB被激活后入核,与NBS结合,启动Cas9的大量表达,并在P65的牵引下入核显著提升,入核后发挥对MyD88的基因切割功能。T7EI实验结果也表明,泄露基因编辑从2.1%下降到0.4%(图4)。
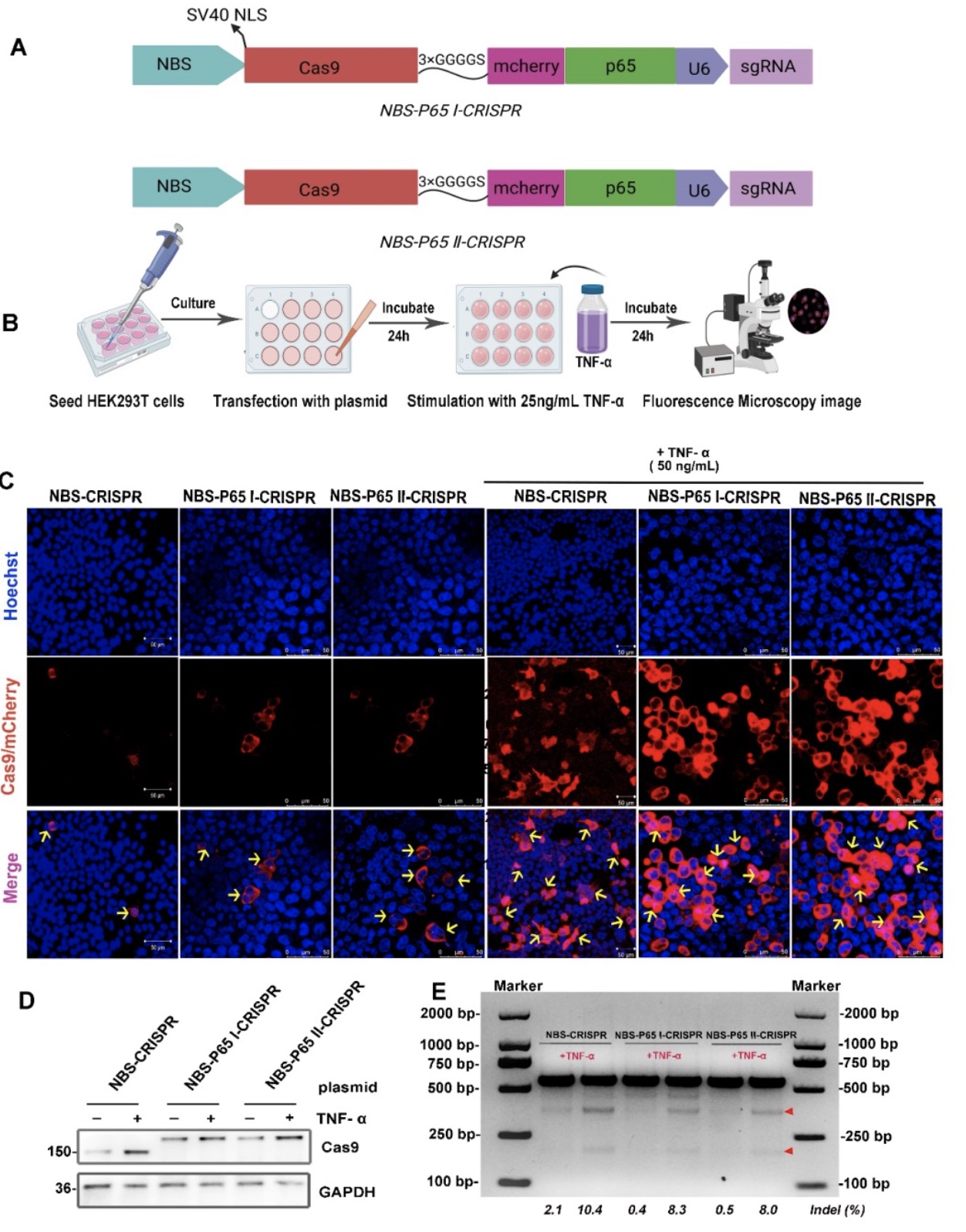
图4 NBS-CRISPR系统的优化
NBS-CRISPR和NBS-P65-CRISPR系统的建立有望提供基于炎症病理状态的治疗性和时空可控性的基因编辑平台。该系统可以通过内源性病理过程触发Cas9的表达而将基因编辑限制在病变部位,从而减少对周围组织的损伤,进一步降低脱靶风险。与此同时,也为基于CRISPR的AAV治疗提供了新的见解。当然,尽管NBS-CRISPR系统对急性炎症反应敏感且具有优越的目标基因操纵能力,但该系统的优势还需要进一步确证,如在其他CRISPR同源物(例如CRISPR-dcas9系统,ABE/CBE /PE碱基编辑器系统中进行可行性验证[9],以及该系统对慢性炎性疾病(如动脉粥样硬化)的治疗效果评价。

