最近二十多年来,反义核苷酸技术和各类RNA药物的临床使用,以至COVID-19三年大流行过程中mRNA疫苗的诞生催生了大量对于mRNA代谢和调控的研究热忱和基于RNA的生物技术和治疗药物的推广应用。其中,植根于数十年对于mRNA翻译调控机制的深刻认知,而富于创造性的对COVID-19刺突蛋白质的mRNA进行革命性的工程化改造,摩德纳和辉瑞公司研发出先进的mRNA疫苗和药物,正在悄然而迅速的改变生物医学研究和临床疾病治疗的范式。越来越多的研究证据表明,基因表达的转录后调控(post-transcriptional regulation),包括RNA剪切、运输、修饰、翻译和降解,主要依赖于RNA结合蛋白(RNA-binding proteins,RBP)。RNA结合蛋白是影响几乎所有类别RNA命运决定的重要调节因子。通过一个或多个RNA结合域,RBPs以时间、空间和功能动态的方式与RNA选择性或全局性的相互作用。一旦招募到RNA上,RBPs会参与基因表达的转录后调控,包括信使RNA翻译水平的调节。RBPs丰度或功能性的改变与各种人类疾病息息相关,包括先天性发育缺陷,免疫系统的炎症反应,多器官的纤维化过程,心脑血管疾病,神经退行性疾病,病毒感染和多种癌症等[1,2]。因此,探索RBPs在基因表达的转录后调控中的作用,对我们理解基础生物学和人类疾病有重要贡献。
信使RNA(messenger RNA,mRNA)翻译是RBPs广泛影响的转录后过程之一[3]。作为细胞中能量消耗最大、最精确调控的过程,mRNA翻译是通过顺式作用的RNA元件(如末端寡聚嘧啶(TOP)基序和富集CA的元件)以及反式作用因子(如mRNA结合蛋白(mRBPs))紧密控制的[4-6]。后者影响全局或特定转录本的所有翻译步骤[3]。近些年来的研究通过基于质谱的“mRNA interactome capture”方法,已经鉴定出了大量人类的mRNA结合蛋白及其 (m)RNA结合结构域。这些方法主要使用脱氧胸腺嘧啶寡核苷酸(oligo(dT))探针,在紫外线(UV)交联后捕获带有多聚腺苷酸(poly(A))的mRNAs以及它们的相互作用的mRBPs[7-9]。然而,大多数新鉴定的mRBPs的功能仍未被研究。
关于mRNA翻译的两个重要的基本问题是mRNA的选择性和翻译效率的调控机制:在胚胎发育,应激反应,抑或人类疾病中,为何特定的mRNAs而非全转录组会被有效的翻译成为蛋白质或被选择性的沉默而无法进行翻译?这种mRNA选择性的丧失或翻译效率的失调会对机体产生何种生理或病理的影响?原麻省理工学院的David Sabatini教授早在2012年通过高通量核糖体足迹测序发现哺乳动物雷帕霉素靶蛋白(mTORC1)通路通过影响eIF4E-eIF4G1 5‘端帽子依赖性的翻译起始复合物的组装和活性进而调节大约99.8%的mRNA的翻译[10]。日本的Shinya Yamanaka教授实验室经过近20年研究,阐明了一种独立于经典的直接受mTORC1通路调控的eIF4E-eIF4G1 复合物的非经典的翻译起始因子eIF4G2的生物学功能。eIF4G2对于小鼠和果蝇胚胎发育极端重要,却在小鼠胚胎干细胞中仅通过影响18个mRNAs的翻译效率,而起到对干细胞增殖和分化不可或缺的关键作用[11]。在过去的8年中,加州大学伯克利分校的Jennifer Doudna和Jamie Cate教授联合发现一个eIF3复合物组分蛋白中特定的翻译起始因子eIF3D,可以直接结合大约人体细胞内0.2%的mRNA 5‘端的帽子结构,进而调节这些mRNA的翻译起始过程[12]。而于此几乎同时,纽约大学的Robert Schneider教授实验室报道了eIF4G2和eIF3D帽子结合蛋白形成非经典的翻译起始复合物,参与人体癌细胞中一小部分的mRNA的翻译起始而促进乳腺癌的癌症发生和发展[13]。目前,学术界的共识是eIF4E-eIF4G1缺乏任何RNA结合的特异性,因而参与几乎所有人体mRNA的翻译。作为eIF4G1的截短形式的变体,eIF4G2也缺乏RNA选择性的结构基础。然而,细胞内如何对如此少量但十分特定的mRNA族群进行选择性翻译,仍然是一个尚未解决的问题。
首次揭示了一个新的mRNA结合蛋白PRRC2B(Proline rich coiled-coil 2B)在mRNA翻译调控上的功能和机制。通过对已发表文献和高通量数据库的分析检索,研究者发现PRRC2B是一个可能参与调控mRNA翻译的RNA结合蛋白。PRRC2B在快速增殖的肿瘤细胞如威尔姆斯瘤中高表达,而且其高表达与患者总体生存率密切相关[15,16]。此外,PRRC2B与MGMT、DEK和ALK的融合基因已在多种不同的人体肿瘤中报道[17-21]。之前的研究基于其与eIF4G2和eIF3在人乳腺癌细胞和小鼠胚胎干细胞中的免疫共沉淀,表明PRRC2B是eIF4G2介导的特异性翻译起始复合物的组成部分[11,13,22]。基于此研究者深入探究PRRC2B在特异性mRNA翻译调控中的功能和机制以及其与细胞增殖之间的关系。

在本研究中,研究者对PRRC2B在人类胚胎肾细胞(HEK293T)中基因表达的翻译调控进行了全面的探索。通过光活化核苷增强交联免疫沉淀和下一代深度测序(PAR-CLIP-seq)技术,研究者证明了全长PRRC2B蛋白质和其中750个氨基酸长的中间片段结合在一部分mRNA的编码区主开放阅读框架起始密码子附近的富含GA-或CU-序列的RNA元件(图一)。大部分的结合靶点位于起始密码子上游约70个核苷酸左右的区域,但也有一小部分结合位点在主编码区和3‘非翻译区中。这些看似可能形成碱基配对的GA-和CU-元件分布在不同的mRNA上或在同一个mRNA上相距甚远的区域内,因而不太可能构成双链RNA结构。相对较少的长非编码RNA也在PRRC2B结合的候选靶标数据库中。研究者猜测某些长非编码RNA可能事实上是错误定义的mRNA,可以翻译成为小的蛋白质或肽段从而参与特殊的功能,值得后续研究。为了确定PRRC2B的功能性靶标,研究者首先利用Doxycycline 诱导表达的PRRC2B shRNA特异性敲低PRRC2B的基因表达,然后对多聚核糖体结合的mRNA进行polysome profiling分离和下一代深度测序(polysome-seq),以鉴定受到PRRC2B翻译调节的功能性靶标mRNAs。针对PAR-CLIP-seq和polysome-seq数据的整合性生物信息学分析,研究者最终发现既被PRRC2B直接结合又受其调控的mRNAs。这些靶标mRNAs,通过基因功能分类,包括癌基因和细胞周期调节因子如CCND2(cyclin D2),CRKL和YWHAZ。这些靶基因在PRRC2B敲低后,其蛋白质表达迅速降低,导致细胞周期的G1/S期转换下降,从而使细胞增殖减少(图一)。当然,通过蛋白质免疫印迹实验,研究者证实了这些半衰期较短的蛋白质表达水平在PRRC2B敲低后短期内便显著下调。但在更长的时间里,更多的非靶标mRNA对应的蛋白质水平可能因二级反应或代偿效应会发生不同方向的变化。而且,除了癌基因和细胞周期调节因子,研究者还注意到作为已知的含有末端寡聚嘧啶元件的mTORC1下游调控靶标的若干个热激活蛋白质和翻译起始因子的mRNAs(如HSP90AB1, HSPA8,和EEF2等)也是PRRC2B的直接结合靶标。这些结果暗示PRRC2B-eIF4G2途径和eIF4E-eIF4G1途径之间可能存在交互作用或互补效应。研究者还发现通过反义寡核苷酸(antisense oligonucleotides,ASOs)阻断PRRC2B与其靶标mRNA,CCND2 mRNA相互作用可特异性的在PRRC2B高表达的细胞中减少CCND2蛋白的翻译表达,从而抑制G1/S转换和细胞增殖。这一发现启发我们,可以使用ASO特异性的在高表达PRRC2B的肿瘤细胞中有效抑制癌基因和细胞周期蛋白的表达。由于PRRC2B在大B细胞淋巴瘤(DLBC)、胸腺癌(THYM)和威尔姆斯瘤(Wilms' tumor)等癌细胞中高表达[15,16]。这些ASOs可以用于潜在的抗癌治疗,值得在基础生物学或与人类疾病相关的动物模型中进一步深入研究。
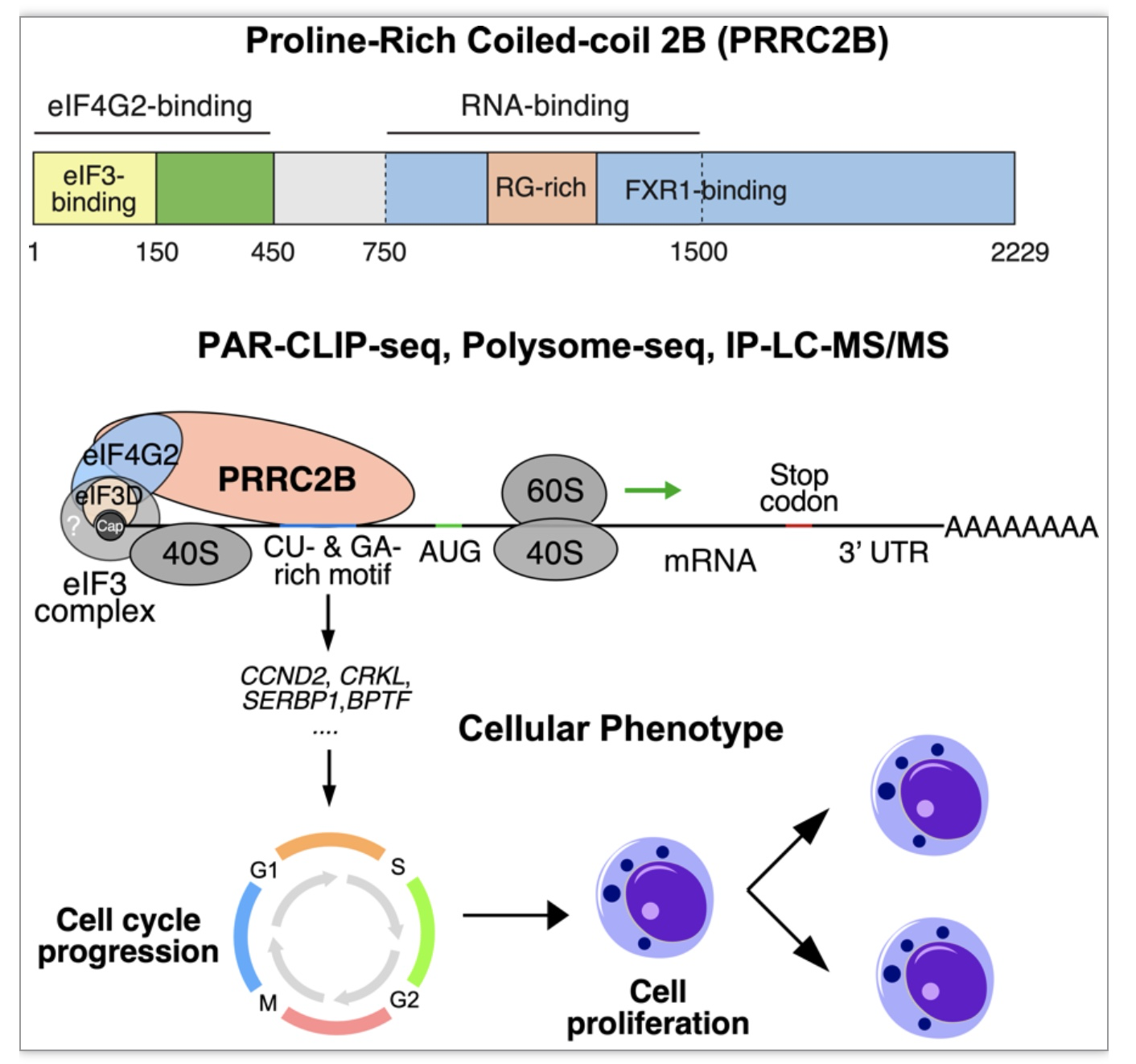
图一:PRRC2B调节特定mRNA翻译起始和影响细胞增殖的功能和机制。
为进一步解析PRRC2B调节mRNA翻译的分子机制,研究者使用PRRC2B的特异性抗体进行免疫共沉淀和质谱分析,发现了一系列和PRRC2B相互作用的蛋白质。其中富集度最高的蛋白质包括若干个翻译起始因子eIF3组成蛋白(如eIF3B,eIF3D,eIF3G等)和eIF4G2以及RNA结合蛋白FXR1(图一)。这些相互作用不受核酸酶剪切作用的影响,因而是蛋白质之间的直接相互作用而非RNA间接介导形成。值得注意的是,日本的Shinya Yamanaka以及纽约大学的Robert S chneider教授在2017-2018年间,发现的eIF4G2的相互作用蛋白组和我们获得的PRRC2B的相互作用蛋白组高度吻合,进一步证明在小鼠胚胎干细胞,人类乳腺癌细胞,和人源HEK293T细胞中的PRRC2B-eIF4G2复合物的组成成员是十分保守的。在更为深入的分子生物学解析过程中,研究者利用对PRRC2B结构域的截短突变和生化分析,揭示PRRC2B通过与翻译起始因子eIF3和eIF4G2的相互作用促进这些特定mRNA的有效翻译,并进而影响细胞的增殖效率。PRRC2B中间的RNA结合结构域含有甘氨酸-精氨酸(GlyArg)重复序列,是典型的RNA结合结构区,可能直接参与蛋白质和核酸之间的相互作用。免疫荧光测定显示PRRC2B蛋白质主要定位于人细胞的胞质中,在细胞核和其他细胞器中未发现明显的定位,这与其参与翻译调控的功能是一致的。在多核糖体分离试验中,PRRC2B蛋白质主要位于40S,60S核糖体亚基,80S单核糖体(monosome),以及双核糖体(disome)组分之中,但在多核糖体组分(polysome)几乎没有检测到其存在。这个现象暗示PRRC2B除了在翻译起始过程起到重要作用,可能在翻译起始转换到翻译延伸的过程中也有贡献。
有趣的是,PRRC2B在先天性心脏病的病人中存在潜在激活无义性终止密码子依赖的mRNA降解途径(nonsense-mediated mRNA decay)的两种杂合型突变,暗示PRRC2B的低水平表达可能会作为一种修饰性的突变但非决定性的遗传因素,影响心脏的早期发育和正常机能。国际小鼠表型分析共享联盟机构的公共数据库显示纯合型的Prrc2b基因敲除小鼠(tm1a)在胚胎发育期间出现多器官的发育缺陷,包括心血管,大脑,肌肉等区域。这些结果说明,尽管PRRC2家族存在三个潜在冗余的成员(PRRC2A,PRRC2B,PRRC2C),PRRC2B对于器官的发育仍起到重要的作用。相似的是,PRRC2家族的另一个成员PRRC2A在中央神经系统中参与大脑功能相关的细胞类型的分化和大脑的发育[23]。之前对于PRRC2A的研究工作,发现这个家族成员蛋白质的功能主要是作为m6A的阅读因子影响mRNA的转录后修饰和RNA的稳定性[23]。然而,我们在稳定敲低PRRC2B后通过RNA深度测序并未观测到靶标mRNA水平的显著变化。结合前述的研究结果,PRRC2B可能不参与m6A和mRNA半衰期的调节。最近的研究表明,PRRC2家族的第三个成员PRRC2C可能参与压力颗粒(stress granule)在氧化性逆境下的形成[24]或调节存在5‘上游开放阅读框(uORF)的mRNA的翻译再起始以及uORF和mORF(main ORF;主要的开放阅读框)的翻译平衡[25]。但是,我们在使用三氧化二砷处理HEK293T细胞过程中未发现PRRC2B参与压力颗粒的形成。同时,我们注意到许多PRRC2B直接结合的mRNAs并不含有AUG起始密码子或可供翻译的uORF,表明PRRC2B也可以通过直接结合在特定的顺式RNA元件上调节mORF的翻译效率,而无须依赖对uORF的识别和选择。尽管在进化上,PRRC2家族的三个成员蛋白质在脊椎动物甚至部分非脊椎动物中保守,但是它们可能存在冗余或独特的生物学功能与分子作用机制。这些重要的问题有待将来系统性的研究。英国的Venki Ramakrishnan教授和美国加州大学戴维斯分校的Christopher Fraser教授实验室联合解析了人源48S翻译起始复合物的冷冻电镜结构,第一次提供了对于翻译起始过程的蛋白质-mRNA复合体的高分辨率的分子水平的信息。这一结构主要解决了eIF4G1和eIF3复合物的诸多蛋白质相互作用网络,复合物在翻译起始过程中包括5‘非翻译区的结合与扫描机制,以及复合物结构和功能关联性的一系列问题。然而,对于高等脊椎动物或哺乳动物机体发育和疾病应激极为重要的eIF4G2和PRRC2B等其他生物学或生理病理水平上必须的选择性或特异性的翻译起始因子及调控蛋白的结构功能分析还处于初级阶段,将来需要更多的研究工作加以解析和揭示。

