PD-1(programmed death 1)和PD-L1(programmed death ligand 1)阻断性抗体已被应用于多种肿瘤治疗,但是在不同的肿瘤以及患者中响应率差异很大(13%-69%)[1,2]。临床和临床前研究显示肠道菌群影响肿瘤免疫疗法,尤其免疫检查点抑制剂疗法。先前研究发现嗜黏蛋白阿克曼菌(Akkermansia muciniphila)、双歧杆菌(Bifidobacterium)等可增强免疫检查点抑制剂疗法[3,4]。将响应免疫检查点抑制剂治疗的黑色素瘤患者的粪菌移植到无响应患者体内,也能促使部分患者对免疫检查点抑制剂响应[5,6]。但是目前关于肠道菌群促进抗肿瘤免疫的机制并不清楚。该研究发现肠道微生物下调 PD-L2- RGMb轴促进抗PD-1或抗PD-L1免疫检查点疗法,为抗PD-1/PD-L1治疗不应答的癌症患者提供了新的干预思路。

通过皮下荷瘤MC38结肠癌细胞,再给予小鼠抗PD-L1或抗PD-1治疗,作者发现常规无特定病原体(SPF)小鼠治疗后肿瘤明显减小,表现出良好的治疗疗效,而无菌(GF)小鼠对抗PD-L1或抗PD-1治疗没有反应。用健康的人类微生物群(healthy human microbiota, HMB)或健康的小鼠微生物群(mouse microbiota, MMB)移植到GF小鼠,明显促进GF小鼠anti-PD-1或anti-PD-L1的治疗肿瘤效果。与无菌小鼠一致,用抗生素(ABX)清除小鼠菌群,能够显著抑制anti-PD-1或anti-PD-L1的治疗。用抗生素清除菌群,在荷瘤七天后口服给予HMB(termed ABX/HMB treatment)能够显著促进anti-PD-1或anti-PD-L1的治疗。在荷瘤第24天比较抗生素处理的小鼠以及ABX/HMB小鼠在给予anti-PD-L1治疗后肿瘤中的免疫细胞浸润情况,发现ABX/HMB小鼠肿瘤中CD8+T/Treg比例明显增加,CXCR5+TIM-3-CD8+T祖细胞增多,终末耗竭性PD-1+TIM-3+CD8+T细胞减少,CD8+T细胞效应功能增加。这些结果说明肠道菌群能够促进CD8+T和CD4+T细胞对肿瘤响应的能力,增强抗PD-L1或抗PD-1肿瘤免疫疗法。
由于肠道微生物群影响抗PD-L1或抗PD-1治疗功效,作者推测肠道微生物可能调节检查点分子的表达,从而影响抗肿瘤免疫治疗。作者进一步比较了ABX以及ABX/HMB小鼠在抗体治疗后肿瘤、肿瘤引流淋巴结(tumour draining lymph nodes, dLNs)、肠系膜淋巴结(mesenteric lymph nodes,MLNs)中CD8+T细胞功能状态以及免疫细胞浸润情况,结果显示与抗生素处理组相比,ABX/HMB anti-PD-L1抗体治疗组肿瘤中PD-1+、PD-1+TIM3+、CD44+PD-1+以及IFNγ+的CD8+T细胞在荷瘤第13天没有显著差异。在dLNs中ABX/HMB anti-PD-L1抗体治疗组较抗生素处理组或对照抗体治疗组CD45+细胞、CD8+T细胞、CD4+T细胞以及MHCII+CD11b+细胞显著增加,并且在抗体治疗响应鼠中(ABX/HMB plus anti-PD-L1)这些细胞的PD-L2表达下调,而PD-L1表达上调。说明肠道微生物通过影响共抑制分子的表达调控免疫检查点抗体治疗信号通路。那么在非响应鼠中是否由于高表达PD-L2从而抑制了抗肿瘤免疫?与抗生素处理组相比,在荷瘤第10天及第13天ABX/HMB鼠dLNs和MLNs中CD11c+和CD11b+细胞PD-L2的表达较低,并且在SPF鼠中也得到了相同结果。在荷瘤24天ABX/HMB鼠dLNs和MLNs中CD11c+细胞仍然低表达PD-L2,说明HMB的移植引起肠道和肿瘤引流淋巴结中CD11c+DCs细胞下调了PD-L2的表达。在抗体治疗非响应鼠dLNs中高表达PD-L2的抗原递呈细胞显著抑制了抗肿瘤免疫,而在无菌小鼠或抗生素处理的小鼠中使用anti-PD-1(能够同时阻断PD-L1和PD-L2与PD-1结合)治疗没有效果,说明PD-L2是通过与其它受体结合发挥作用。

图1. 微生物促进anti-PD-L1对肿瘤治疗的有效性,抑制PD-L2的表达
作者进一步使用多种肿瘤模型探究了PD-L2对抗肿瘤免疫治疗的影响。用GF小鼠或抗生物喂养的小鼠,作者发现联合anti-PD-L2和anti-PD-1或anti-PD-L1治疗均能显著减少结肠癌MC38、膀胱癌MB49的生长,而单独使用任何一种抗体均不能抑制肿瘤生长。在SPF小鼠中联合anti-PD-L2和anti-PD-L1治疗黑色素瘤B16或乳腺癌Py8119均显著高于单独一种抗体治疗效果,这说明联合治疗在有肠道菌群的情况下也能提高治疗效果。在SPF小鼠中单独使用anti-PD-1或anti-PD-L1治疗MC38、乳腺癌E0771以及Lewis肺癌LLC,均具有良好治疗效果,联合anti-PD-L2和anti-PD-L1治疗没有显著提高治疗效果。在SPF 小鼠中,联合抗PD-L2治疗并没有增强抗PD-L1或PD-1在乳腺癌E0771中的疗效,也没有增强PD-L1在Lewis肺癌LLC中的疗效。以上结果说明联合阻断PD-L2与PD-L1或PD-1能够提高多种肿瘤而非所有的治疗效果。
接下来作者探究了肠道中的哪种微生物能够诱导dLNs中DC细胞下调PD-L2进而影响anti-PD-L1介导的抗肿瘤免疫。作者分别用万古霉素(Vancomycin)清除革兰氏阳性菌,用甲硝哒唑(Metronidazole)清除厌氧菌都能够充分阻断anti-PD-L1抗肿瘤免疫反应。氨苄青霉素(Ampicillin)能够部分清除革兰氏阳性菌和革兰氏阴性菌,使用氨苄青霉素后能够部分损伤anti-PD-L1抗体治疗效果但是肿瘤体积没有显著改变。用新霉素(Neomycin)靶向清除好氧菌和兼性厌氧革兰氏阴性菌没有明显改变anti-PD-L1抗肿瘤疗效。这些实验说明革兰氏阳性厌氧菌对anti-PD-L1抗肿瘤免疫反应必不可少。结合菌群16S rRNA测序和抗生素筛选实验作者最终发现C.cateniformis菌,该菌只在HMB粪菌中存在。移植C.cateniformis不仅能够减少dLNs中CD11b+细胞和CD11c+细胞PD-L2的表达,也能减少MLNs中CD11c+细胞表达PD-L2。用C.cateniformis表面可溶性分子提取物刺激BMDC同样能够诱导BMDC下调PD-L2的表达。这说明C.cateniformis在体内外均能下调DC细胞表达PD-L2。随后作者在抗生素喂养的小鼠体内移植C.cateniformis,与移植HMB类似,单独移植C.cateniformis就能增加免疫应答,用anti-PD-L1抗体治疗后肿瘤中浸润的效应GranzymeB+IFNγ+CD8+T细胞明显增加,但是CD8+T细胞TNF的表达与HMB相比没有显著增加。说明单独移植C.cateniformis几乎能够完全替代移植HMB,但是HMB中其它的细菌会发挥额外的免疫效应。
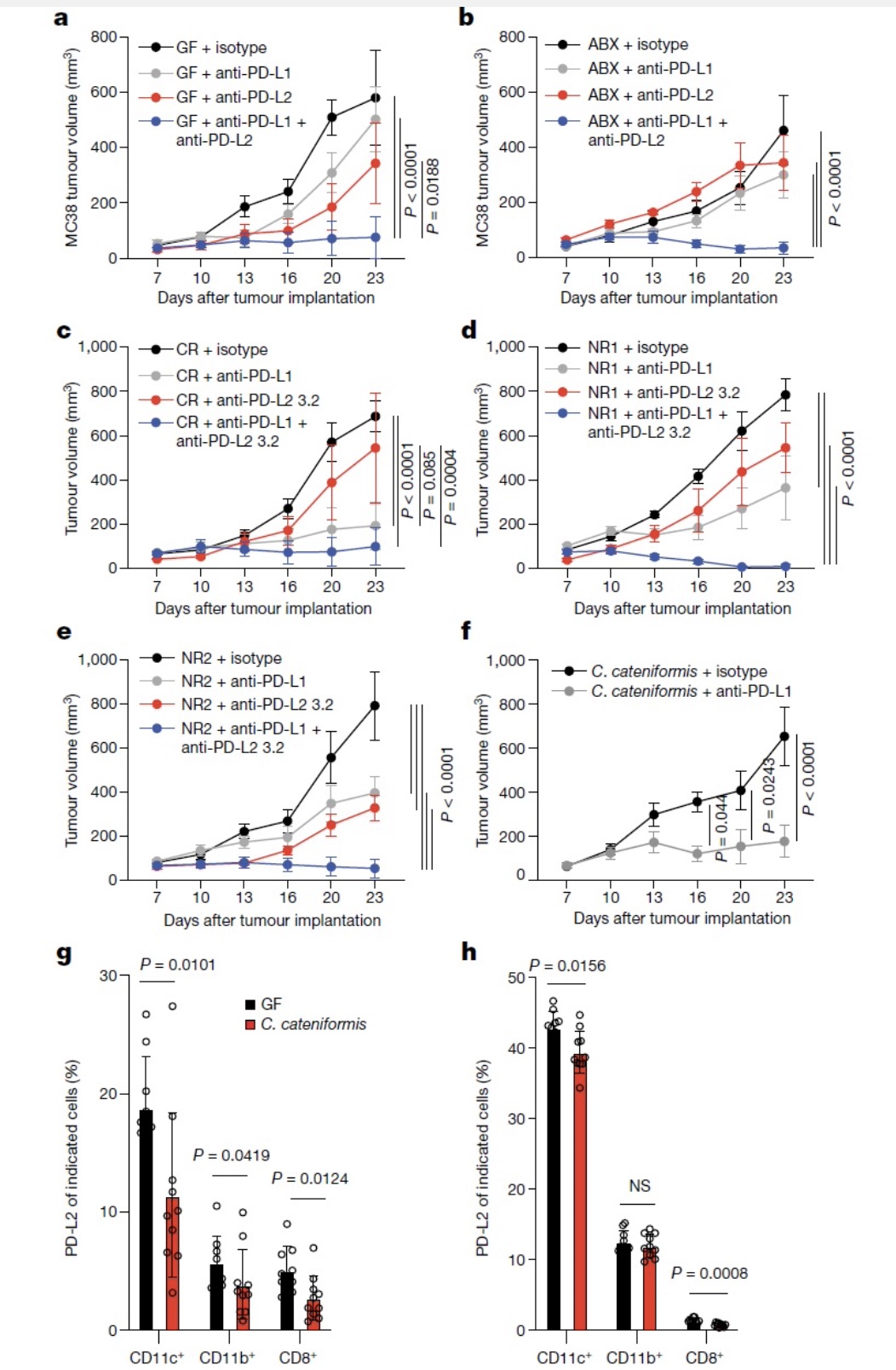
图2. Anti-PD-L2或C.cateniformis联合anti-PD-L1治疗能够克服PD-L1治疗抵抗
为直接证明C.cateniformis通过下调DC细胞表达PD-L2增加抗肿瘤免疫,作者用C.cateniformis细菌表面可溶性分子体外预处理的BMDC-GFP或BMDC-PD-L2-GFP(稳定表达PD-L2的BMDC)细胞与OT-I CD8+T细胞共培养,BMDC-GFP细胞能够促进CD8+T细胞表达IFNγ、TNF、CD107a、GranzymeB、CD44以及CD25,显著提高了T细胞的效应功能,而表达PD-L2-GFP的BMDC没有这种效应。在anti-PD-L1治疗期间同时口服C.cateniformis能够显著促进抗肿瘤免疫反应,在GF小鼠中联合C.cateniformis和anti-PD-L1治疗能够达到anti-PD-L1和anti-PD-L2联合治疗同等效果。在GF小鼠中回输BMDC-PD-L2-GFP细胞能够显著促进肿瘤生长,在移植了C.cateniformis的GF鼠或PSF鼠中过继回输BMDC-PD-L2-GFP细胞同样能够促进肿瘤的生长,而过继回输BMDC-GFP的小鼠获得了很强的抗肿瘤能力。说明C.cateniformis通过下调DC细胞表达PD-L2增强了抗肿瘤免疫反应。作者进一步将野生型BMDC或Pdl2 KO BMDC注射到肿瘤部位,结果显示预先用C.cateniformis处理的野生型DC细胞能够显著促进抗肿瘤免疫应答,而Pdl2 KO 的BMDC同样能引起很强的抗肿瘤应答,C.cateniformis处理Pdl2 KO BMDC不能进一步增强其抗肿瘤免疫应答。这些结果说明抑制DC细胞表达PD-L2促进抗肿瘤免疫,并且C.cateniformis促进抗肿瘤免疫是通过下调DC细胞表达PD-L2实现。
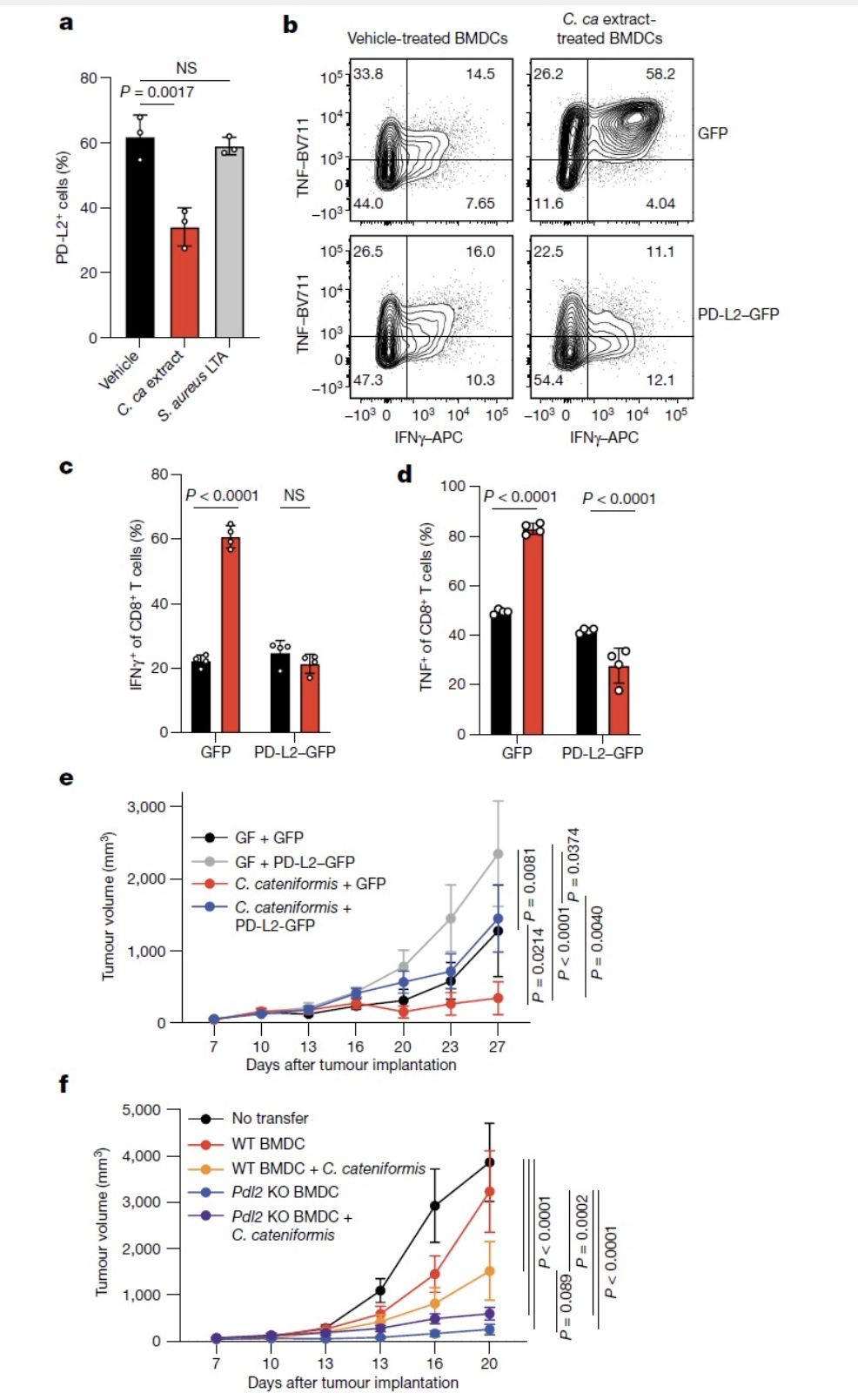
图3. C.cateniformis通过下调PD-L2促进抗肿瘤免疫疗法
由于联合阻断PD-1和PD-L2较单独阻断PD-1有更好的抗肿瘤效果,推测PD-L2发挥的效应应该由其它受体介导而不依赖于PD-1。PD-L2除能与PD-1结合外也能与RGMb结合。作者发现通过阻断PD-L2-RGMb能够显著促进anti-PD-L1或anti-PD-1免疫治疗,anti-RGMb诱导的抗肿瘤免疫依赖于阻断RGMb与PD-L2的结合而与抗体诱导的RGMb+细胞的清除无关。RGMb在神经系统、上皮细胞以及免疫系统(免疫细胞中巨噬细胞表达最多)中均有表达。作者发现GF小鼠中肿瘤浸润的T细胞较SPF小鼠高表达6.1倍的RGMb,在其它免疫细胞中RGMb的表达无明显差异,提示表达RGMb的T细胞在CD8+T细胞介导的抗肿瘤免疫反应中发挥重要作用。此外移植anti-PD-1非响应患者粪菌的小鼠肿瘤中的CD8+T细胞同样高表达RGMb,而SPF小鼠肿瘤中的CD8+T细胞与GF小鼠相比表达更低水平的RGMb。这些结果说明免疫细胞表达RGMb或PD-L2能够影响肿瘤免疫治疗,阻断PD-L2-RGMb能够克服anti-PD-1或anti-PD-L1治疗抵抗。
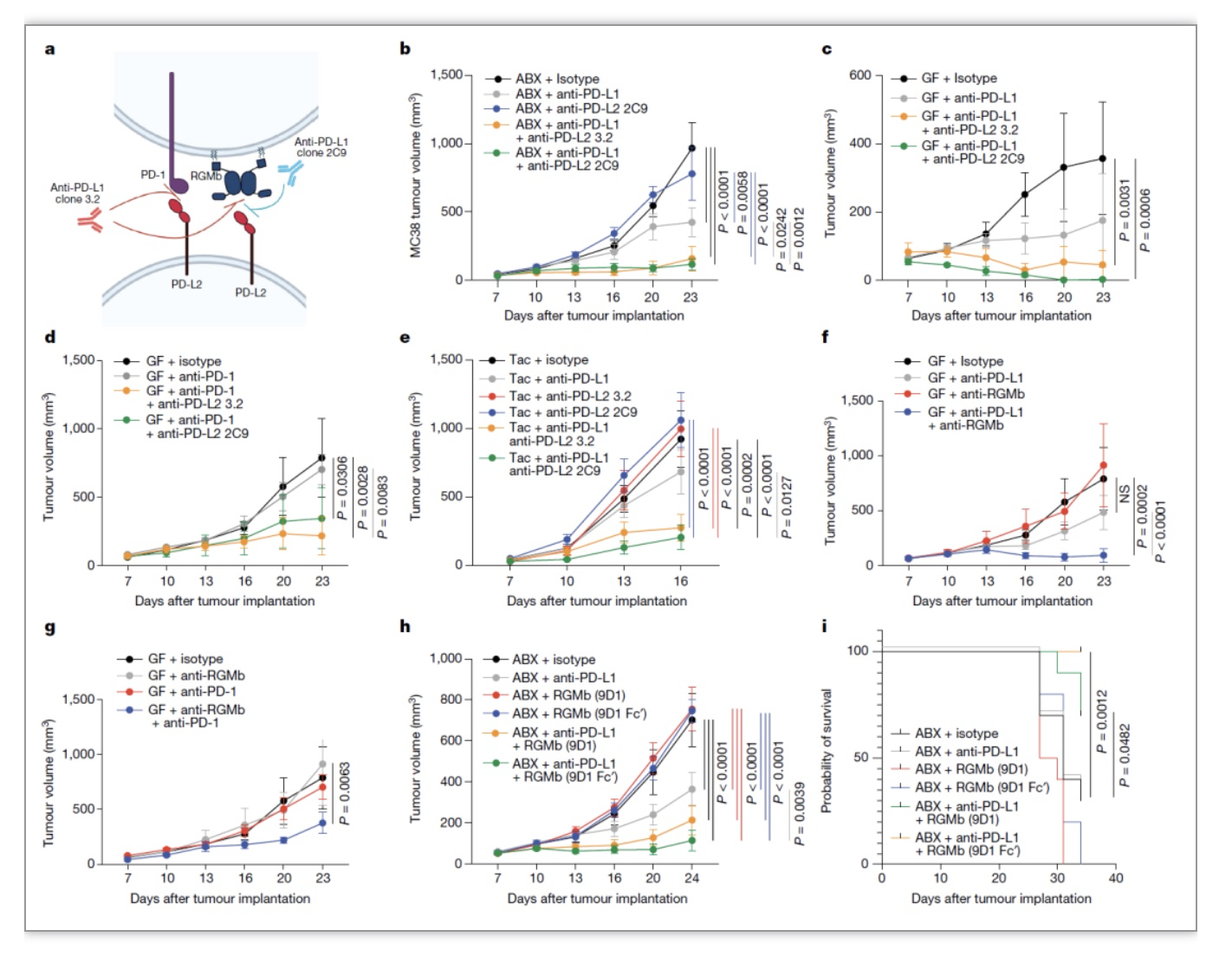
图4. 阻断PD-L2-RGMb能够克服anti-PD-1或anti-PD-L1治疗抵抗
作者进一步探究了RGMb如何影响T细胞功能,联合anti-PD-L1和anti-RGMb治疗能够显著增加GF小鼠肿瘤中CD8+T细胞和CD4+T细胞浸润,而不影响Treg细胞的浸润,提高了肿瘤中CD8+T/Treg比例。联合治疗也显著促进了瘤内CD4+T细胞表达TNF。这些结果说明联合anti-PD-L1和anti-RGMb治疗能够显著增加T细胞抗肿瘤免疫。为直接探究RGMb在特定细胞群体中调节抗肿瘤免疫的作用,作者分别构建了T细胞、巨噬细胞和粒细胞敲除RGMb的小鼠,发现只有T细胞缺陷RGMb能够改善抗生素喂养小鼠anti-PD-L1治疗的抗肿瘤免疫反应。体外用WT BMDC与WT或Rgmb KO的 CD8+T共培养,发现敲除RGMb的CD8+T细胞显著增加了CD44、T-bet的表达,并且RGMb KO CD8+T细胞中有更高比例的细胞表达IFNγ、IL-2和TNF。
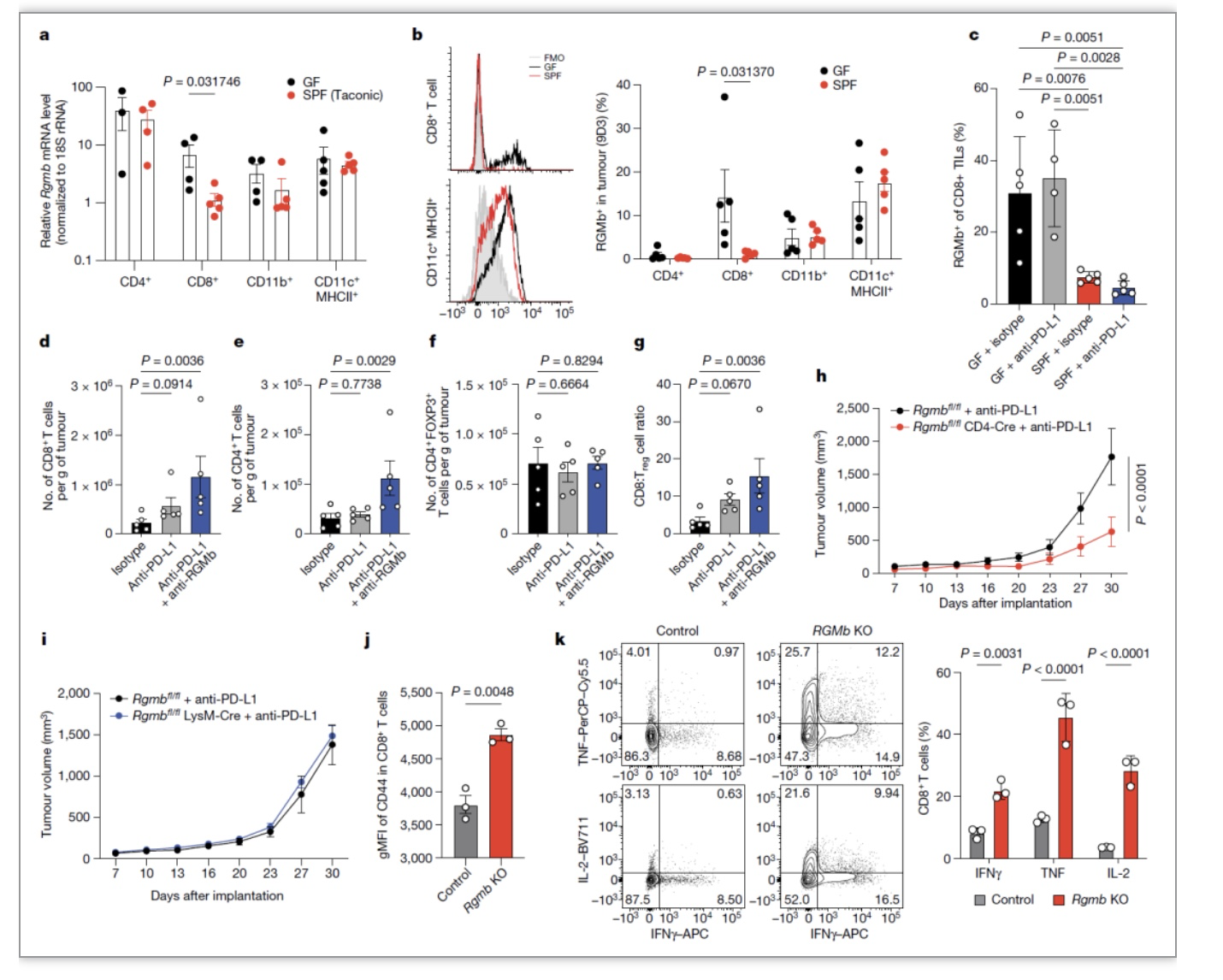
图5. T细胞表达RGMb调节抗肿瘤免疫

