
化学小分子在调控细胞命运层面具有其独特的优势,例如操作简便安全,且处理可逆。但在细胞多能性重编程过程中,小分子是如何沉默体细胞基因,激活内源性多能基因调控网络,最终成功实现细胞命运转变呢?为了回答这一有趣的科学问题,作者首先根据生成Sall4(早期多能性标志物)阳性克隆的数目进行了化学小分子筛选,发现类视黄醇X受体(RXRα)特异性激活剂CD3254效果是最好的。与对照组相比,CD3254处理后可以显著增加Sall4阳性克隆数目(图1)。此外,外源过表达Rxra能够将重编程效率提高至10倍,进一步说明CD3254-RXRα在细胞化学重编程中具有关键作用。
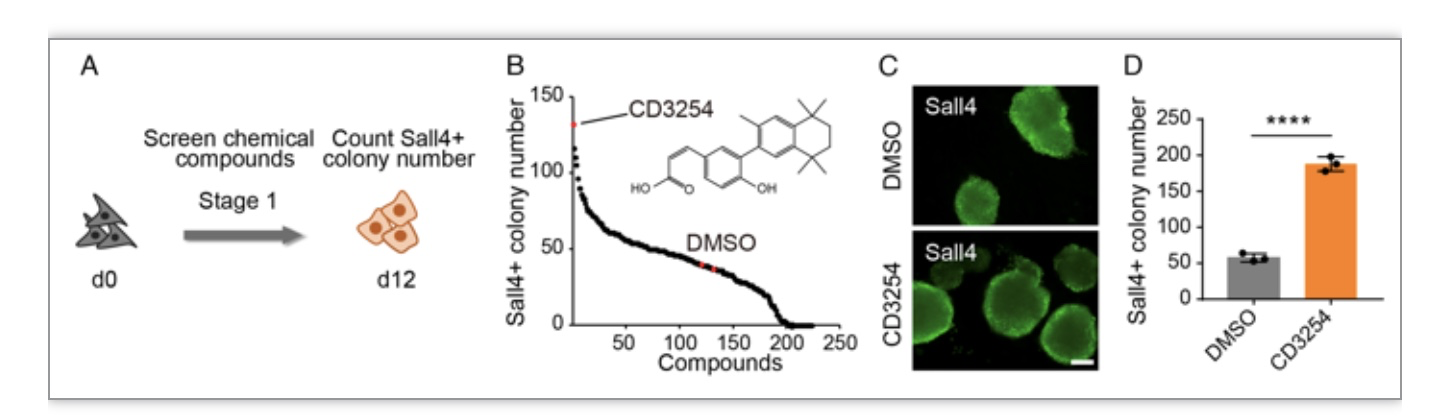
图1 筛选发现RXRα特异性激活剂CD3254可以显著促进细胞化学重编程
重编程时间延长至第二阶段,CD3254也可以显著提高Oct4-GFP阳性克隆数目。后续通过一系列实验证明CD3254处理后获得的化学诱导多能干细胞(ciPSCs)具备多能性,能够分化成三个胚层细胞和组织,将ciPSCs打到小鼠胚胎,能够获得健康的小鼠,证明了重编程的成功完成(图2)。
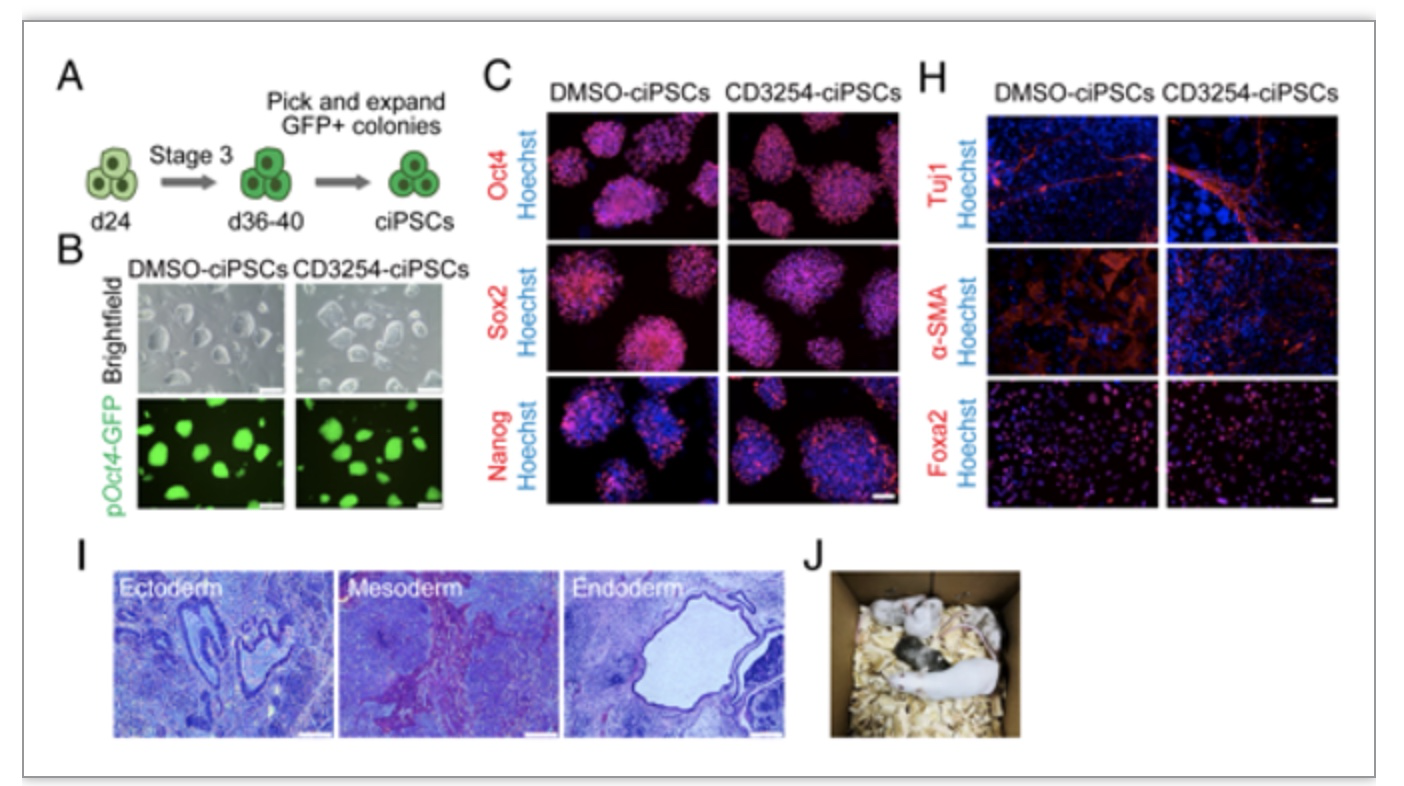
图2 ciPSCs的功能鉴定
作者接下来对CD3254处理和过表达Rxra的重编程样本进行了转录组测序,发现CD3254处理与过表达Rxra的上升差异基因都富集到了RNA降解途径。RNA外切体是RNA降解系统的关键复合物,由11个组分组成。CD3254处理和Rxra过表达都能够激活RNA外切体的所有11个基因(Exosc1-10和Dis3)。为了探究转录因子RXRα是否是RNA外切体的直接上游调控因子,作者通过CUT&Tag实验观察到RXRα确实直接结合在RNA外切体相关基因的启动子区域(图3)。综上所述,课题组确定CD3254-RXRα轴可以直接转录激活RNA外切体。另外,相关的功能实验证明RNA外切体在细胞重编程过程中是重要的。
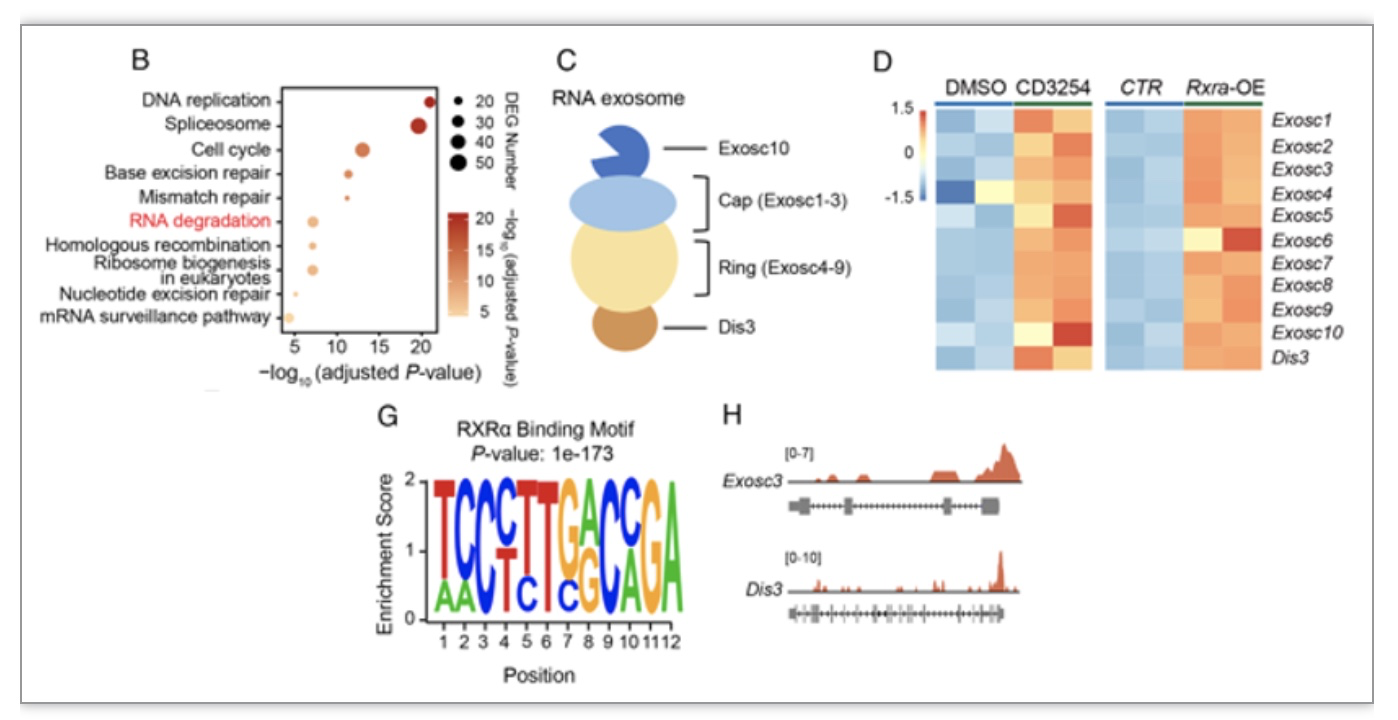
图3 CD3254-RXRα轴可以直接转录激活RNA外切体
RNA降解是一种普遍的生物学过程,广泛存在于所有生物体内。当RNAs寿命结束时,或者出现缺陷时,就会被RNA降解系统迅速识别,并立即降解。目前研究表明,RNA外切体广泛参与编码RNA和多种非编码RNAs的加工和降解途径,在生长、发育及疾病过程中发挥关键作用。为了深入探究RNA外切体在细胞化学重编程的具体机制,作者将敲低RNA外切体的核心成分Exosc3的重编程样品进行链特异性RNA测序,发现mRNA,lncRNA,eRNA和paRNA的表达呈现下降趋势。意外的是,作者发现在敲低Exosc3后转座子相关的repeat RNA的整体表达水平明显累积,进一步分析发现上调的转座子RNAs多数属于MMVL30家族,说明细胞化学重编程中,RNA外切体降解转座子相关的RNAs,其中多数属于MMVL30家族。为了进一步验证该结论,作者进行了RIP-qPCR实验,发现Exosc3蛋白与MMVL30转录本有直接结合。同时,通过RNA稳定性实验发现CD3254处理后MMVL30的整体稳定性明显减弱,说明CD3254-RXRα-RNA外切体信号轴主要降解转座子相关的RNAs(图4)。在功能上,MMVL30敲低后会显著增加Sall4+克隆数目,说明MMVL30是化学重编程过程中一个新障碍。
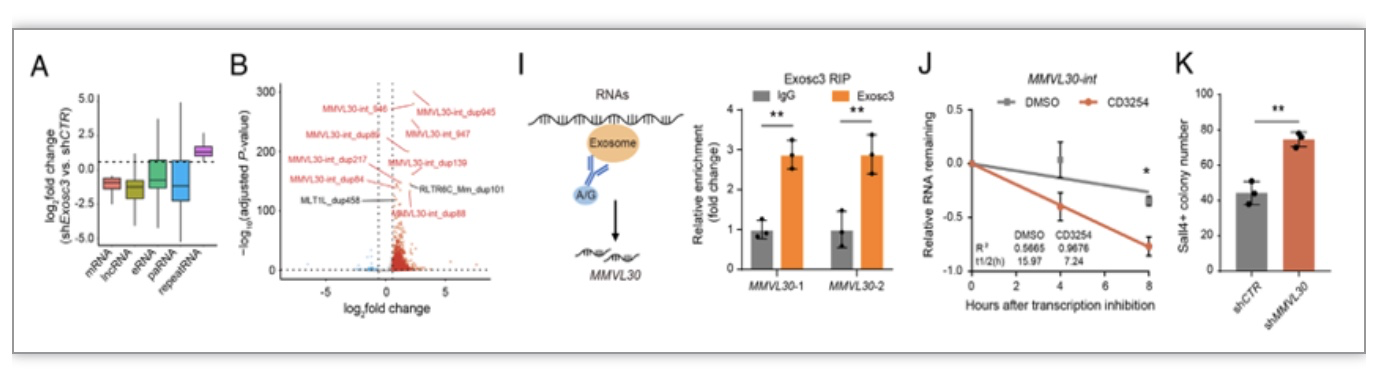
图4 CD3254-RXRα-RNA外切体信号轴调控MMVL30
之前的研究表明MMVL30-int相关转录本的累积会刺激细胞核苷酸感应途径,刺激下游干扰素反应[6-8]。为了探究这一机制是否同样存在于细胞重编程过程,作者首先通过生信分析发现敲低Exosc3后,内源逆转录病毒ERVs同时以顺式和反式形式被诱导。上调的ERVs,包括MMVL30在内,以正向和反向表达,就会形成双链RNAs(dsRNAs)。作者发现在重编程中,CD3254处理会显著降低细胞内dsRNA的含量以及MMVL30区域dsRNAs的形成。此外,敲低Exosc3会导致炎症(例如IFN-γ和TNF-α信号通路)相关基因的表达上调。而CD3254处理,Rxra过表达以及MMVL30敲低后均可以显著降低这些炎症相关基因的表达水平。直接外源添加IFN-γ和TNF-α明显抑制重编程,而添加IFN-γ和TNF-α下游JAK与IKK的抑制剂能够促进重编程,说明炎症反应(包括IFN-γ和TNF-α信号通路)也是化学重编程的障碍(图5)。综上所述,CD3254-RXRα-RNA外切体信号轴在细胞化学重编程过程中通过降解转座元件相关RNAs(主要是MMVL30),减弱MMVL30介导的炎症反应(包括IFN-γ和TNF-α信号通路),从而有效促进细胞化学重编程效率。

图5 CD3254-RXRα-RNA外切体信号轴可以降低ERV所介导的炎症反应

图6 本研究机制模式图

