近三年来严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)及其突变株在全球的肆虐给人类健康带来了前所未有的威胁,除了广泛关注的呼吸系统症状外,越来越多的研究表明SARS-Cov-2对神经系统的影响更为深远。肌痛、头痛、神志不清、定向障碍、脑雾等是SARS-CoV-2引起的典型神经系统症状。此外,已有研究表明SARS-CoV-2对神经元和胶质样细胞高度敏感[1],可能通过ACE2、NRP1等受体发挥影响,并且非细胞自主破坏也是其诱导嗅觉缺失的潜在原因[2]。除了这些显著的表型发现,研究还发现SARS-CoV-2通过组蛋白模仿来破坏宿主表观遗传调控[3],这表明病毒可能通过细胞外信号干扰宿主细胞的表观遗传调控。然而,目前还没有共识关于病毒在神经系统入侵后如何影响神经元。因此,尚未明确SARS-CoV-2是否以及如何通过表观遗传调控来维持神经元细胞的稳态。
通过模拟SARS-CoV-2感染神经元细胞,发现RBD蛋白可以通过细胞外信号转导途径调控线粒体生物发生,从而改变神经元细胞的生长状态。这项研究揭示了线粒体生物发生相关基因的转录后调控过程,为我们深入了解SARS-CoV-2的发病机制提供了新思路。

宿主细胞通过控制生存能力和增殖能力,可以提供应对外部损伤刺激的机制。例如,肿瘤细胞可以促进细胞增殖和迁移,以抵御宿主防御细胞和免疫系统的攻击[4]。然而,尚不清楚神经元细胞是否采用该途径抵御SARS-CoV-2病毒的攻击。因此,我们需要更多的研究来确定SARS-CoV-2刺突蛋白RBD及其各种突变体是否会影响神经元细胞的生存能力、增殖能力以及宿主的表观遗传调控系统。研究人员推测SARS-CoV-2可能影响“非复制性”感染的转录反应和神经元细胞线粒体生物发生的表观遗传机制。在使用RBD及其突变体蛋白模拟病毒感染SH-SY5Y细胞时,研究人员发现这种胞外信号刺激不仅引起SH-SY5Y细胞的增殖,而且引起线粒体数量的增加,但在呼吸道上皮细胞HBE中则没有这样的作用(图1B-D)。这些研究结果表明SARS-CoV-2的细胞外作用模式可能是通过RBD特异性细胞表面受体的转导来改变神经元细胞的增殖活性和线粒体活性。
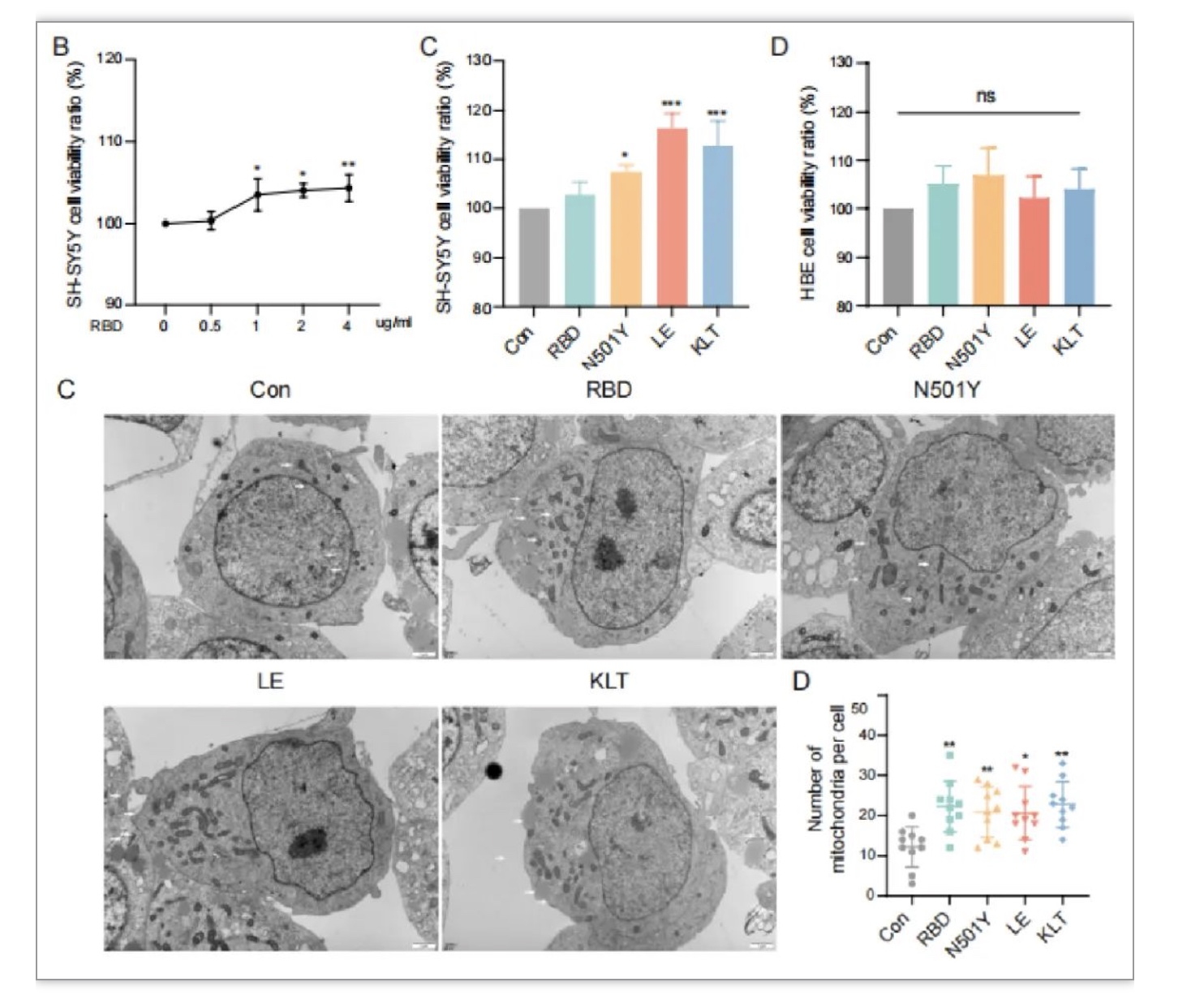
图1 RBD及其突变体引起SH-SY5Y细胞增殖和线粒体数量增加
线粒体功能与细胞增殖密切相关。研究结果显示RBD蛋白能够显著提高SH-SY5Y细胞中mito-tracker标记的荧光强度,并促进DRP1和MFF蛋白的表达,这是细胞对外界生理反应应激的必要反应,维持细胞内稳态。此外,RBD突变体蛋白作用后可以显著降低细胞内总ROS (cytoROS),表明RBD蛋白通过胞外信号转导途径,控制神经元细胞内线粒体的生物活性和生物发生,进而调节ROS稳态。NRF2是与线粒体生物发生和活性氧稳态调节相关的蛋白,同时受表观遗传因子如KDM6B和EZH2的转录调控。在RBD及其突变体作用24小时后,研究人员发现SH-SY5Y细胞中EZH2表达明显降低,H3K27me3表达降低,而KDM6B表达略有升高(图2D)。因此,RBD可能通过表观遗传途径激活神经元细胞中某些基因的表达,从而介导线粒体生成和ROS稳态。通过ChIP-qPCR,研究人员还发现LE突变体处理后Nrf2启动子区域的H3K27me3修饰水平显著降低(图2I),这表明RBD蛋白通过表观遗传机制激活神经元细胞内Nrf2基因转录。
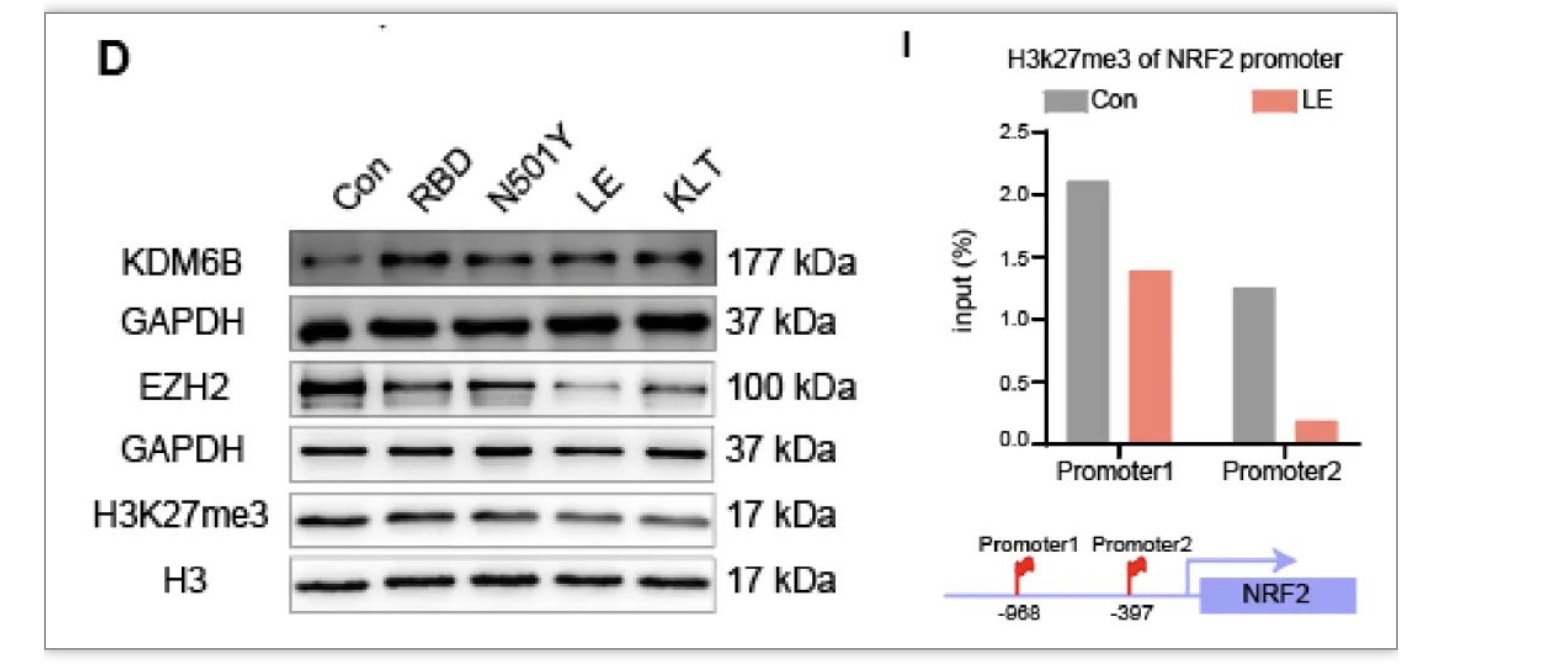
图2 RBD及其突变体通过表观遗传机制调控Nrf2基因转录
传统的基因转录本定量测定方法,如实时荧光定量PCR (RT-qPCR)、微阵列和普通RNA-seq等只能定量检测稳态RNA[5]。在这项研究中,尹世刚课题组使用EU标记方法捕获新生RNA转录本,然后使用稳定状态RNA作为对照,采用链特异性RNA高通量测序,分析了隐藏转录本(Cryptic transcripts)的转录模式。生物信息学分析发现,RBD蛋白处理SH-SY5Y细胞12小时前后新生RNA转录水平存在显著差异。本研究中基于新生RNA的表达模式共鉴定出76个上调基因和96个下调基因,新生RNA的上调主要发生在核糖体相关基因中,形成了紧密的表达相互作用网络(图3左)。相比之下,下调基因之间的相互作用较弱,只有HSPA5基因具有较强的分子相互作用,有报道称HSPA5基因是冠状病毒的干预靶点(图3左)。另一方面,下调的基因更多地与特定的信号通路相关,如MARK和Rap1信号通路,都与SARS-Cov-2感染宿主相关。总体而言,尽管还需要进一步的研究,但新生RNA的表达谱为了解SARS-Cov2对神经元细胞的影响提供了一个窗口,并揭示了与其生命周期密切相关的一系列基因转录调控规律。

图3 RBD蛋白影响SH-SY5Y细胞新生RNA的转录

