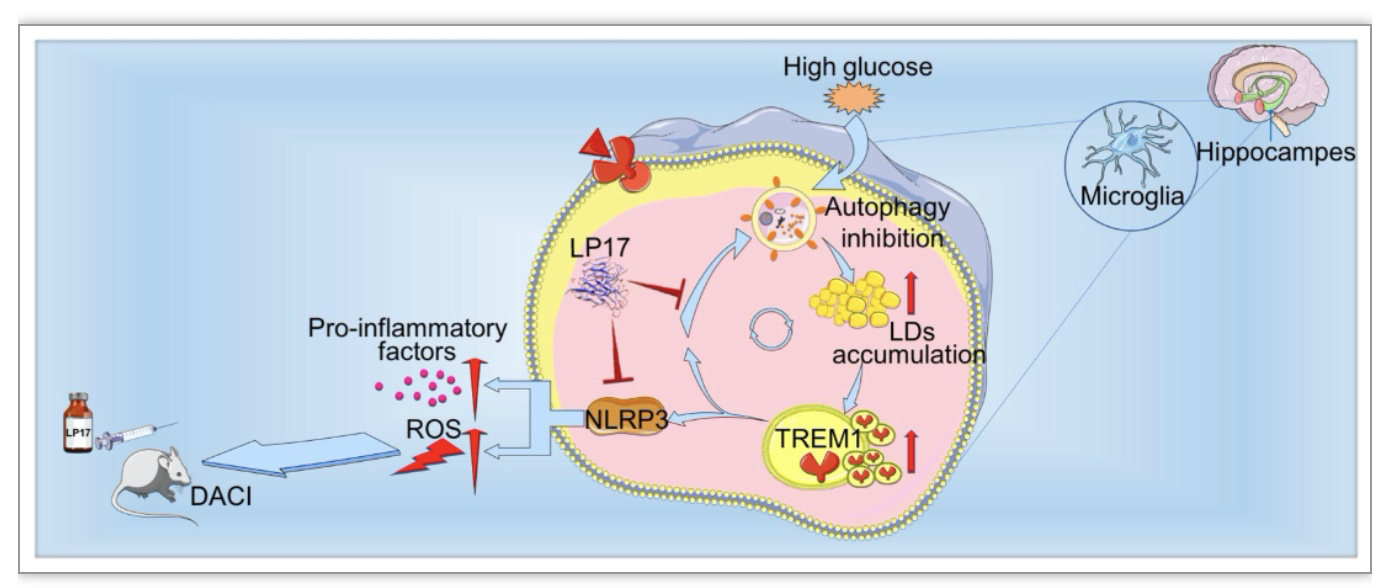
我国糖尿病患者高达1.47亿,易感人群约为1.97亿,高居世界首位。糖尿病认知功能障碍(DACI)已超越心脑血管并发症,成为糖尿病患者第二大死因,尚无有效的诊断和指导治疗的早期生物标记物,给患者个人和社会带来沉重的医疗负担。小胶质细胞活化引起的神经炎症以及随后的神经认知功能受损是糖尿病认知功能障碍的主要发病机制。脂滴自噬是是自噬的一种,参与维持细胞内脂质及炎症稳态。

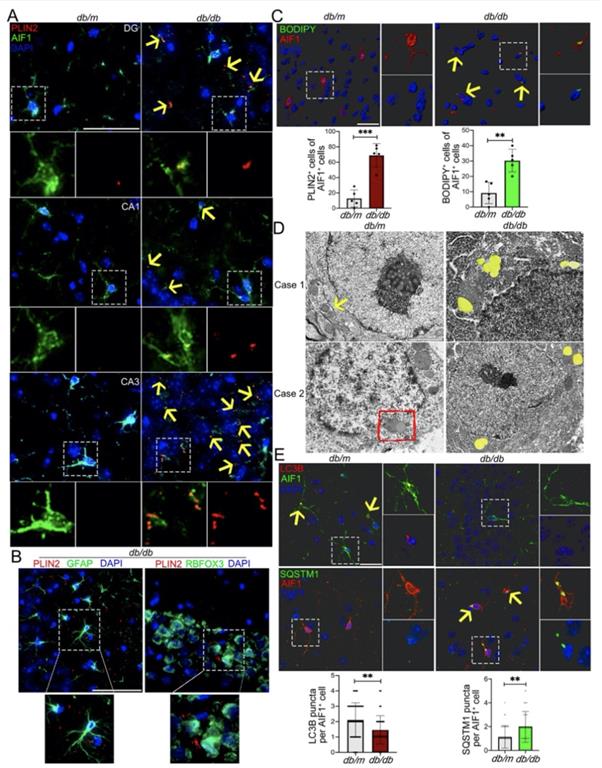
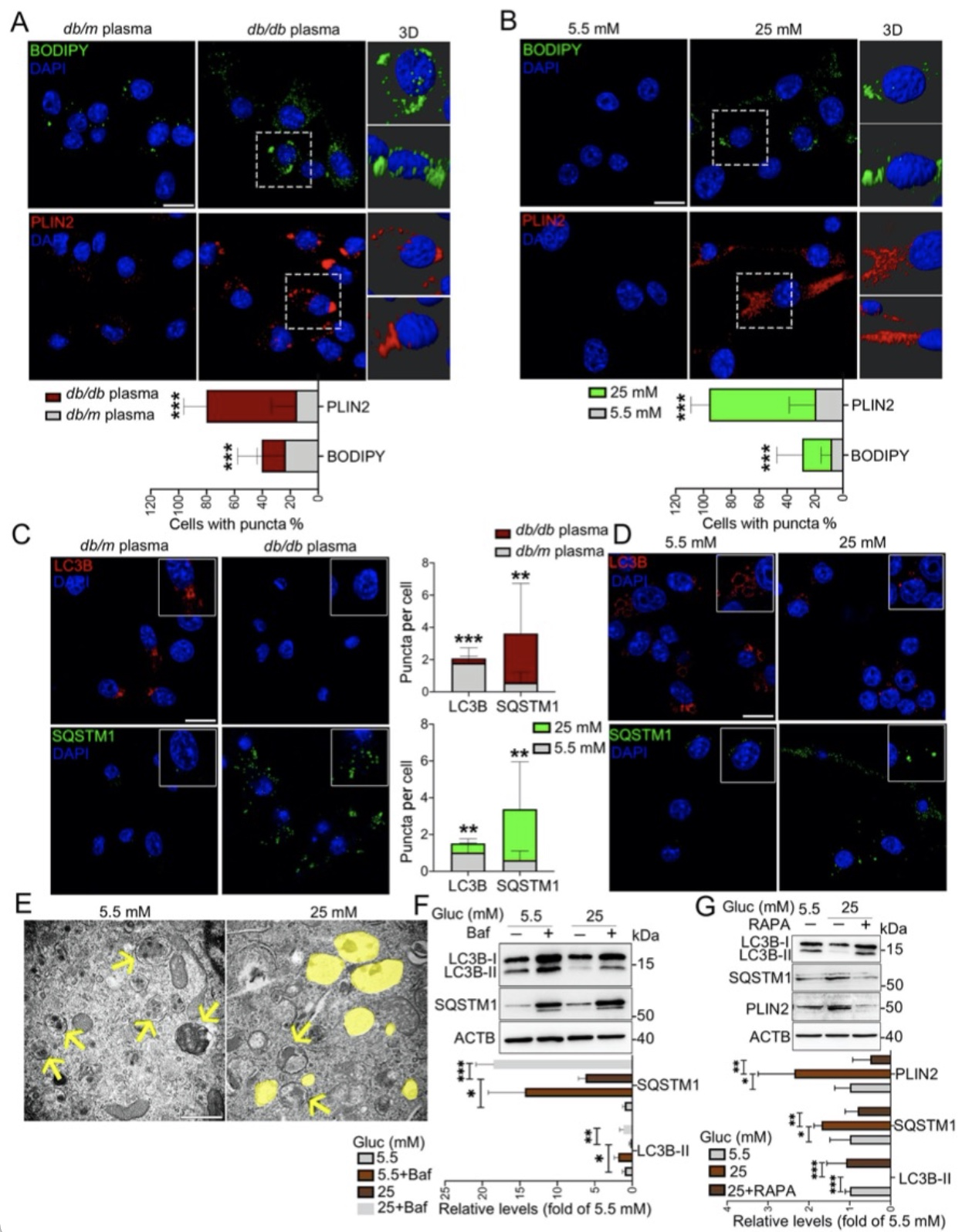
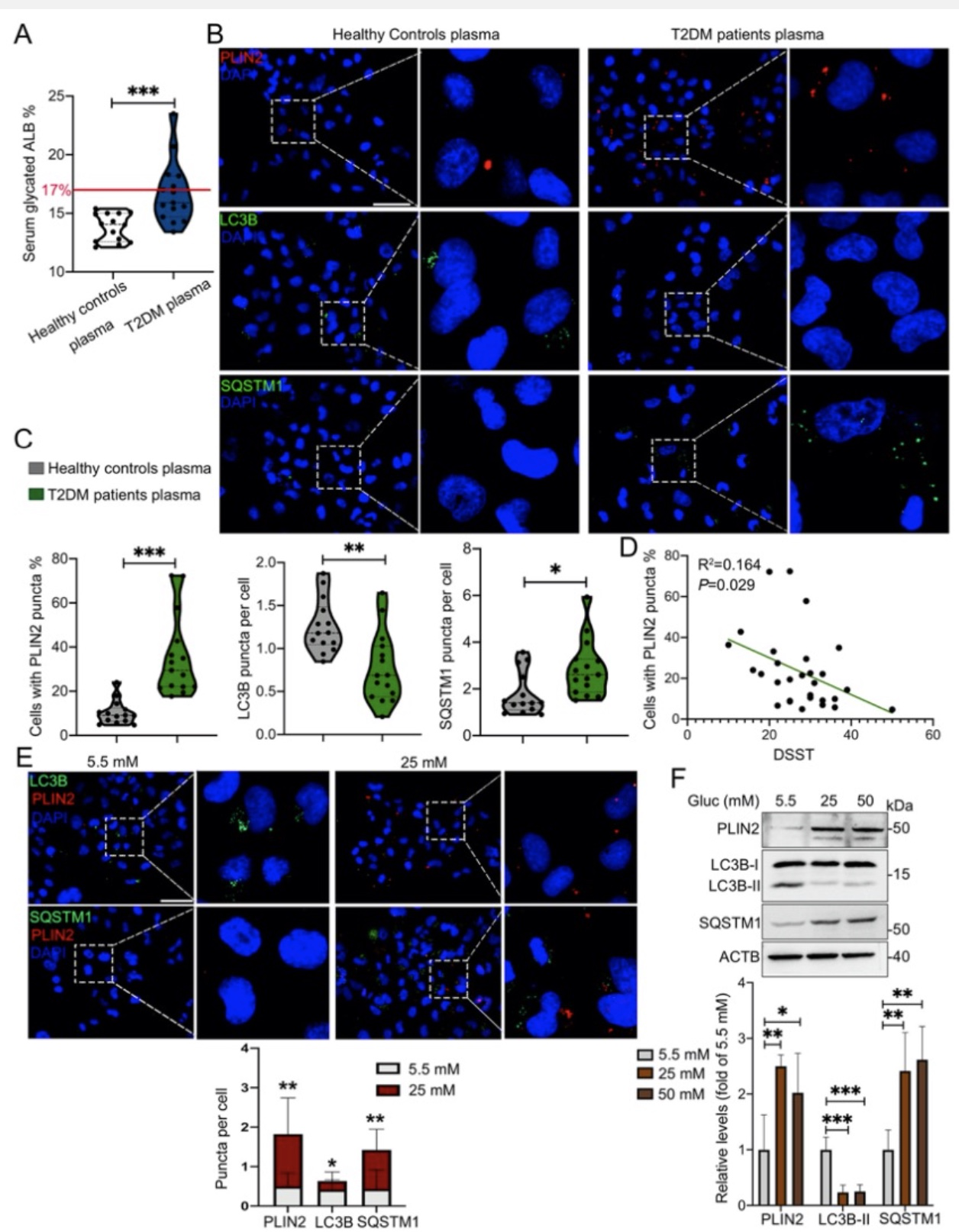
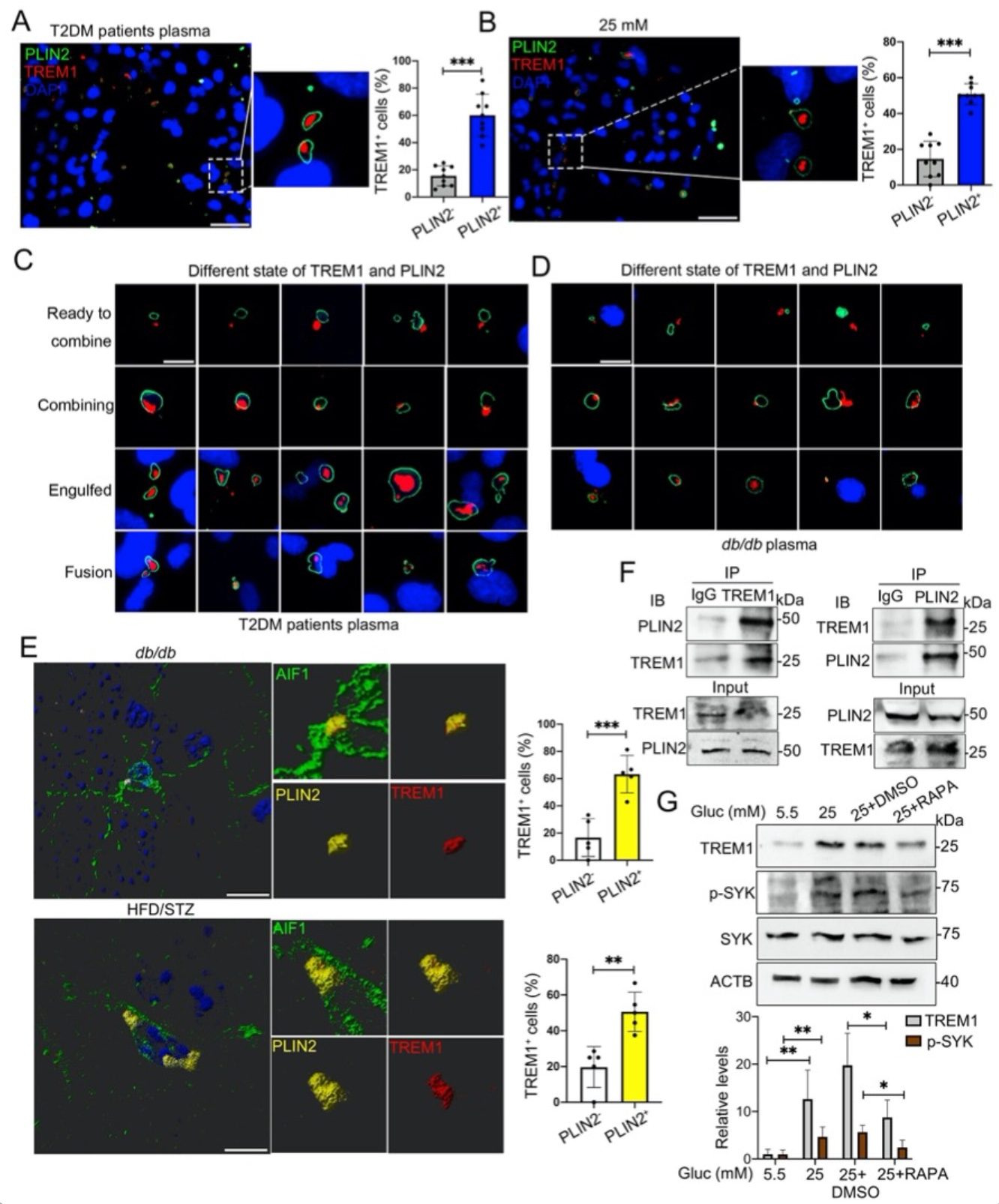
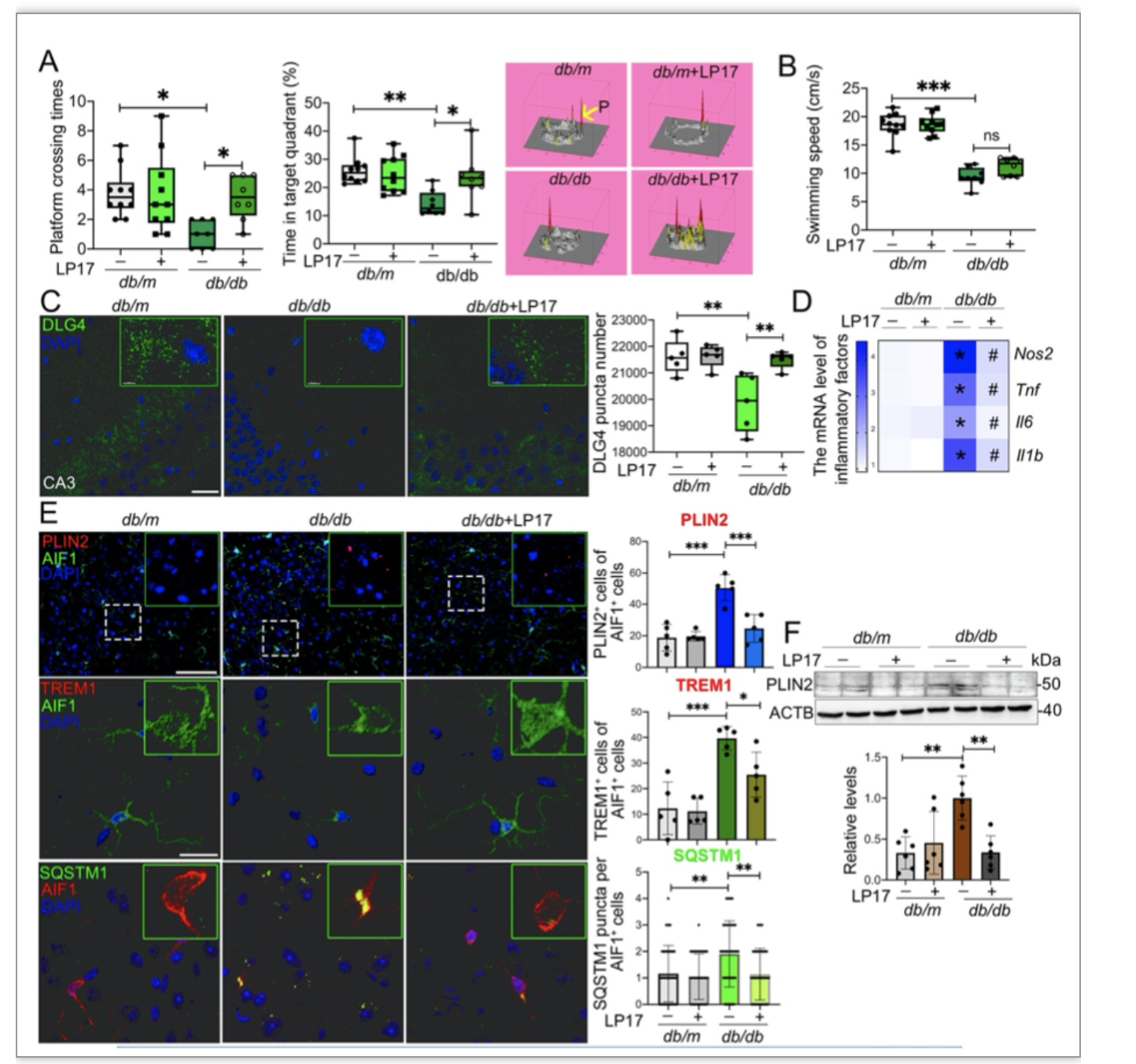
近年来的研究已经表明,小胶质细胞内脂滴蓄积的老龄化大脑的一个重要特征,然而,小胶质细胞脂滴自噬是如何参与DACI的以及具体的分子机制知之甚少。针对上述科学问题,研究团队构建了2型糖尿病喂养模型HFD/STZ以及基因敲除模型db/db小鼠,以及体外高糖培养鼠源性小胶质细胞BV2、人源性小胶质细胞HMC3以及原代小胶质细胞,确认了高糖损害的脂滴自噬作用是小胶质细胞中脂滴蓄积的重要原因。从机制上创新性的发现,蓄积的脂滴与小胶质细胞特异性炎症放大因子TREM1共定位,并多成包裹形式,导致小胶质细胞中TREM1的异常堆积,这反过来又加重了高糖诱导的脂滴自噬损伤,随后通过NLRP3炎性小体促进高糖诱导的神经炎症级联反应。此外,本研究确定了LP17对db/db小鼠和HFD/STZ小鼠的TREM1进行药物阻断可抑制脂滴和TREM1的蓄积,减少海马神经元炎症损伤,从而改善认知功能。综上所述,作者的发现揭示了一个以前未被重视的机制,既高糖诱导的脂滴自噬受损与老年糖尿病患者脑内持续加重的神经炎症之间的分子机制关系,表明TREM1可作为一个延迟糖尿病相关认知衰退具有临床转化潜力的治疗靶点(图1)。
图1. 脂滴自噬受损参与神经炎症致DACI的模式图
图3. 高糖环境是导致脂滴自噬受损的重要原因
图4. 老年糖尿病患者的血清诱导人源性小胶质细胞内脂滴自噬受损
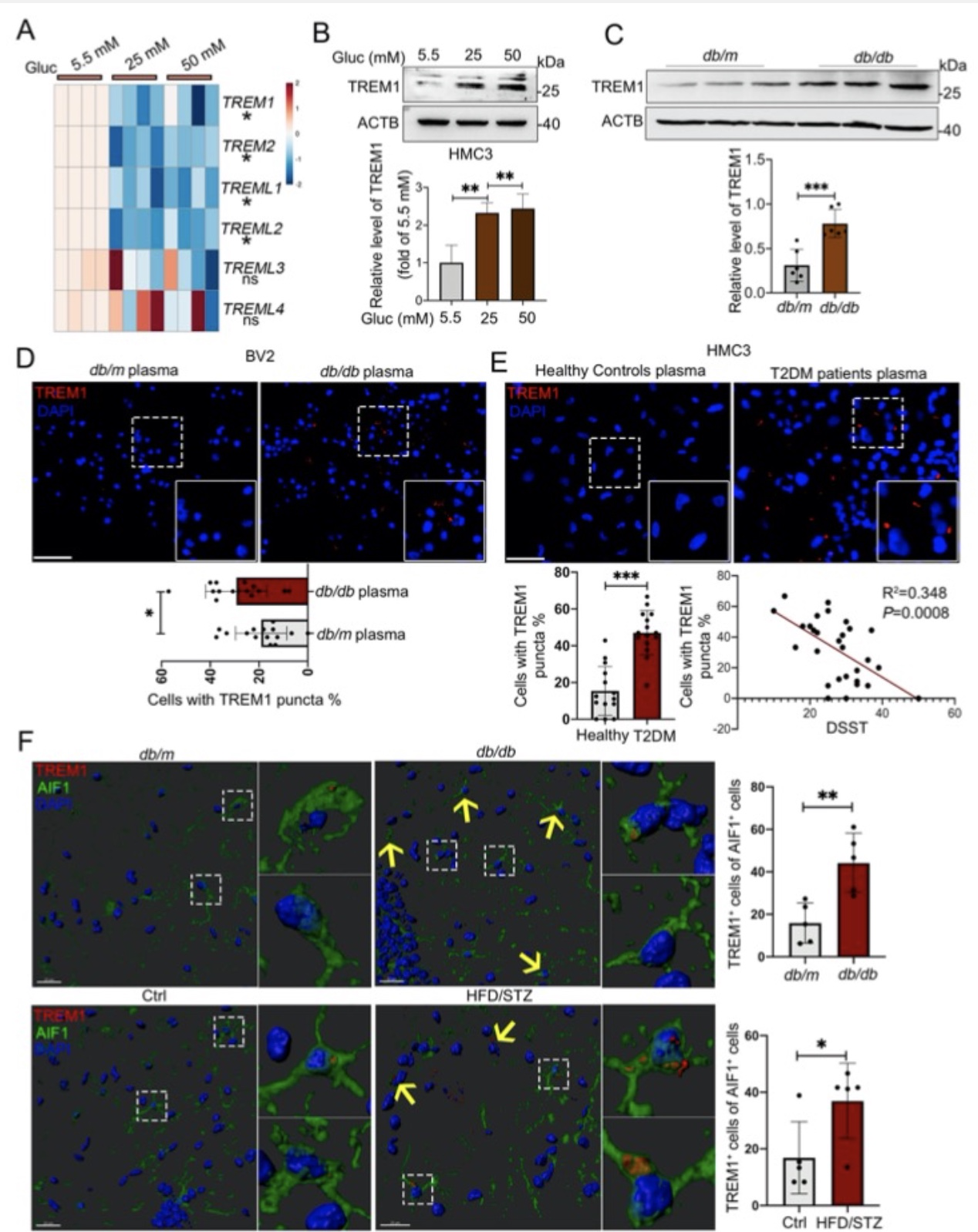
图5. 血清及高糖诱导细胞内TREM1蛋白水平增加,且动物模型中海马内小胶质细胞中TREM1蛋白升高
图7. 抑制TREM1后能够挽救高糖损害的脂滴自噬功能
图8. 动物模型中LP17药物抑制TREM1功能后能够改善认知功能、减轻海马神经元损伤、抑制小胶质细胞的炎症反应。
文章结论与讨论,启发与展望
综上所述,该研究集中揭示了DACI中蓄积的脂滴和神经炎症的分子基础。脂质代谢和神经炎症的发生机制是非常复杂的,炎症放大因子TREM1蛋白水平的增加在这一过程中发挥了重要的作用,本研究中严格的数据证明了这一点(图1)。该研究也为衰老过程中的认知障碍发生机制提供了一种更深层次的理解。从临床转化潜力来讲,该研究证实了TREM1是糖尿病认知功能损害的潜在靶点。未来的研究方向需要进一步探索脂滴如何与TREM1共定位,并且是如何将炎症信号释放。