红细胞是血液中含量最丰富的一类细胞,它为人体所有器官及组织提供氧气。红细胞生成是从造血干细胞逐步分化形成成熟红细胞的过程。造血干细胞可先形成第一个红系祖细胞爆裂形成单位红系(BFU-E)[1],然后BFU-E细胞分化为红系晚期祖集落形成单位红系(CFU-E)细胞和原红细胞。原红细胞进入末端红系分化形成嗜碱性红细胞、多色红细胞、正色红细胞,最终吐核形成成熟的红细胞[2]。红系祖细胞是有一定的增殖能力的多能性细胞,它的增殖受多种受体及细胞通路的调控,其中,c-Kit和EPOR是红系祖细胞表面两个最重要的受体。c-Kit是一种III型酪氨酸激酶,它的表达与激活是红系祖细胞增殖的关键。c-Kit在与其特异性配体SCF结合后,会形成二聚体并发生自磷酸化,进而激活细胞内的一系列通路,从而促进增殖[3]。EPOR是促红细胞生成素EPO的受体,主要在红系分化过程中起调控作用[4]。低浓度的EPO也可以促进早期红系祖细胞的增殖。发现了N6-甲基-2’-脱氧腺苷(6mdA)可以显著促进红系祖细胞的增殖。

该研究采用10种常见的核苷和脱氧核苷分别处理红系祖细胞,发现仅当6mdA处理时可以显著促进红系祖细胞的增殖(图1J)。并发现只有当第0天时加入6mdA进行培养才可以促进红系祖细胞的增殖(图1L-M),提示6mdA可能在早期红细胞生成过程中发挥作用。
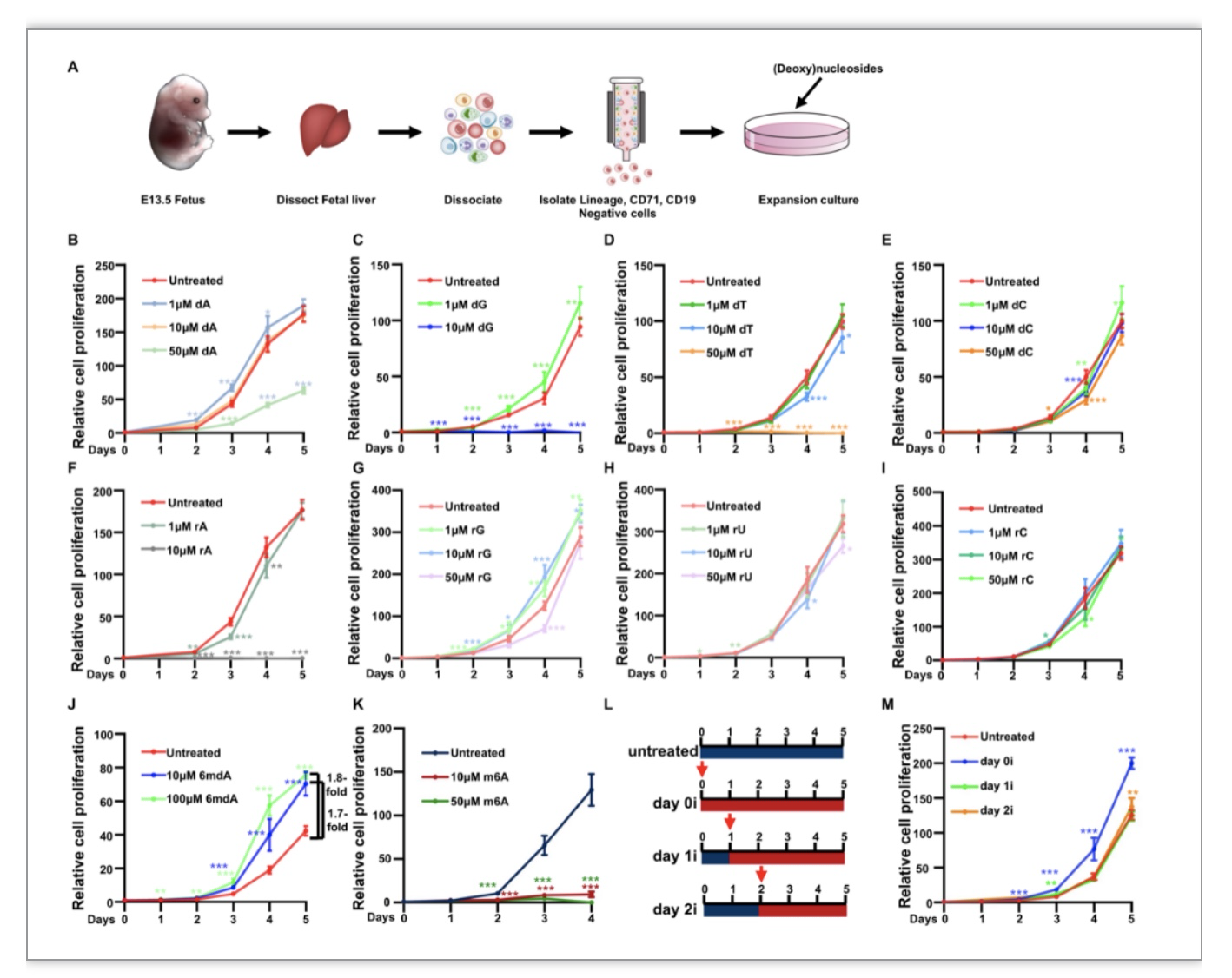
图1. 常见(脱氧)核苷对红系祖细胞增殖影响
进一步利用流式分选得到更纯净的早期红系祖细胞BFU-E及晚期红系祖细胞CFU-E(图2A),发现6mdA可促进早期红系祖细胞BFU-E的增殖,能将其增殖提高约10倍左右,而对CFU-E的增殖没有显著影响(图2B-C)。EdU掺入实验证明6mdA处理显著增加了BFU-E细胞增殖(图2D)。数据统计结果显示6mdA可维持BFU-E细胞增殖能力。在8天扩增培养后,6mdA核苷处理使超过60%的BFU-E细胞处于高增殖的状态,而未处理组仅30%(图2E)。直接收集扩增8天后BFU-E细胞图像显示,在初始培养细胞相同的情况下,6mdA核苷处理显著增加红系细胞的产量。与MTS检测结果一致,在扩增8天后,6mdA核苷处理将红系细胞最终的产量提高约10倍,且在与EPO和SCF共同培养条件下,6mdA处理组BFU-E细胞增殖倍数能超过5000倍,而仅有EPO和SCF培养下细胞增殖倍数为560倍(图2F)。除此之外,6mdA显著抑制红系祖细胞的凋亡(图2G-H)。

图2. 6mdA可促进早期红系祖细胞BFU-E的增殖
对6mdA培养的BFU-E细胞进行转录组测序发现,6mdA引起BFU-E细胞内多个基因转录水平发生变化。在这些变化的基因中,红细胞生成所必需的受体酪氨酸激酶c-Kit的表达上调。除此之外,促进包括红系祖细胞在内的造血祖细胞增殖的重要转录因子Myb和Gata2的表达也显著上调。相反,在红系分化后期表达的几个重要基因的转录水平显著被抑制,包括两个在血红素合成中起关键作用的两个酶Alas2(5-aminolevulinate synthase 2)和Fech(ferrochelatase),促进核凝结的重要蛋白Wdr26(WD40 repeat protein 26),红细胞离子交换器Slc4a1(solute carrier family 4 member 1)以及血型糖蛋白Gypa(glycophorin A)。建立红系终末分化正确起始和进展的重要转录因子Gata1、Klf1和Spi1的表达也显著下调(图3A)。三个红系祖细胞相关的转录因子(c-Kit,Myb,Gata2)和八个在红系分化末期表达的基因(Alas2、Fech、Wdr26、Slc4a1、Gypa、Gata1、Klf1、Spi1)的表达通过q-PCR得到进一步的验证(图3B-C)。
由于酪氨酸激酶受体c-Kit的转录水平和它表达的动态变化都维持在较高的水平,而且它是支持红系祖细胞增殖的关键蛋白。因此,c-Kit的蛋白表达与磷酸化也被验证。与mRNA水平变化相一致,6mdA显著增加了c-Kit的蛋白表达,在100 μM 6mdA处理后,c-Kit的蛋白表达在扩增6天后提高4倍左右。除此之外,c-Kit上与MAPK和PI3K/AKT信号通路相关的两个磷酸化位点Tyr568/570以及Tyr719的磷酸化均增加2倍左右(图3D-E)。利用慢病毒shRNA的方法对BFU-E细胞中c-Kit进行敲低,当c-Kit敲低40%左右时,BFU-E细胞的增殖被明显的抑制,而6mdA对BFU-E细胞增殖的促进作用也受到一定影响(图3F-G)。
为了探究6mdA刺激的c-Kit激活能否导致下游PI3K/AKT及MAPK/ERK信号通路的激活,这些通路中重要的下游蛋白ERK1/2及AKT的磷酸化也被检测。结果显示,6mdA处理对ERK1/2本身的表达没有明显的作用,而ERK1/2的磷酸化在不同扩增天数都有明显的增加。定量结果显示在扩增2天,6天后,分别增加了3.0倍和4.3倍,表明MAPK/ERK通路被激活(图3H-I)。同样的,AKT的表达在6mdA处理后也没有明显的变化,但AKT的磷酸化在6mdA处理后显著增加,在扩增2天,4天,6天后分别增加了2.0,3.7和2.6倍(图3J-K)。总的来说,这些结果证明6mdA处理引起c-Kit及下游ERK/MAPK,PI3K/AKT通路的激活,这可能是造成红系祖细胞增殖提高的原因(图4)。
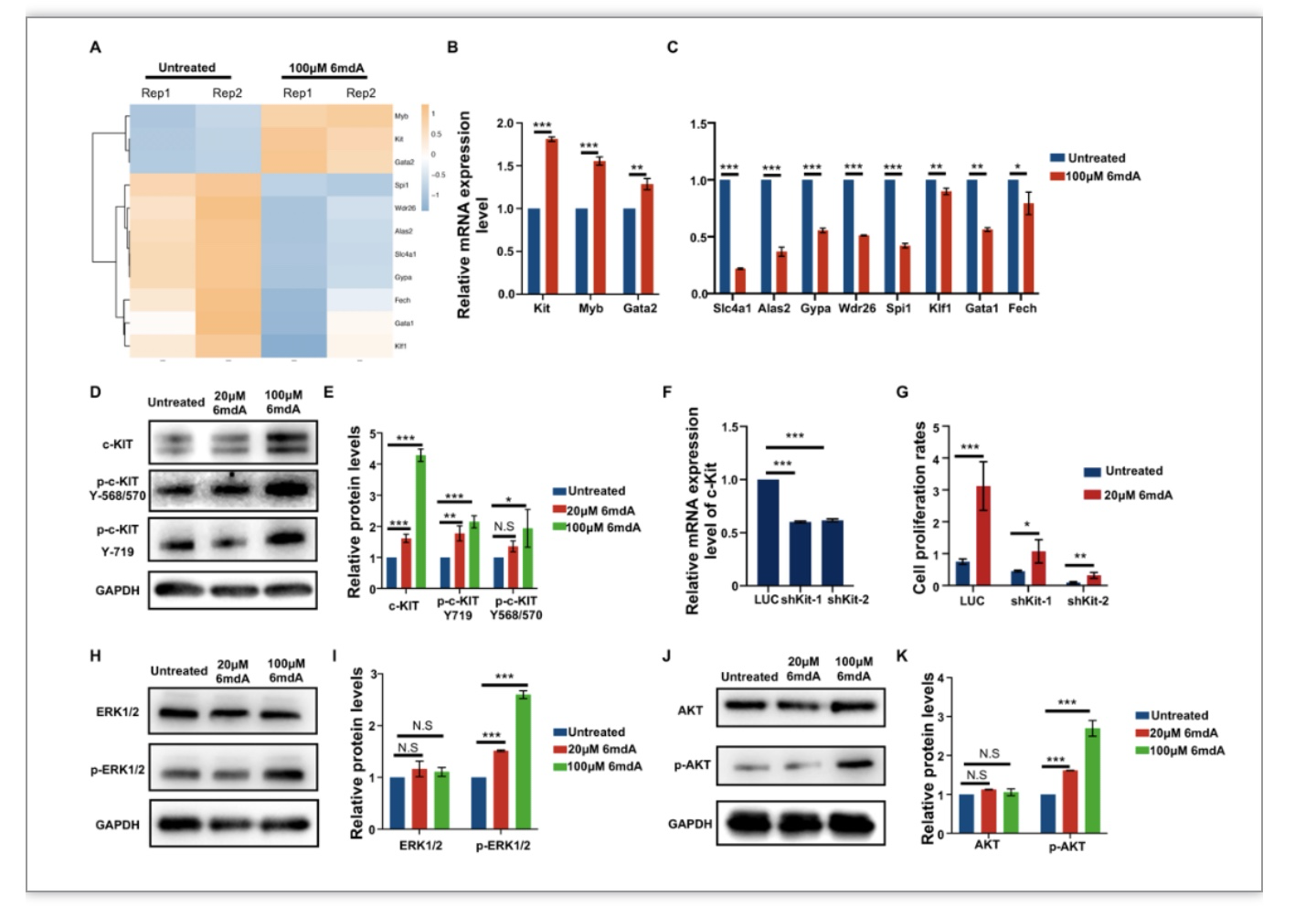
图3. 6mdA促进c-Kit及其下游通路的激活
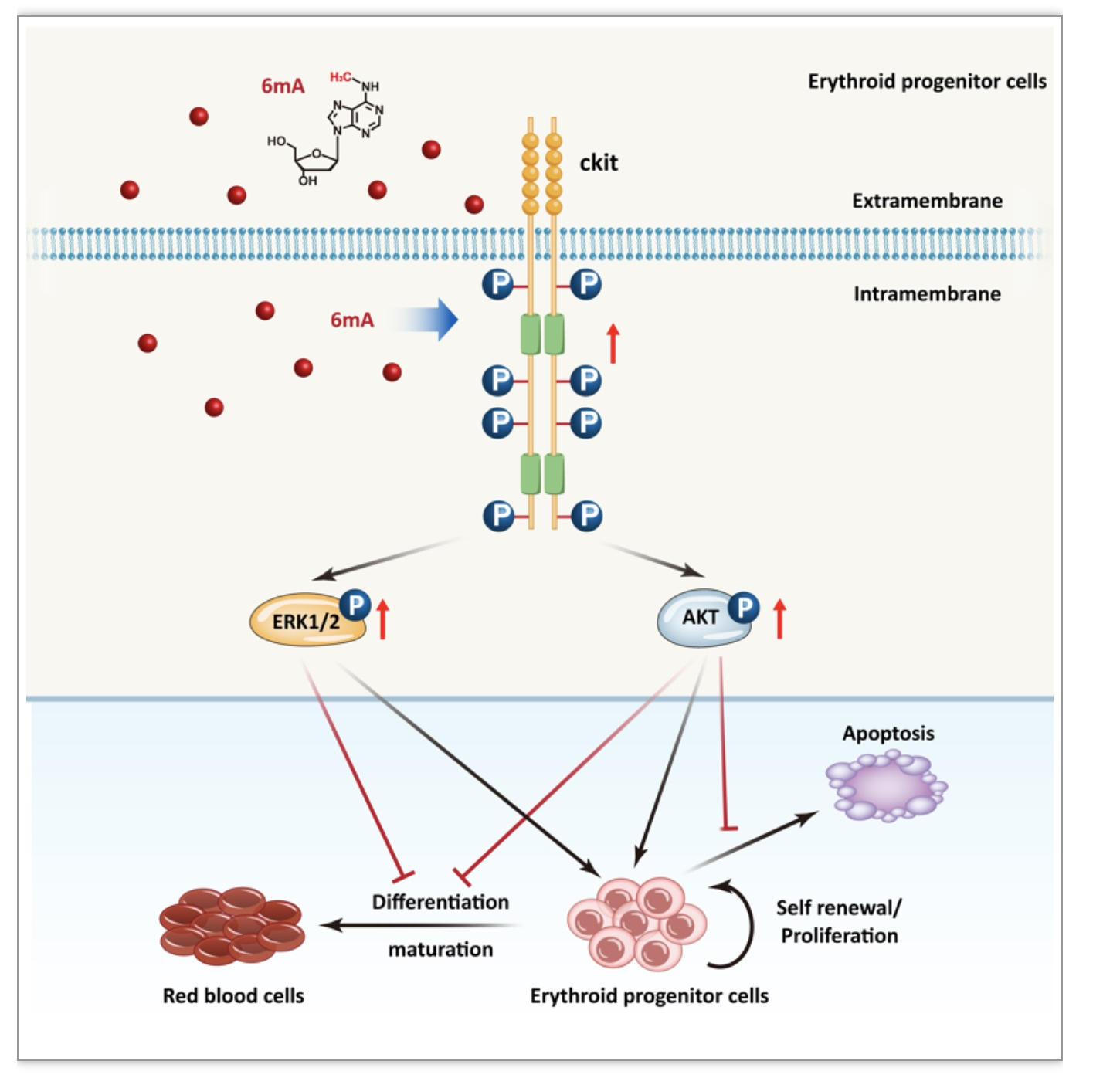
图4. 文章总结图
总之,此研究证明6mdA处理通过激活酪氨酸激酶c-Kit及其下游的MAPK/ERK和PI3K/AKT通路来促进BFU-E细胞的增殖。发现6mdA可能是一种促进体外培养红系祖细胞增殖的化学分子。但红系祖细胞中6mdA的直接作用蛋白还需要进一步的研究。

