纤维化是不同病因引发慢性肝病的最终共同途径,经肝硬化,进展为肝癌,全球每年因慢性肝病造成超过200万人死亡。我国是肝病大国,全球每年一半以上的肝癌发生在我国,患者多,危害大,阻断及逆转肝纤维化已经成为慢行肝病研究中的一个重要课题。肝纤维化表现为肝脏内弥漫性的、过量的细胞外基质(特别是胶原)沉积。尽管从TGFβ促进肝星状细胞活化,促进胶原合成和沉积,抑制金属蛋白酶合成,积聚细胞外基质,促成肝硬化的机制和信号通路已经比较清晰,但其更为早期的事件仍不明确,使得其分子病因特征不明确,至今尚无有效的早期肝纤维化诊断标志物和明确靶点的抗肝纤维化药物。因此,阐明肝纤维化早期事件和分子机制对开发新的肝纤维化诊疗策略至关重要。
该研究对临床纤维化肝脏样本进行了定量蛋白质组学分析,发现上调的组织蛋白酶S(cathepsin S, CTSS)在纤维化肝脏细胞外基质(extracellular matrix, ECM)重构中占据中心节点位置。进一步分析164例不同阶段肝纤维化患者成对的血液和肝穿刺样本,发现血清CTSS水平可有效预测早期肝纤维化,填补领域空白。进而利用小鼠肝纤维化模型,揭示细胞外CTSS主要来源于脾脏巨噬细胞,通过降解胶原18A1(collagen 18A1, COL18A1)重构细胞外基质,并生成内皮抑素(endostatin),内皮抑素通过整合素α5/β1(integrin α5β1)直接激活肝星状细胞(hepatic stellate cells, HSCs),使得肝脾轴在肝纤维化发生以及发展中互相促进,恶性循环,从而加速肝纤维化进程,揭示了已有100余年临床外科手术切脾保肝历史但不为人知的分子机制,证明CTSS是新的明确靶点肝纤维化诊治靶点。

研究团队首先利用iTRAQ标记试剂和定量蛋白质组技术比较了肝纤维化患者肝脏和健康人肝脏,发现CTSS在纤维化肝脏中上调并处在失调ECM蛋白的中心节点位置。考虑到CTSS切割基质蛋白,从而重构细胞外基质是肝纤维化的重要诱因,作者利用不同发展阶段和不同病因引起的肝纤维化患者血清进行系统比较,ROC曲线分析表明CTSS可灵敏地区分健康和早期肝纤维化患者,进一步证明CTSS失调是肝纤维化早期的重要分子事件。
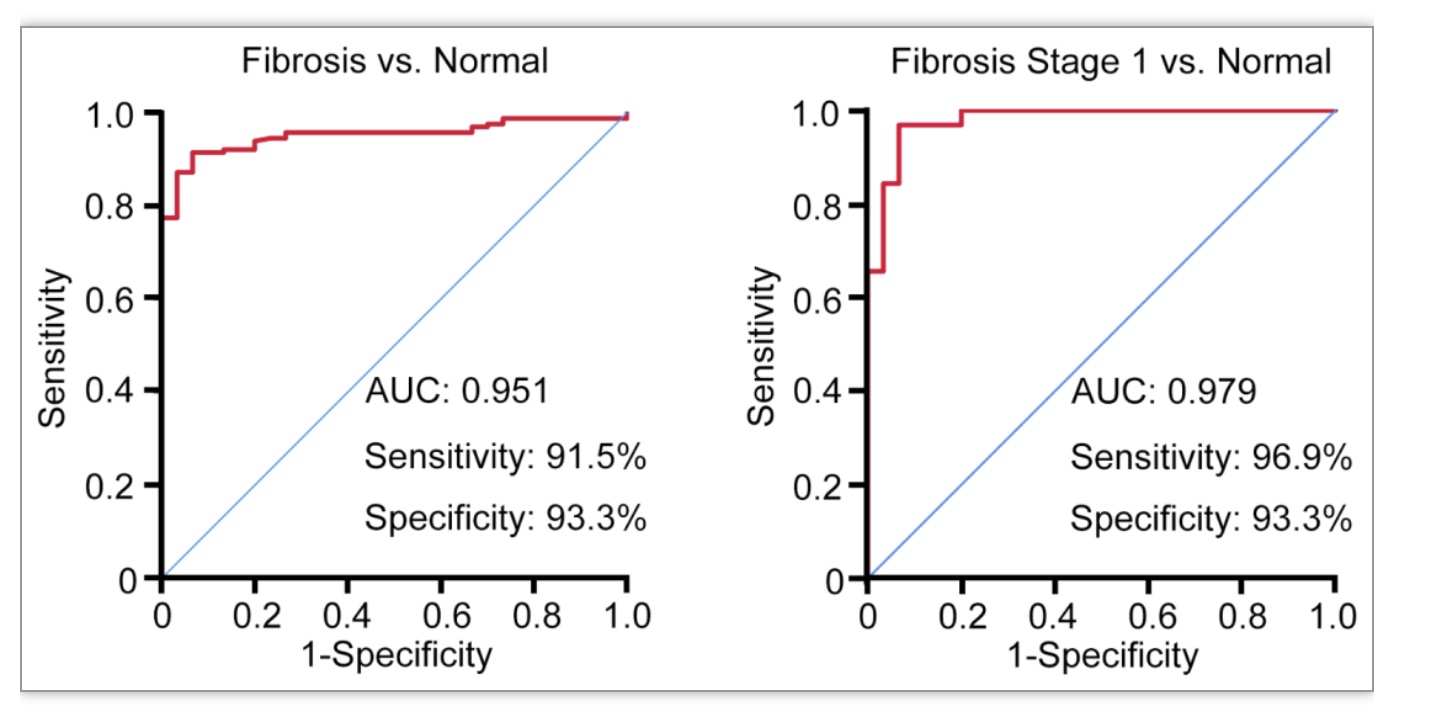
图1. ROC曲线分析显示血清CTSS对所有肝纤维化患者或I期患者的诊断准确性
利用Ctss-基因敲除模型小鼠分别构建CCl4和DDC诱导肝纤维化模型,均发现Ctss缺失显著抑制肝纤维化发展。利用重构的生化反应体系和N端蛋白组学技术,发现COL18A1是CTSS的直接底物,可生成内皮抑素。机制上,内皮抑素可以结合肝星状细胞表面的integrin α5β1受体,激活p-FAK-p-ERK信号通路,促进肝星状细胞活化和胶原生成。
作者进一步通过单细胞测序分析发现巨噬细胞可能是肝脏CTSS的主要来源细胞,并通过构建巨噬细胞特异性的Ctss敲除小鼠模型,发现巨噬细胞Ctss的缺失可显著缓解肝纤维化进展。而脾脏作为单核细胞的储存库,为受损组织提供单核巨噬细胞。利用脾片移植小鼠模型证明脾脏巨噬细胞携带CTSS迁移到肝脏。当纤维化小鼠行脾脏切除术后,其肝纤维化得到显著缓解,肝脏巨噬细胞的浸润和CTSS含量显著降低。临床上“切脾保肝”治疗肝硬化的外科手术已有一百多年历史,但其机制至今未明,使得外科切脾手术没有明确的可解释的科学依据而难于发展。脾脏巨噬细胞来源CTSS诱发肝纤维化机制的阐明首次在分子层面上解释了“切脾保肝”的机理。
给纤维化小鼠CTSS特异性抑制剂LY3000328,可有效缓解甚至部分逆转已经发生的肝纤维化,提示CTSS具有作为临床治疗肝纤维化明确靶点的价值。
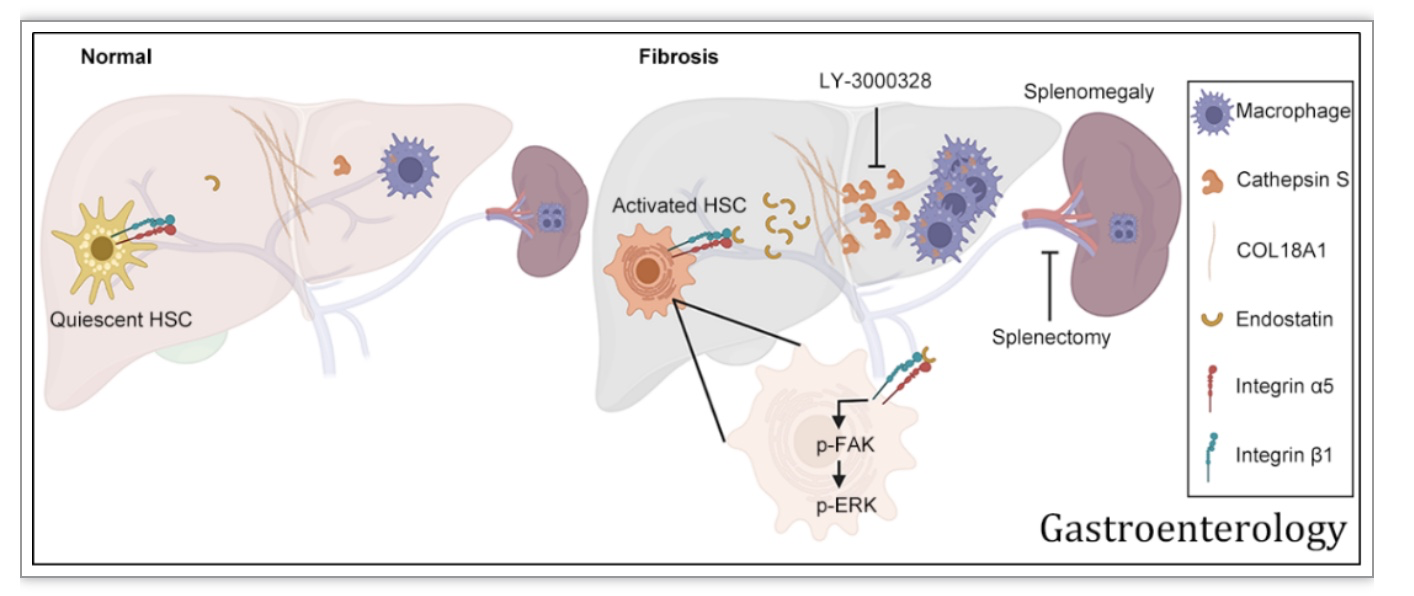
图2. CTSS促进肝纤维化机制与干预策略
总之,该研究表明脾脏来源巨噬细胞携带CTSS转运到肝脏,是早期肝纤维化的重要分子事件;CTSS切割胶原18A1产生内皮抑素,激活肝星形细胞,引发肝纤维化,并通过肝脾轴循环恶化,促进肝纤维化;血清CTSS是普适性的肝纤维化早期诊断灵敏的标志物,靶向CTSS可能提供新的治疗途径。未来需要对肝纤维化患者进行更大队列的多中心研究,促进临床转化。

