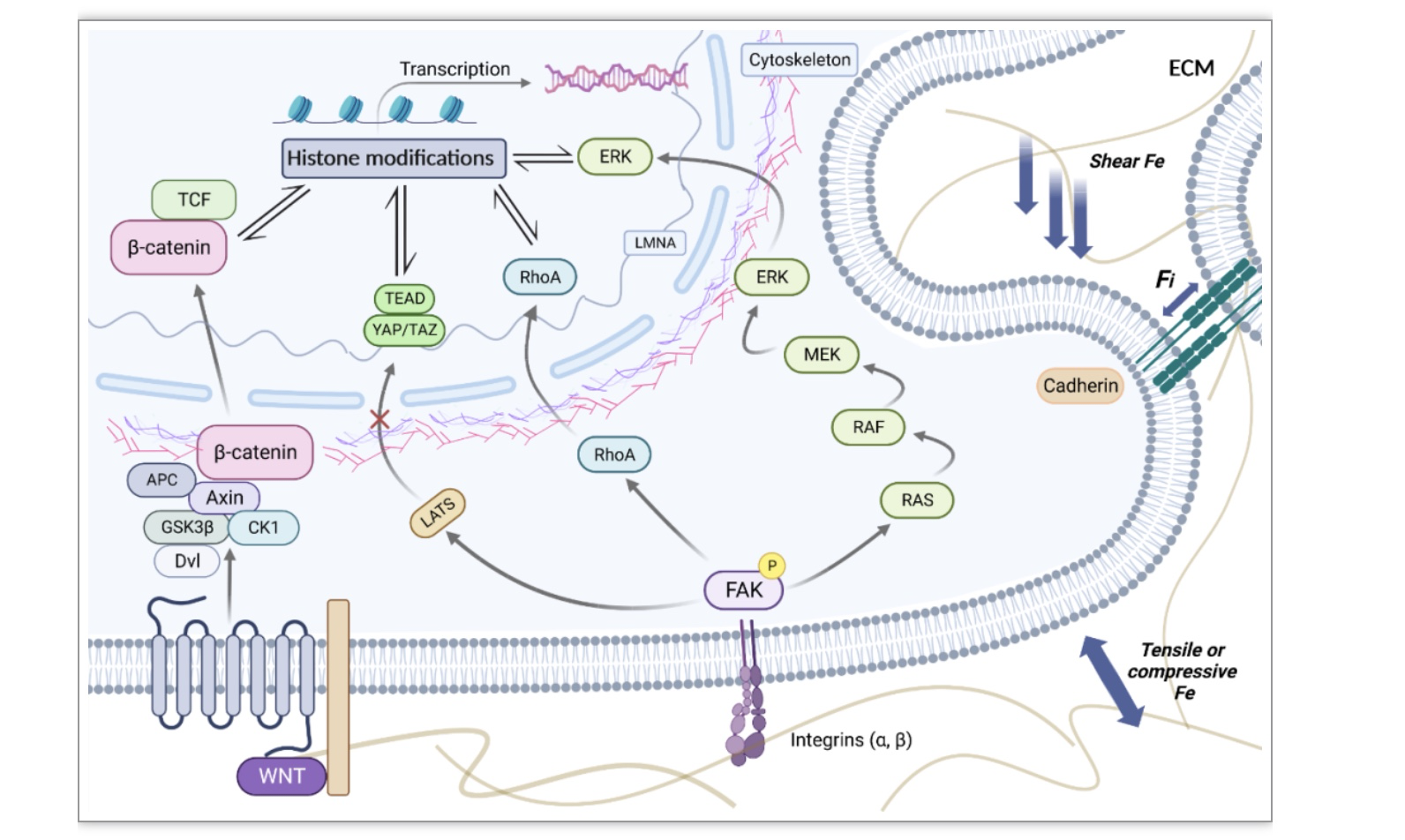
力学刺激是导致细胞环境改变的关键物理因素,在力学信号转导的过程中,各种各样的信号通路至关重要(图1)。信号通路作为细胞行为的基本调节器,调控细胞增殖,分化,凋亡,并在病理过程中表现出特异性标志性的改变。
自整合素被发现以来,一直被认为是参与信号转导的受体中的核心[1]。黏着斑激酶(Focal adhesion kinase, FAK)是一种胞质酪氨酸激酶,通过破坏整合素氨基端结构域(Four-point-one, Ezrin, Radixin, Moesin, FERM)和中央激酶结构域之间的自抑制分子内相互作用而被激活。被激活的FAK与Src家族激酶形成一个复合体,继续调节多个下游信号通路,如丝裂原相关蛋白激酶(MAPK),Rho激酶(RhoA),Hippo-YAP/TAZ以及WNT/β-catenin等[2-4]。
随着分子机制研究的深入,表观遗传学被证实与力学信号转导过程密不可分。组蛋白修饰主要通过招募非组蛋白和改变染色质结构来影响染色体动态和基因表达[5]。组蛋白修饰有多种类型,如组蛋白乙酰化、组蛋白甲基化、组蛋白丁腈化、组蛋白磷酸化和组蛋白β-羟丁基化。每种组蛋白修饰都能产生不同的生化信号,并在细胞增殖和分化中发挥关键作用。而力学信号通路中的许多分子本身就受组蛋白修饰的调控,在传递信号控制靶基因的过程中也涉及到组蛋白修饰的改变。
机械刺激调节细胞行为的机制一直在不断扩大和完善,但机械信号如何在分子水平上被感知和传递到直接基因表达一直是一个谜。因此阐明在生理病理过程中力学刺激介导的信号转导与表观遗传学协同作用的分子机制至关重要。
图1 机械传导的构成和机制
作者在综述中重点说明了组蛋白修饰作为表观遗传学的重要组成部分,如何与多种信号通路相协调,控制着细胞命运和疾病进展。作者认为组蛋白修饰可以与信号通路形成反馈调节环路,即组蛋白修饰不但可以作为信号通路的下游调节靶基因转录和表达,还可以反馈调节信号通路。此外,对力学信号通路及表观遗传学改变作为预测预后的潜在标记物和治疗靶点提出了展望。
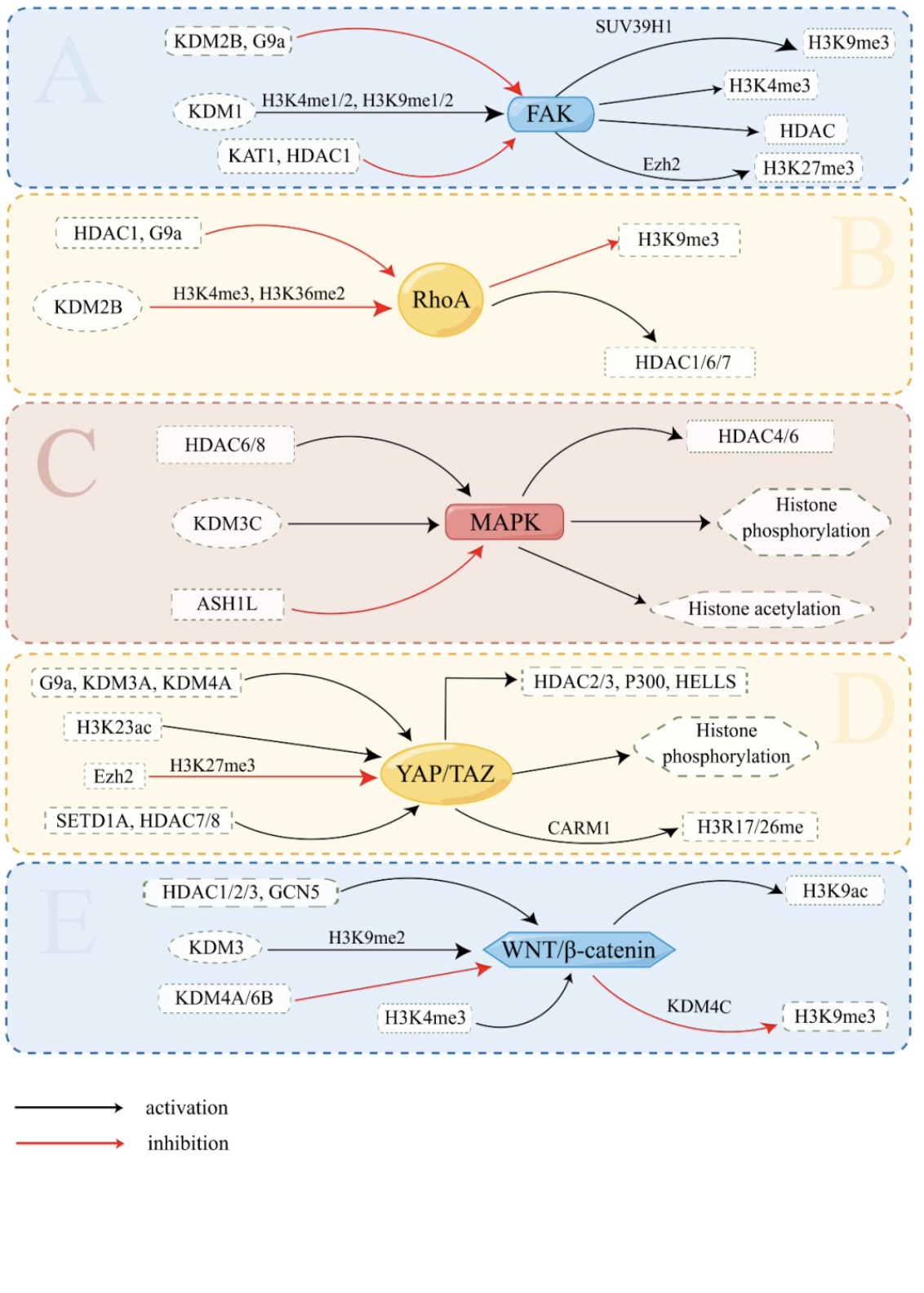
作者在文中先后阐述了力学信号通路转导影响组蛋白修饰和表观遗传学影响力学信号通路分子表达这两方面(图2)。通过前面内容明确了力学信号转导所产生的的最终生物效应依赖于组蛋白修饰。而信号通路是由很多种环节共同配合形成的,这其中涉及到很多分子,于是这些组分就成为了组蛋白修饰的靶点,受控于表观遗传学改变。于是作者阐述了信号通路中存在的反馈调节环路(图3)。
FAK信号通路中,FAK使H3K9me3表达水平升高,H3K9me3可以促进FAK信号通路激活;YAP/TAZ信号通路中,YAP受到HDAC的反馈调节;WNT信号通路中,KDM4C既是WNT的下游靶点也是激活WNT信号通路的因子之一。
这种反馈并不都是正反馈,也会存在负反馈。例如RhoA可使HDAC1上调,而HDAC1抑制RhoA信号通路;MAPK信号通路中,HDAC6激活该信号通路,但MAPK的一些修饰后产物则会减少HDAC6的数量。但有其他研究得出了相反的结论,认为MAPK激活HDAC6,而HDAC6的下调有利于MAPK的活化。
组蛋白修饰的反馈调节不止作用于引起其改变的信号通路还可以作用于其他的信号通路。例如,在肝细胞癌中FAK过表达,这种过表达会引起Ezh2表达水平升高。Ezh2过表达则会激活WNT信号通路。再比如,YAP通路联合H3K4甲基转移酶MLL1将细胞锁定在增殖和再生状态,使他们易于发生肿瘤。而H3K4me3还会激活WNT信号通路,进一步促进了癌症的进展。
作者还提到同样的组蛋白修饰对不同的力学信号通路也有不同的作用结果。例如H3K9me2表达水平降低有利于WNT信号通路的激活,但不利于YAP及MAPK信号通路的激活。有一些病理过程本身就是一个反馈回路,例如在病理性纤维化中成纤维细胞激活既是细胞外基质硬化的结果也是原因,似乎也可以理解为组蛋白修饰和力学信号通路形成反馈调节宏观表现。在细胞分化的过程中,同一基因在不同阶段会表现出不同的表达水平,疾病发展过程中也会出现暂时好转的临床表现,这都提示力学信号通路和组蛋白修饰并非是单向调节的稳定过程,而是通过形成的反馈调节环处于相互调节的动态变化中。
当某一力学信号通路被激活或抑制时,都会产生其下游相应的组蛋白修饰发生改变,组蛋白修饰不但产生其自身的生物学效应还会反馈调节该力学信号通路甚至其他的信号通路。这种反馈调节可以是正反馈也可以是负反馈,将力学信号通路所形成的调节网络变得更加复杂。
二、力学信号通路和组蛋白修饰形成的反馈环路在临床中的应用价值
力学信号通路和组蛋白修饰在人类癌症中的异常活动表明,信号通路中的每个组分,每一种激酶,上游及下游的效应因子,以及信号通路与组蛋白修饰之间的相互作用都可能成为癌症治疗的靶点。
首先在临床中,以信号通路为靶点的治疗已经有很多。FAK通过作用于癌细胞以及肿瘤微环境的基质细胞,促进肿瘤的进展和转移[6]。除了癌症,FAK抑制还会产生限制水肿和炎症等临床益处[7]。FAK对血管通透性的影响还有助于克服患者对于化疗药物的耐药性。对于RhoA信号通路,抑制RhoA-ROCK信号已成为治疗中枢神经系统疾病的一种有前途的方法。目前有很多ROCK抑制剂可用,例如法舒地尔、Y-27632、利帕舒地尔、羟法舒地尔、尼他地尔、H-1152、KD-025和AMA-0076。针对MAPK信号通路的各种组分的抑制剂如RAF265(Raf抑制剂)、PD325901和ADZ6244(MEK1/2特异性抑制剂)以及FTI和SCH-66336(Ras抑制剂)等也在治疗癌症方面表现出巨大潜力。分子靶向药物达拉菲尼也通过靶向抑制MAPK通路在治疗黑色素瘤方面发挥着重要作用。而针对Hippo信号通路,最明显的分子靶点就是YAP/TAZ和TEAD转录因子,以及它们之间的相互作用,在肺、心脏、肝脏和肾脏等脏器纤维化的病理改变以及癌症中十分重要。WNT/β-catenin通路的异常激活也会导致肿瘤的恶化和转移。对WNT/β-catenin通路的靶向抑制,还可以降低肿瘤干细胞的自我更新能力。研究证明WNT/β-catenin通路的抑制剂氯硝胺表现出了靶向卵巢肿瘤干细胞的抗肿瘤特性。XAV939抑制β-catenin信号转导,抑制头颈部鳞状细胞癌的进展。类似的还有WNT抑制剂WNT-C59 (C59)和IC-2,分别控制着鼻咽癌和肝细胞癌的进展。
目前已经有很多文章从多个方面对以上信号通路的靶向治疗进行了阐述说明,但更重要的是,利用组蛋白修饰与信号通路间的密切联系,协同抗肿瘤提高治疗效果,使患者有更多的选择。目前也已经有部分的靶向治疗是通过靶向组蛋白修饰来间接改变信号通路。例如,HDAC抑制剂HTPB通过抑制整合素-FAK-RhoA信号通路延缓了肺癌细胞的生长并诱导细胞周期阻滞从而实现肿瘤细胞的凋亡。值得注意的是,靶向组蛋白修饰不但可以直接影响信号通路,还可以稳定其他抑制剂的效果协同调节信号通路。正如H3K27me3水平升高可以提高机体对顺铂敏感性一样,组蛋白修饰也可以提高人体对于靶向信号通路的诸多药物的敏感性减少耐药性。
组蛋白修饰与信号通路的异常几乎促进了疾病发生发展的每一个阶段。信号通路之间以及通路与组蛋白修饰间的交流使其作用复杂化。但也正因为二者相互关联,为疾病的治疗和研究提供了更多的思路。
在这篇综述中,作者强调了组蛋白修饰作为力学信号通路的分子水平上的调节因子,如何通过与力学信号通路交织影响了细胞命运以及疾病的发生发展。即组蛋白修饰可以作为机械信号通路的下游对转录因子和基因的表达作出直接调节,也可以作为机械刺激的传感器,反馈调节信号通路的激活或抑制。
力学信号通路和表观遗传学的改变可以和肿瘤标志物一样成为辅助诊断的一项内容。虽然不能依此而确诊,但可以作为一种提示,以便复查和监测。同样,力学信号和表观遗传学的改变也可以作为预测预后的潜在标志物,监测患者的复发情况以及评价治疗效果。
然而,尽管有许多研究可以证实我们的猜想,仍有一些悬而未决的问题仍未得到解答。当细胞感受力学刺激或发生病理改变时,组蛋白修饰对信号通路的调节是主要的控制因素还是只发挥协同作用?当一种信号通路受到多种组蛋白修饰的调节时,又如何平衡?既然力学信号通路和表观遗传学存在反馈调节环,那么是否可以通过控制二者的关系使一些病理过程可逆?力学信号通路中的各种效应因子以及多种影响力学信号通路的分子间的确切联系也未彻底研究清楚。
尽管存在需要问题需要进一步探索,但力学信号通路和组蛋白修饰对于诊断,治疗及预测预后仍有很大的价值和潜力。