人类白细胞抗原(human leucocyte antigen, HLA)即人源主要组织相容性复合体(major histocompatibility complex, MHC),在整个人群中的分布是高度多态性的。HLA呈递外来抗原或自身异常蛋白产生的抗原激活T细胞是人体免疫的重要防线。由HIV引起的艾滋病是研究HLA参与T细胞免疫的经典模型。在被HIV感染的人群中,有不到1%的人可长期自发将病毒控制在极低水平,被称为“精英控制者”。全基因组关联性分析[1]和免疫学[2]及病毒学[3]研究表明,“精英控制者”与特定的人源HLA,即保护型HLA(如HLA-B*57/5801)限制的T细胞免疫有强关联性。然而,保护型HLA是如何决定“精英控制者”的T细胞免疫,其分子机制尚不清楚。
该团队以被认为最具保护力的HLA-B*5701(简称B57)和非保护型HLA-B*5301(简称B53)为研究对象,通过生物化学、细胞免疫学、病毒学以及结构生物学等方法,获得两个HLAs呈递HIV同一抗原表位(QW9)及其逃逸突变体(QW9_S3T)的结构特征,并探索了两个HLAs限定的T细胞受体(TCR)对病毒突变体免疫应答的差异性的分子机制。该研究表明不同的HLA限制性的TCR在交叉识别抗原突变体上存在显著差异,对基于T细胞相关的免疫治疗、疫苗设计具有重要意义。

作者首先利用荧光标记的结合抗原肽QW9的B53和B57的四聚体,分别从含有B57和B53的HIV感染群体中各选出5个可以识别该抗原肽QW9的参与者,并发现不同HLA限制性的T细胞只能识别相应HLA呈递的QW9(图1b,c)。随后,作者利用相应HLA四聚体分选出两组T细胞克隆,并进行细胞扩增和细胞裂解实验。两项实验均表明,保护型B57呈递抗原QW9所限制的T细胞可以更好地交叉应答QW9的突变体,QW9_S3T(图1d-f)。
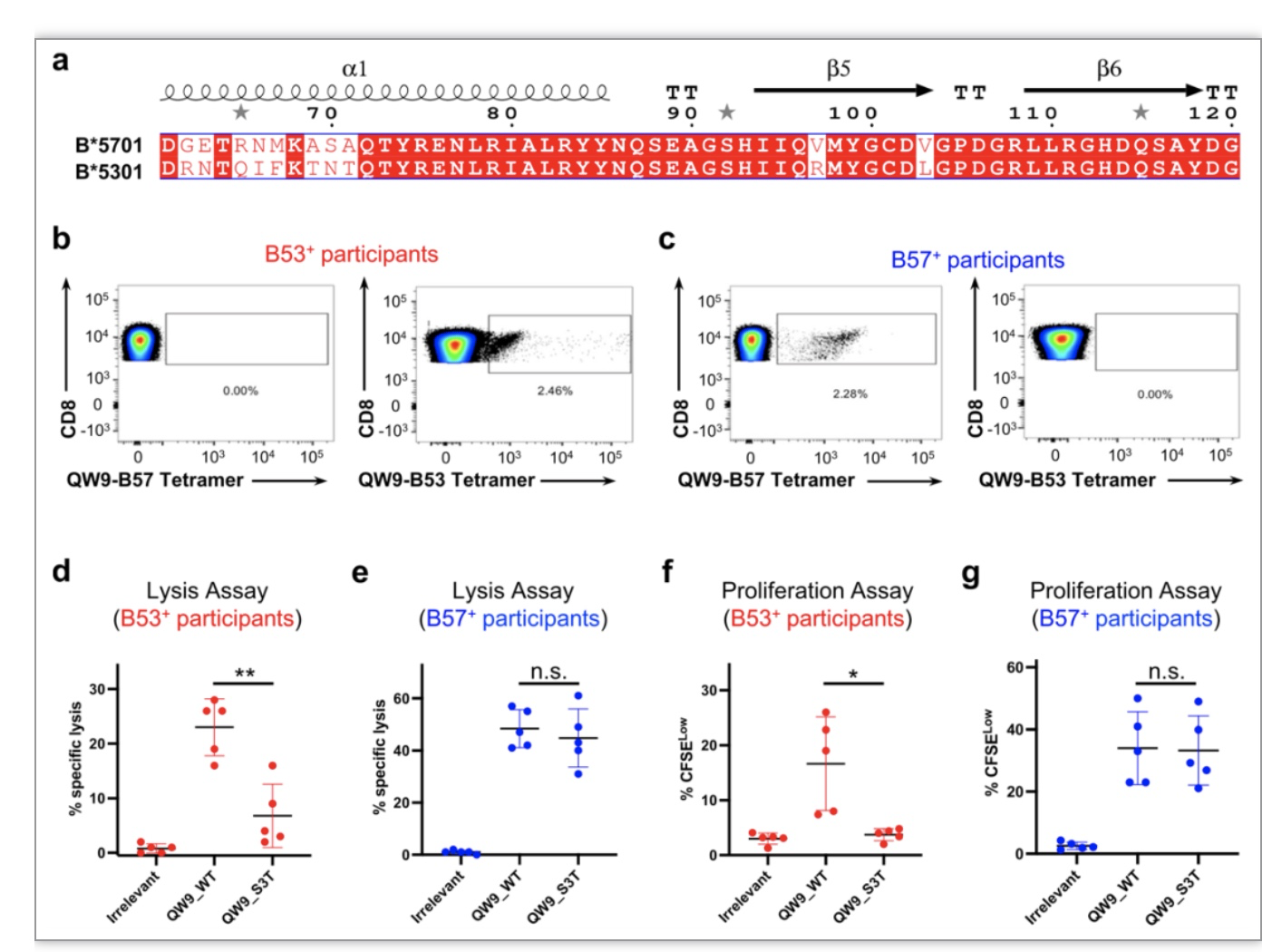
图1. B57 和B53限制性T细胞免疫应答HIV抗原肽及其突变体的差异。a. B57与B53序列比对;b. 四聚体染色;d-e. T细胞裂解实验;f-g. T细胞扩增实验。
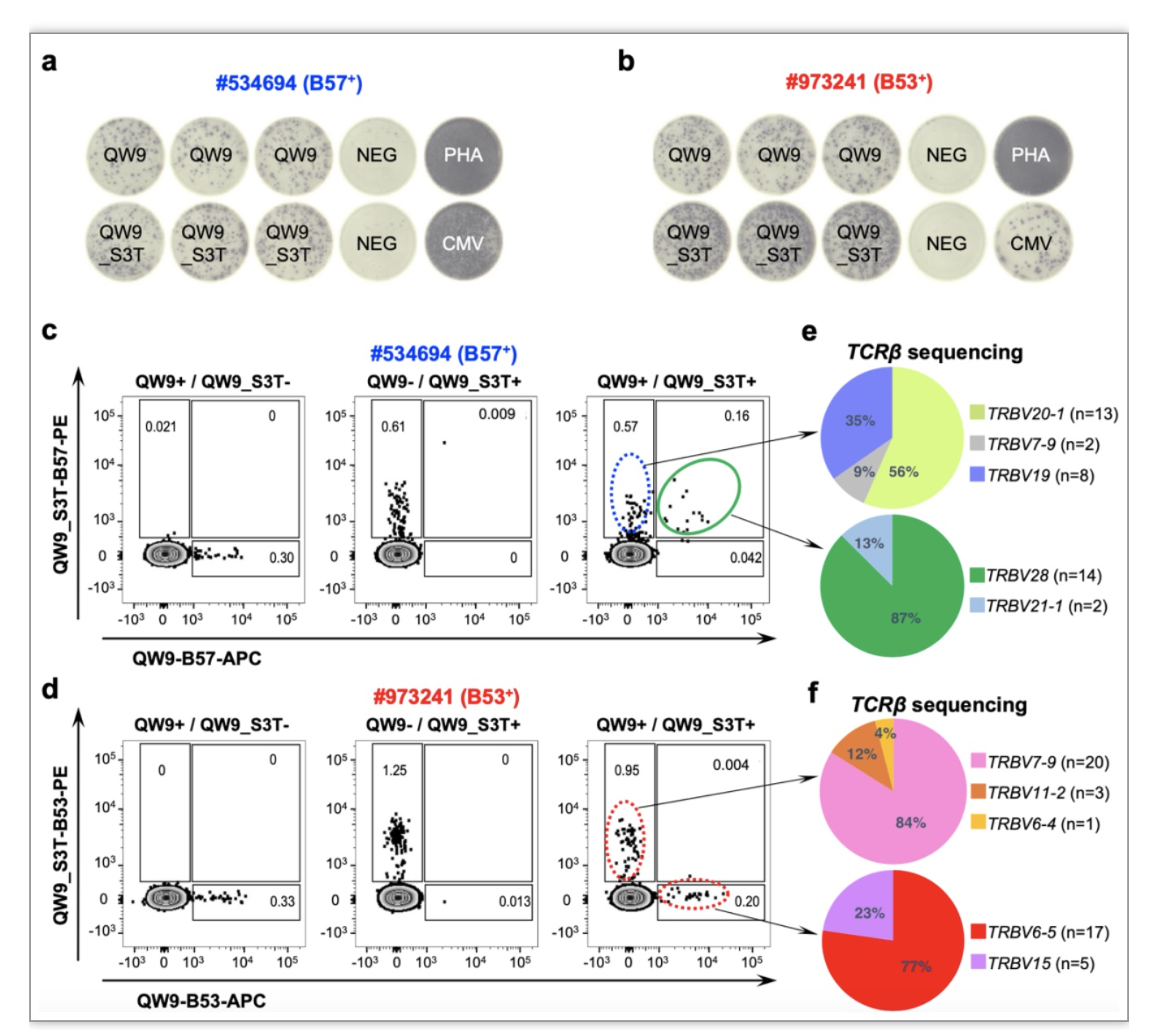
图2. B57 和B53限制性T细胞免疫交叉识别HIV抗原肽突变体的差异。a,b IFN-γ EliSpot实验。 c,d 四聚体染色实验。e,f 单细胞TCR测序。
为了进一步揭示B57和B53限制的T细胞应答QW9突变体的差异性,作者先通过ex vivo IFN-γ Elispot实验筛选出对QW9和QW9_S3T均有免疫反应的PBMC样品(图2a,b),并通过QW9-B57、QW9_S3T-B57四聚体以及QW9-B53、QW9_S3T-B53四聚体,对含有相应HLA的PBMC样品进行单四聚体染色和双四聚体染色。单染色结果与Elispot实验结果一致,两组PBMC均含有对野生型QW9和突变型QW9_S3T应答的CD8 T细胞。令人惊讶的是,双染色实验显示含有B57的个体PMBC中,存在同时识别QW9-B57和QW9_S3T-B57的T细胞群(图2c),而在含有B53的个体PMBC中,只存在分别识别QW9-B53和QW9_S3T-B53的T细胞群(图2d)。随后,作者分别对四聚体染色分选出的T细胞受体进行测序,发现各细胞群表达的TCRs是互不相同的(图2e,f)。
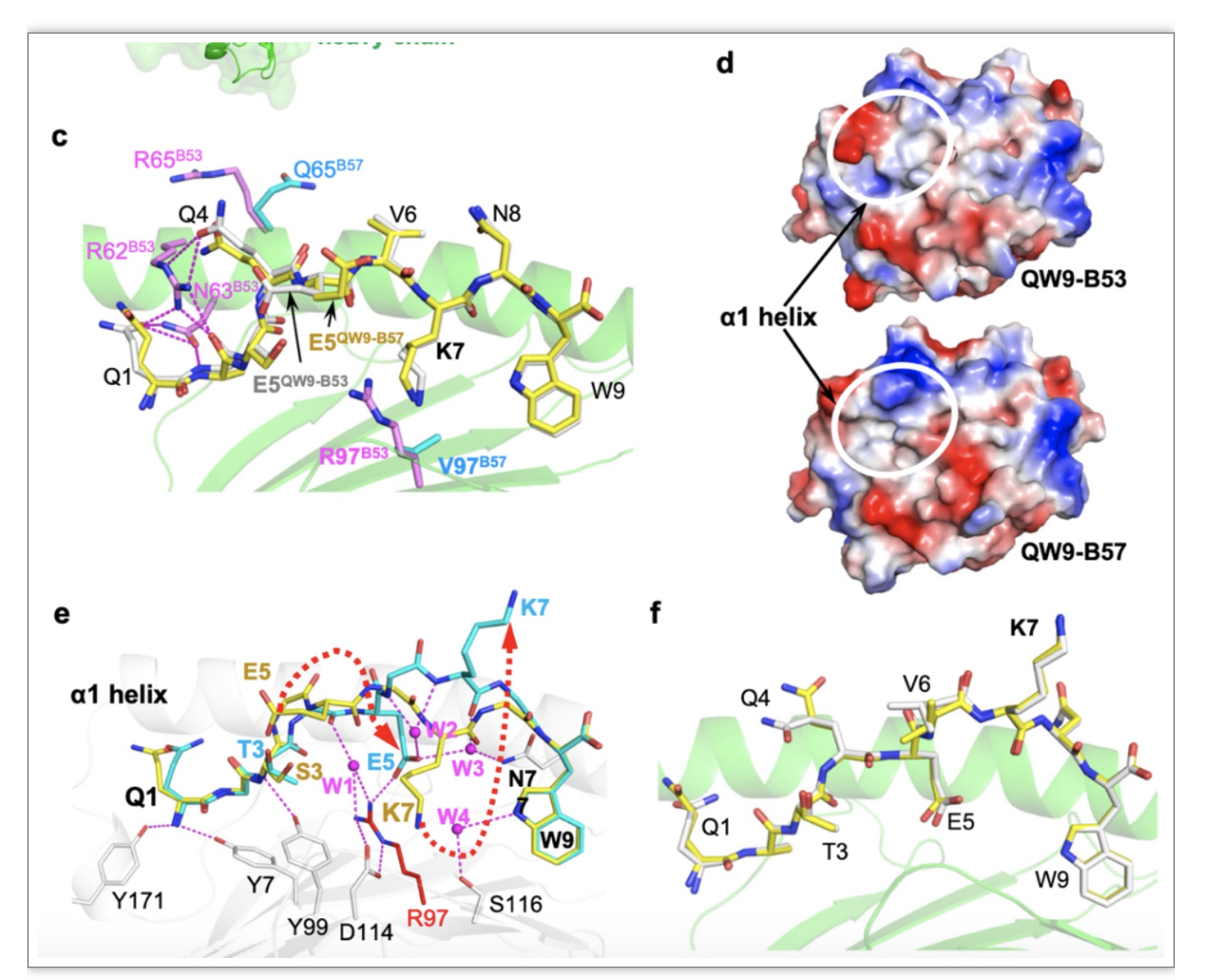
图3. B57 和B53呈递HIV抗原肽QW9及其突变体QW9_S3T的结构特征。c. QW9-B57和QW9-B53的结构叠合比较。 d. B57与B53抗原沟槽界面表面电势分布比较。e. S3T突变诱导抗原肽构象变化的过程。f. QW9_S3T- B57和QW9_S3T- B53的结构叠合比较。
为理解这两类HLA限制性T细胞识别QW9及其突变体差异性的分子机制,作者首先解析了高分辨率的QW9-B53、QW9_S3T-B53、QW9-B57、QW9_S3T-B57的晶体结构。 整体上,B57和B53两个结构的主要差异存在于HLA alpha-1螺旋上(图1a, 图2d)。进一步结构分析发现,野生型QW9以相同的构象结合于B57和B53抗原结合沟槽中(图 3c),QW9_S3T同样以相同的构象结合于B57和B53抗原结合沟槽中(图 4f)。然而,单一氨基酸S3T的突变足以使得抗原肽在两个HLAs的沟槽中均发生了显著的构象变化(图 3e)。这种构象变化,可能是QW9-B53特异性T细胞不能识别QW9_S3T突变体的机制。为验证该假设,作者鉴定出识别QW9-B53的T细胞克隆C3。 并成功对C3 TCR进行测序和高纯度蛋白样品制备。蛋白-蛋白相互作用实验显示,C3 TCR可以高效结合QW9-B53(图 4d,e),但对QW9_S3T-B53则是极弱的结合或无相互作用(图 4d,f)。

图4. C3 TCR与 peptide-B53的相互作用。d.静态SPR测定。e-f. 动态SPR测定。
同时,作者通过对C3 TCR以及C3 TCR与QW9-B53复合物进行结构测定与分析,发现在C3 TCR结合QW9-B53前后: 1)C3 TCR抗原决定簇具有一定程度的刚性,形成复合物时没有发生显著的构象变化(图4a-d);2)QW9在B53沟槽中的构象在形成复合物前后也没有发生显著变化(图 4g)。因而,S3T突变引发的抗原构象变化,会破坏C3 TCR在B53表面的对接,导致免疫逃逸。然而,B57限制性TCR是如何交叉识别构象变化的抗原肽来控制突变逃逸,其结构基础尚待进一步研究。基于B57与B53的序列及结构差异(图 1a, 图3d),作者推测alpha-1螺旋的关键氨基酸对TCR对接模式的选择,可能是B57限制性TCR交叉识别的重要因素。未来B57限制性TCR与QW9-B57及TCR与QW9_S3T-B57复合物结构的解析,将有助于揭示保护型HLA限制性TCR交叉识别抗原突变的分子机制。
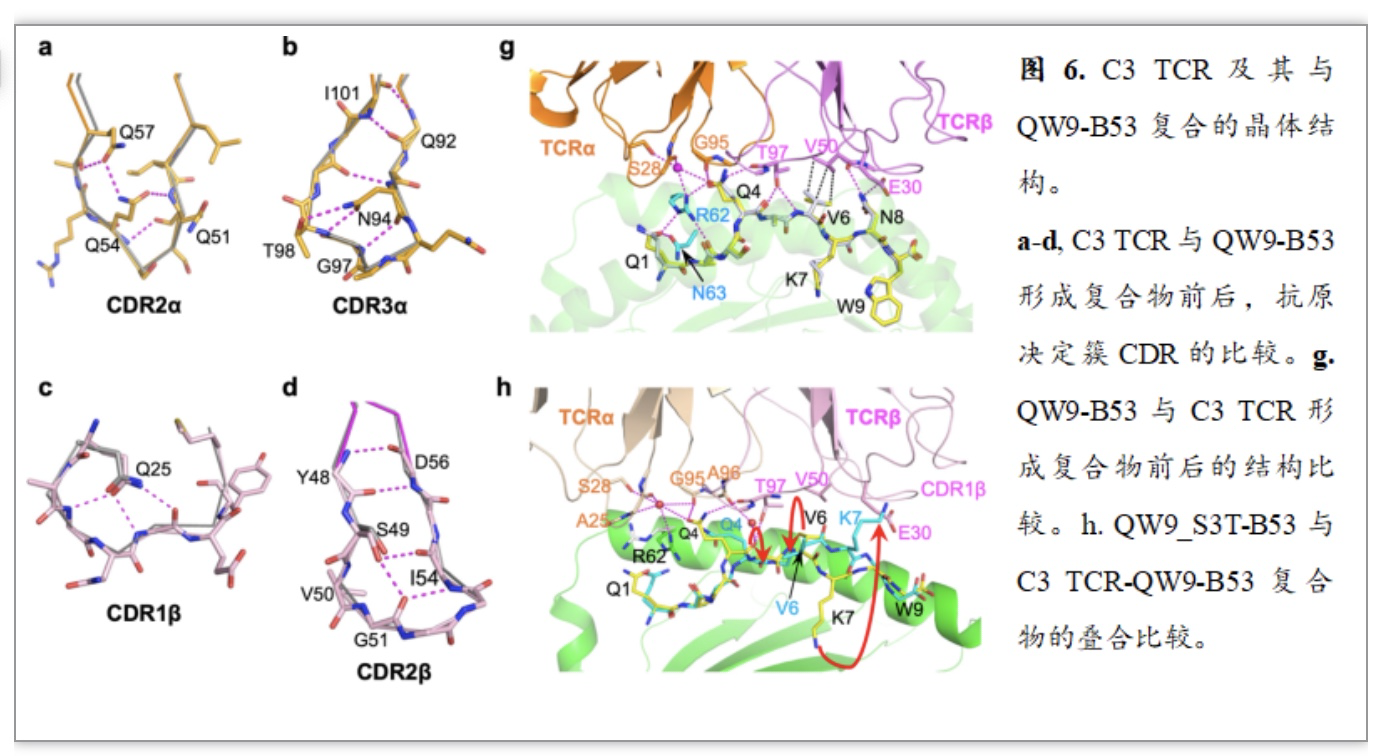
图5. C3 TCR及其与QW9-B53复合的晶体结构。a-d, C3 TCR与QW9-B53形成复合物前后,抗原决定簇CDR的比较。g. QW9-B53与C3 TCR形成复合物前后的结构比较。h. QW9_S3T-B53与C3 TCR-QW9-B53复合物的叠合比较。
此外,HLA呈递抗原的稳定性最近被认为是决定T细胞交叉识别的重要因素[4,5]。为验证该假设对该研究中T细胞识别差异性的影响,作者最后比较了QW9与QW9_S3T结合在B57和B53的热稳定性,并发现野生QW9结合于B57与B53的热稳定性相近(图6f)。然而,S3T突变显著影响QW9_S3T在B53中的热稳定(图6 a),而对B57呈递该抗原则无显著影响(图6b)。基于结构分析,HLA第70位的氨基酸对抗原氨基酸侧链在HLA抗原沟槽内堆积的局部环境产生影响(图6c-e),并通过突变试验证实该位氨基酸的重要性(图6f)。然而,在本研究中弱稳定性的QW9_S3T-B53同样可以高效选择产生其对应的特异性T细胞亚群(图2d),表明突变体引发的热稳定性变化,在该研究中并非T细胞识别差异的决定因素,而TCR的独特对接/识别模式才更可能是交叉识别的机制。
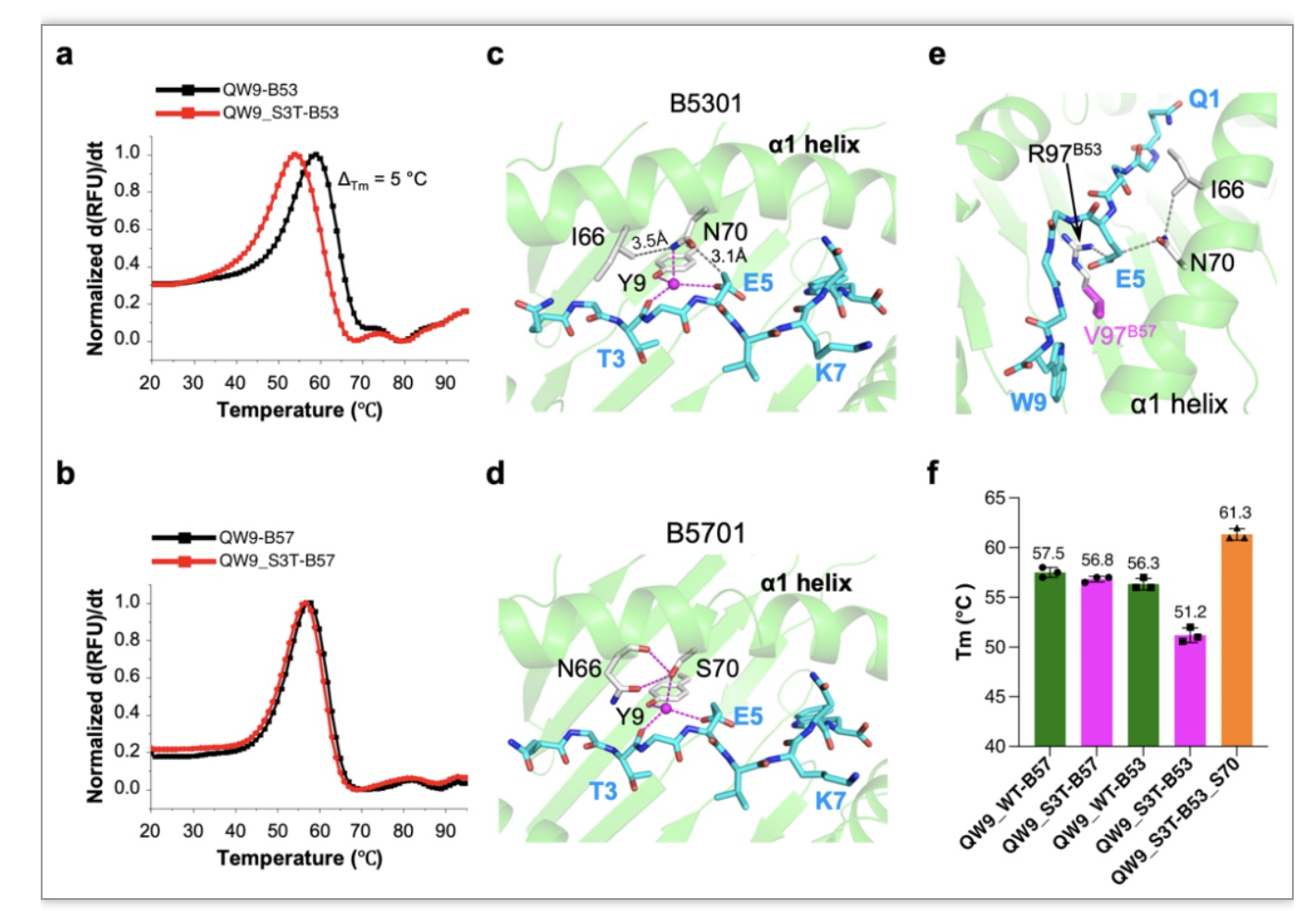
图6. 抗原肽结合HLA的热稳定性分析。a,b 热熔曲线变化,抗原决定簇CDR的比较。 c-e. 影响抗原肽结合的氨基酸分析。f. 不同抗原结合HLA的Tm值比较。
综上所述,该研究综合生化、生物物理、结构、免疫、病毒等交叉学科方法,系统地研究了保护型和非保护型HLA呈递同一抗原表位及其突变体激活免疫效应的差异性。作者发现HLA抗原结合沟槽细微的氨基酸差异,会影响到对同一抗原呈递的稳定性,以及TCR的识别模式。该研究揭示了HLA-B57在抗原呈递的稳定性以及其限制性TCR的交叉识别能力的优越性,是决定其作为保护型HLA的可能分子基础,对于基于T细胞的疫苗或者细胞治疗策略有重要的意义。

