
图2. CD4+TRM在病毒感染后在转录和表观遗传修饰与TH1相似
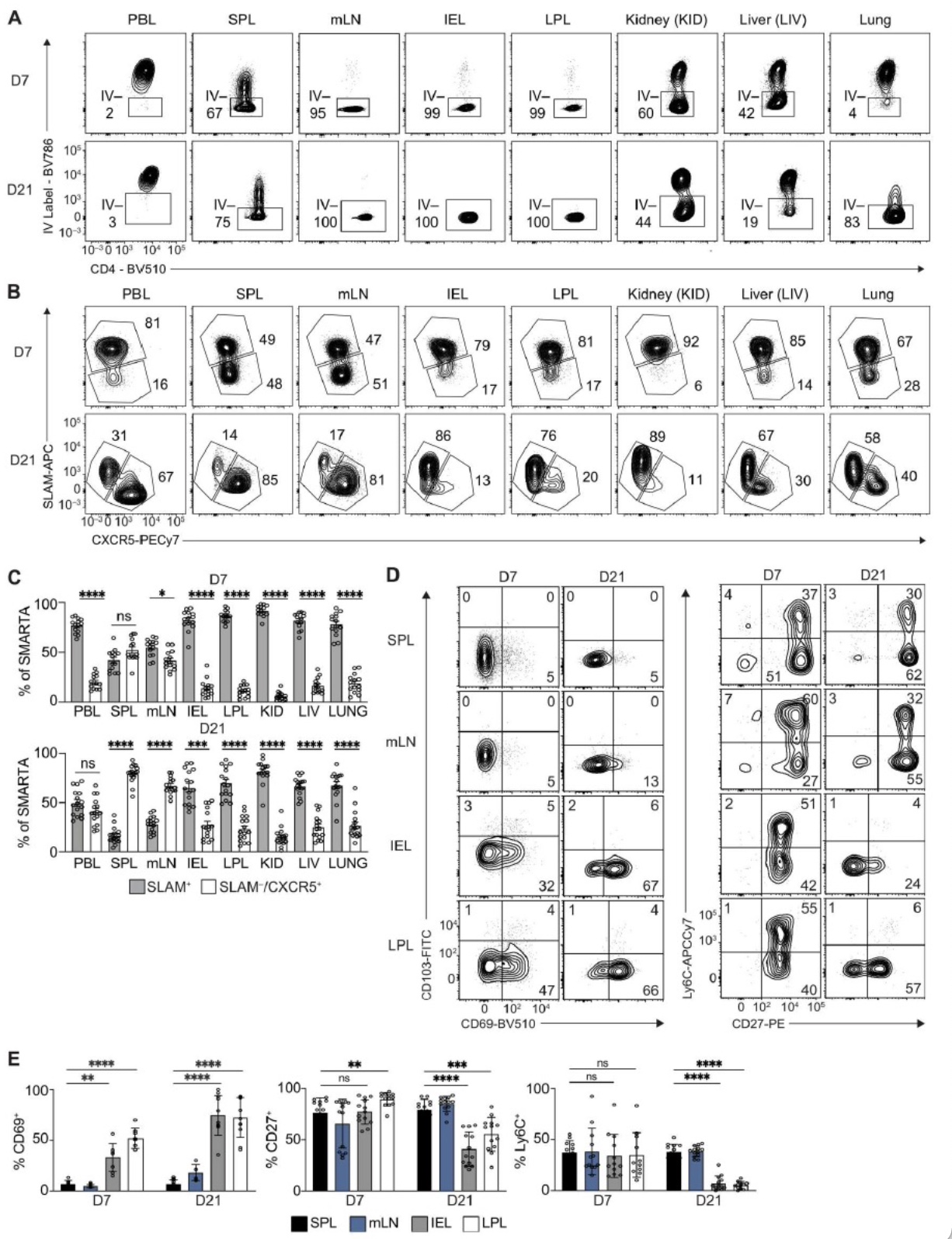
作者进一步探究了循环CD4+T细胞和SI CD4+TRM细胞在感染后的分化和功能。CCR9和CD49a能够介导细胞肠道归巢,分析发现在IEL和LPL中CCR9+CD49d+CD4+T比例增加,并且SPL中高于80%的CD4+T细胞、mLN中高于90%的CD4+T细胞为SLAM+TH1细胞,说明循环的TH1细胞与SI CD4+TRM之间存在关联性。作者进一步评估了SI CD4+TRM与脾脏效应T细胞亚群的功能差异,在体外用SMARTA CD4+T细胞特异性抗原肽GP61-80刺激后,发现感染早期效应阶段的CD4+T细胞无论在SI还是脾脏中均高表达IFN-γ和TNF-α,而在记忆阶段与脾脏T细胞相比,SI中仅有少量CD4+T细胞表达IFN-γ和TNF-α。与SPL和mLN中CD4+T细胞相比,SI CD4+T细胞在效应和记忆阶段均表达高水平granzyme A 和 B。这些结果进一步强调了SI CD4+TRM与TH1效应细胞之间的相似性。
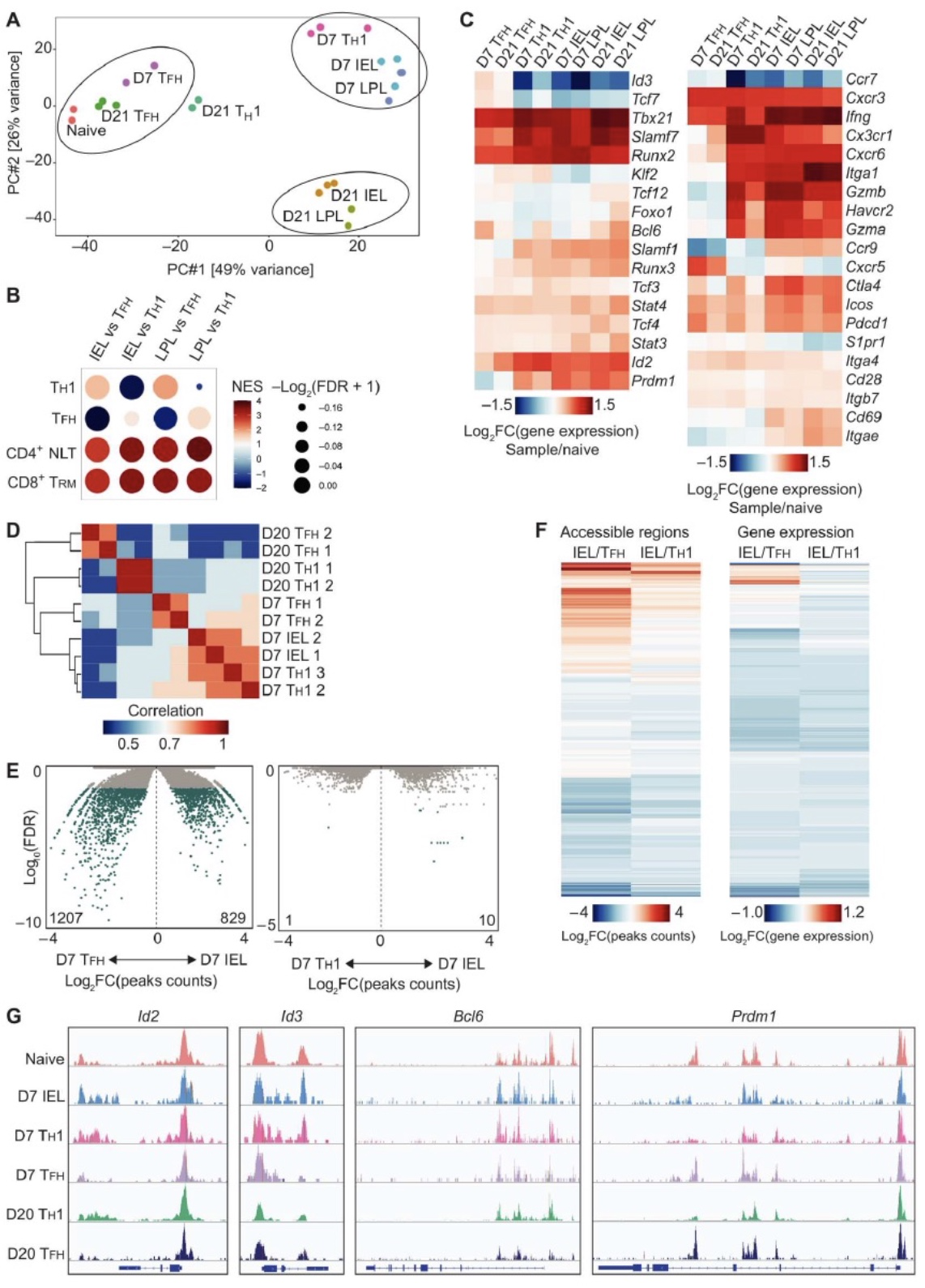
RNA-seq结果显示感染第7天的CD4+TRM细胞获得了记忆CD4+TRM 13-15%的基因表达特征,而CD8+TRM在感染第七天已经获得成熟TRM约57%的基因表达特征,说明CD4+TRM在感染后的成熟动力学过程与CD8+TRM不同。这可能与细胞的组织定位有关,CD8+TRM在感染D21天主要分布在IEL中,而CD4+TRM主要在LP中。因此CD4+TRM的成熟比CD8+TRM需要更长的时间。为了探索效应和记忆 SI CD4+ T细胞亚群之间转录程序的差异,并评估这些群体中细胞的异质性,作者进行了bulk RNA-seq和scRNA-seq。结果显示感染D21天 SPL和LPL样本都具有独立的基因特征,感染D7天的细胞仅表达少量SPL或SI特征基因。TH1记忆细胞特征基因主要在感染D7天和感染D21天SI细胞中表达,而记忆TFH特征基因主要在感染D21天SPL中表达。RNA velocity分析显示感染早期的脾脏CD4+T细胞向IEL和LPL群体逐步发展成成熟TRM群体的过程。综上感染早期SI中T细胞与脾脏T细胞相似,随后逐步分化成组织定居型CD4+T细胞。

图3. 效应CD4+T细胞逐步获得成熟SI TRM程序
为确定CD4+TRM是否存在异质性,作者通过scRNA-seq分析感染第21天 SPL和LP中CD4+T细胞,结果显示LPL簇在记忆性TH1,NLT以及CD8+TRM特征基因均有富集,而SPL仅在记忆TFH特征基因存在富集。分析调控效应T细胞和记忆T细胞转录因子发现,SPL群体存在异质性,既表达效应程序基因也表达记忆程序基因,并且测序结果推测Blimp1、Id2以及Bcl6能够调节CD4+TRM程序,使得CD4+TRM能够长期维持效应和记忆功能。随后作者通过Blimp1-YFP SMARTA CD4+T、Blimp1-KO SMARTA CD4+T、Id2-YFP SAMRTA CD4+T过继回输等实验发现Blimp1和Id2缺失后影响了早期CD4+TRM的分化,减少了SI CD4+TRM的数量。基于TH1和CD4+TRM在表型、转录组、功能方面的相似性,作者推测效应TH1群体中包含CD4+TRM祖细胞,进一步通过过继回输TH1细胞和TFH细胞,证明了TH1细胞会分化成SI TRM,而TFH主要在SPL和mLN中。
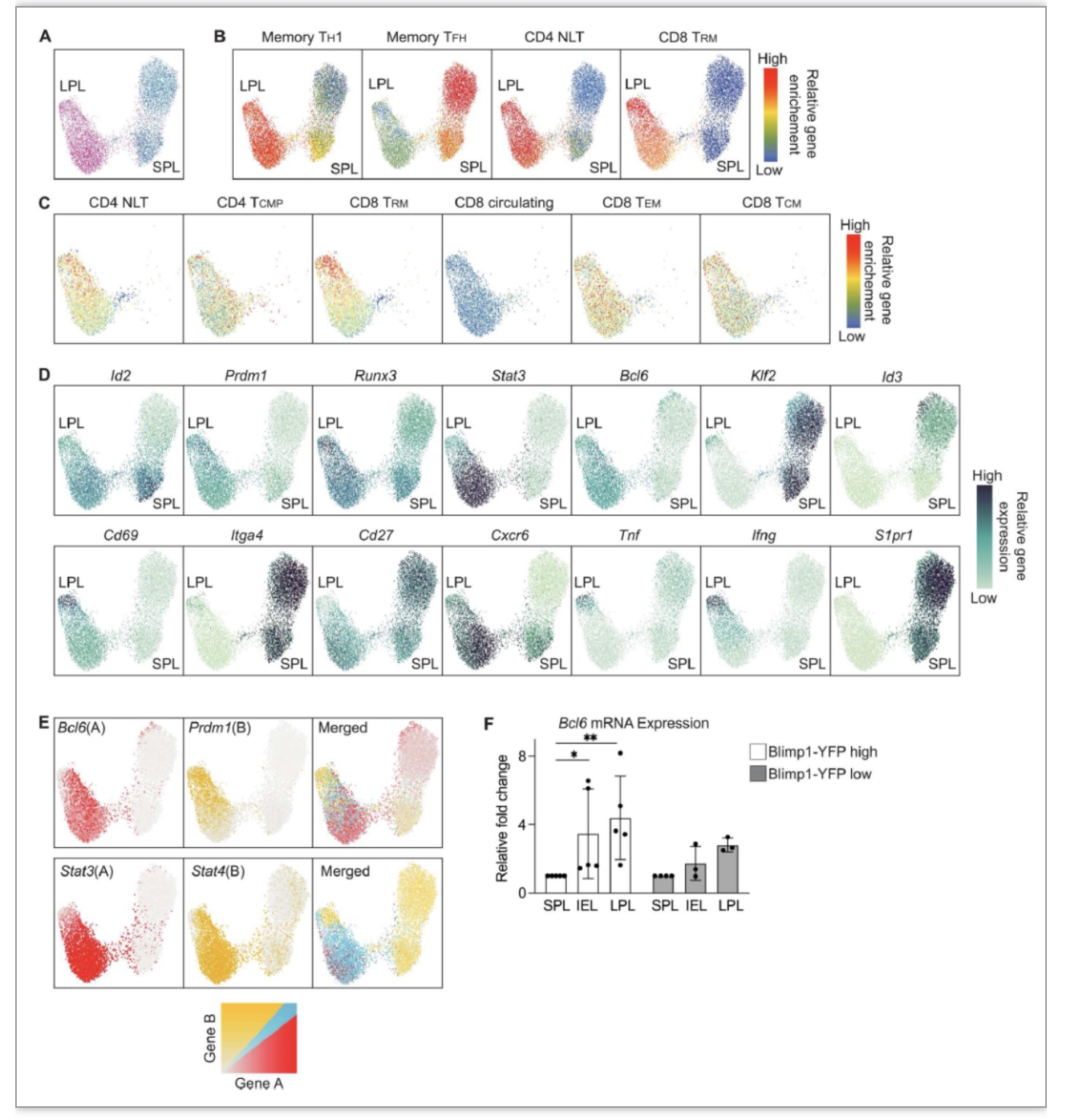
图4. SI CD4+TRM具有异质性,同时表达效应和记忆进程相关基因
Bcl6在记忆阶段SI CD4+TRM中表达,作者进一步探究了Bcl6是否调控CD4+TRM,用Bcl6-KO SMARTA T细胞过继回输实验发现,感染D7天脾脏和淋巴结中CD4+T SMARTA细胞显著减少,并且在记忆阶段细胞减少更加明显。Bcl6的缺失没有影响感染早期CD4+T细胞在SI中的累积,但是在感染第14天和第21天,Bcl6-KO细胞较WT细胞的比例和数量显著减少。通过RNA-seq分析感染早期WT和Bcl6-KO SMARTA CD4+T细胞,发现脾脏中Bcl6-KO细胞与TH1表型相似,SI中感染早期的Bcl6-KO细胞与感染21天WT CD4+T细胞相似。说明Bcl6的缺失促进了效应T细胞向成熟TRM细胞分化的进程。

