临床上有60%左右的胚胎会在围着床阶段(受精后6至14天)出现着床失败或妊娠丢失;此外,我国胎儿出生缺陷率为5.6%。着床失败、妊娠丢失和胎儿出生缺陷,与围着床胚胎的异常发育密切相关,但机制尚不清楚。深入解析人围着床胚胎的发育机制,有助于理解胚胎发育与疾病发生的关系,从而为不育和胎儿出生缺陷的诊疗提供理论依据。近年来,研究人员成功将病人捐赠的体外受精囊胚培养至原肠前阶段[1-4],为理解围着床阶段的胚胎发育事件提供了机会。然而,围着床胚胎的完整细胞图谱尚未绘制、特别是上胚层和下胚层衍化而来的细胞谱系的身份特征和信号调控机制依然不清楚。此外,用人胚胎开展研究受到伦理、数量和技术限制。干细胞来源的胚胎模型,容易开展基因编辑和进行大规模制备,是体外研究人胚胎发育机制的理想模型。然而,当前构建的胚胎模型,不能很好地模拟人围着床胚胎的一些关键组织结构(双胚盘、羊膜腔和卵黄囊)和细胞谱系(胚外内/中胚层、原始生殖细胞和原条)的发育。
为了填补人围着床期发育的知识空白,2023年7月17日,昆明理工大学李天晴、艾宗勇和季维智带领的团队在Cell Research在线发表题为Dissecting peri-implantation development using cultured human embryos and embryo-like assembloids的研究长文。该研究首次绘制了体外培养的人围着床胚胎的完整细胞图谱,并定义了下胚层和上胚层来源的不同细胞谱系及其这些谱系间的互作关系。在此基础上,研究人员首次构建了能高度模拟人围着床发育的胚胎模型,系统揭示了BMP、WNT和Nodal信号通路精确调控人胚胎和胚外谱系的命运决定机制。该研究为深入理解人围着床胚胎的发育机制以及揭示不育和胎儿出生缺陷的致病机理奠定了重要基础。
在课题组之前建立的人胚胎三维(3D)延长培养的基础上(Nature,2020)[4],研究人员首先收集了体外培养的受精后10-14天的人胚胎进行单细胞转录组分析,首次绘制了人围着床胚胎的完整细胞图谱,深入表征了上胚层和下胚层衍生而来的不同细胞谱系的身份、标志基因和信号调控网络(图1),并进一步通过免疫荧光染色验证了胚外内/中胚层的特异性标志物。这些数据填补了人围着床胚胎发育的认知空白,为体外建立的胚胎模型、以及胚胎和胚外细胞谱系的鉴定提供了参考。
图1 人着床胚胎的发育图谱
为了建立能够模拟人围着床发育的胚胎模型,研究人员首次开发了一种能够在常氧下维持的人原始态(naive)胚胎干细胞。通过将滋养层干细胞(hTSCs)或滋养外胚层样细胞(nTEs)与原始态胚胎干细胞进行组装,意外的是,hTSCs或nTEs都不能有效包裹原始态胚胎干细胞,而是形成8字型结构,不能模拟真实胚胎的形态结构特征。为此,研究人员进一步开发了一种信号巢细胞,这种细胞类似人的胚外组织,表达BMP和WNT信号配体。有趣的是,通过将信号巢细胞和原始态胚胎干细胞进行组装,信号巢细胞能够高效(>90%)包裹人原始态胚胎干细胞,组装形成人工合成胚胎。
在延长培养过程中,人工合成胚胎能够发育产生上胚层、胚外中胚层、羊膜和原条等胚胎和胚外组织,但不能形成胚外内胚层。为此,研究人员利用3D培养的人胚胎和人工合成胚胎,采用化学调控和基因编辑等操作,系统揭示了人围着床胚胎下胚层和上胚层衍化而来的细胞谱系的转录特征,以及BMP、WNT和Nodal信号通路精确调控人胚胎和胚外细胞谱系(上胚层、胚外内/中胚层、羊膜和原条)的命运决定机制(图2)。
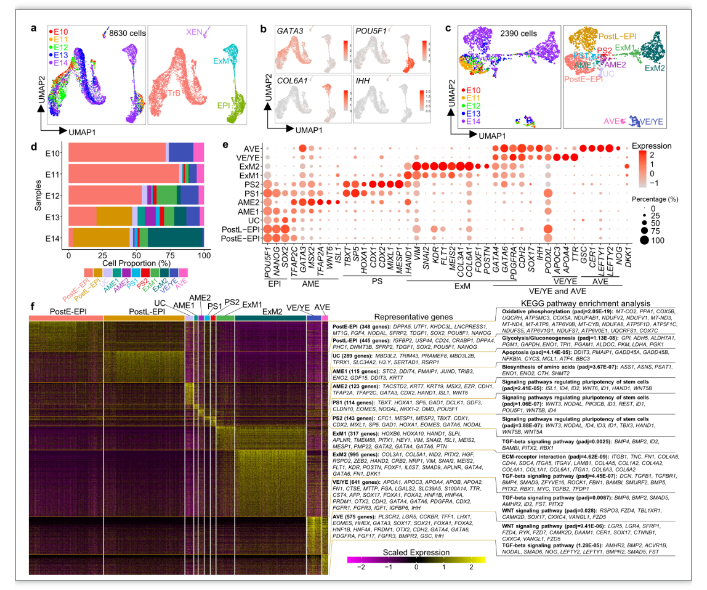
图2 人围着床胚胎谱系发育的信号调控机制
最后,研究团队基于不同信号通路对特定细胞谱系特化的调控原理,开发了一个新的“三步”延长培养系统,克服了人工合成胚胎不能特化产生胚外内胚层的缺陷,使80%以上的人工合成胚胎生长到对应人14天胚胎的发育阶段,成功再现了双胚盘、羊膜腔(ACLS)和卵黄囊(YSLS)的三维结构,以及上胚层(EPILCs)、胚外内/中胚层(VE/YELCs、AVELCs和ExMLCs)、羊膜(AMELCs)、原条(PSLCs)和原始生殖细胞(PGCLCs)等胚胎和胚外细胞谱系的分子特征(图3)。

图3 人工合成胚胎的流程图以及明场、染色和模式图
值得注意的是,同一时期国际上其他四个团队也在预印本bioRxiv和Nature杂志上发表了人围着床胚胎模型的工作。其中,三项工作(来自英国剑桥大学的Magdalena Zernicka-Goetz团队、美国耶鲁大学的Berna Sozen团队和美国匹兹堡大学的Mo R. Ebrahimkhani团队)获得的胚胎模型缺乏典型的双胚盘、羊膜腔和卵黄囊结构;来自以色列魏茨曼科学研究所Jacob H. Hanna团队建立的胚胎模型具有典型的双胚盘、羊膜腔和卵黄囊结构,但效率极低(2.9%)。相比之下,本研究的胚胎模型发育效率超过80%,为人早期胚胎发育研究、药物研发和毒理测试提供了重要的研究和筛选平台。

