研究背景
肥胖对人类的生活质量和现代医疗保健系统构成了重大威胁。肥胖的代谢危险因素与脂肪分布的关系比与总脂肪量的关系更密切,这可能是由于解剖学上不同的脂肪组织(AT)对能量平衡和营养稳态的贡献存在实质性差异,以及不同部位脂肪组织在肥胖发展过程中扩张的机制存在差异。表现出内脏AT(VAT)优先扩张的肥胖个体比将多余能量储存在皮下AT(SAT) 的肥胖个体患糖尿病和心血管疾病的风险更高。三维染色质结构是转录调控的基本调控因素,并以多尺度层次组织,包括染色体区域、区室、拓扑关联域(TADs)、染色质环以及启动子和增强子之间的长期相互作用(PEI)。之前的研究突出了染色质组织在脂肪形成中的重要调节作用。然而并不能说明脂肪组织转录组差异与染色质结构动态变化的关联机制,这些变化可能与肥胖发展和饮食干预中的进行性代谢风险有关。
研究方法
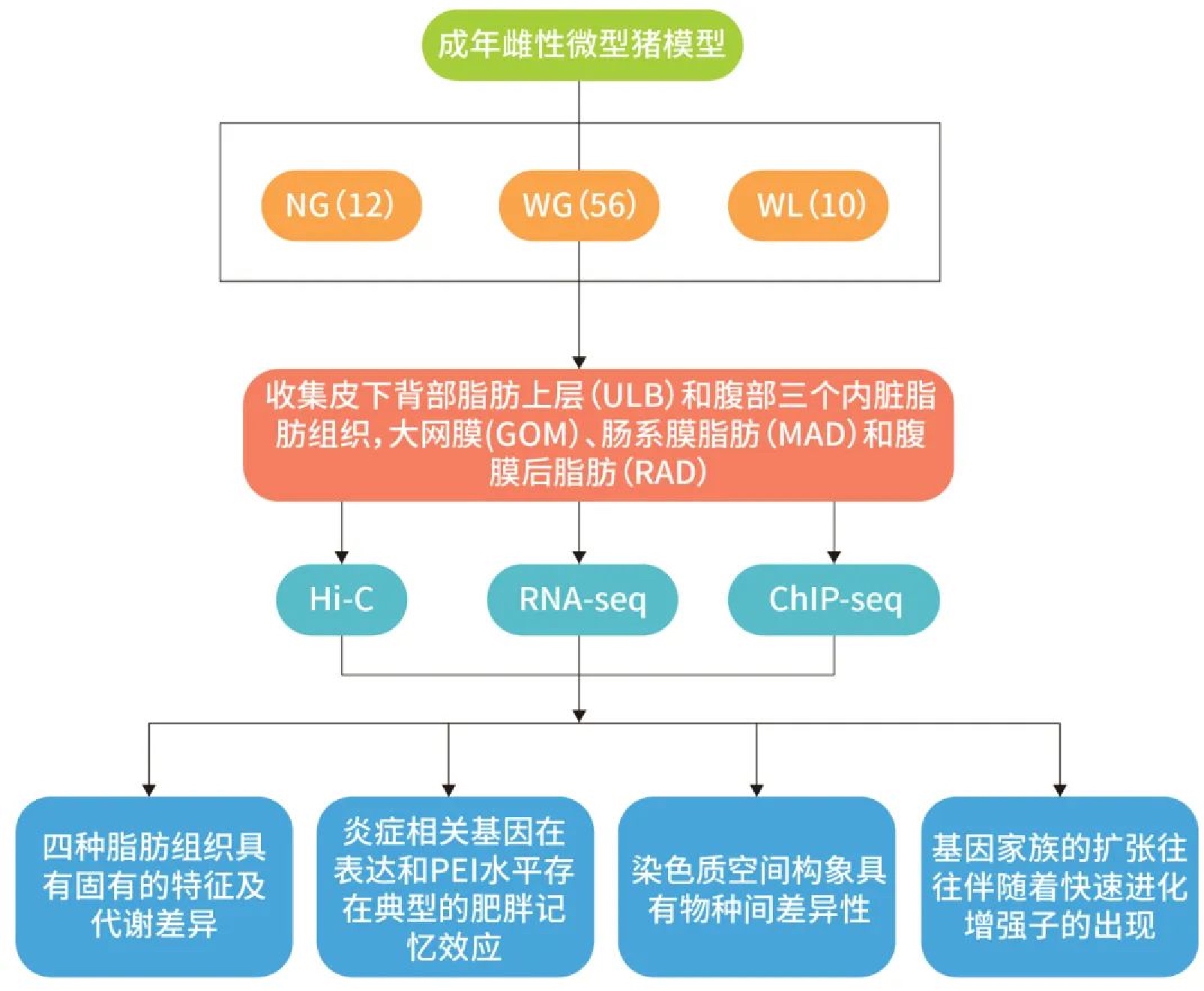
作者采样自68头成年母猪,其中12头正常喂养组,46头增重喂养组(增重1.94倍),10头减重喂养组(减重32.28%)。每头针对四个解剖学部位采集脂肪组织(包括背部皮下脂肪[ULB]、大网膜脂肪[GOM]、肠系膜脂肪[MAD]和腹膜后脂肪[RAD]),利用Hi-C技术大规模构建了249个脂肪样品的高分辨率染色质互作图谱,联合RNA-seq和ChIP-seq多组学技术,对染色质结构的多尺度重组及其对基因表达的影响进行综合分析。此外,作者还全面比较了人类和猪基因组中四个同源脂肪组织的互作模式,以表征其空间调控网络的进化分歧,并确定空间重新连接如何影响物种特异性脂肪生长调控,为未来人类和猪的比较代谢研究提供了重要的资源。
研究思路
研究结果
不同的脂肪组织中转录组和染色质结构在增重和减重期间发生改变
作者将68头成年母猪,分为三个营养组:正常组(NC,n=12)正常喂食22周;体重增加组(WG,n=46)高脂肪喂食22周;体重减少组(WL,n=10 ) 高脂肪喂食22周后改为仅摄入正常组热量的10%,再持续12周。结果显示,WG组与正常组相比体重增加了1.94倍。WL组与WG组相比,体重平均下降了32.28%。
作者收集一个背部皮下脂肪组织ULB(SAT)和三个腹部内脏脂肪组织(VATs),即大网膜脂肪(GOM)、肠系膜脂肪(MAD)和腹膜后脂肪(RAD),与皮下ULB脂肪细胞相比,NC组和WG组的三个VAT脂肪细胞的肥大程度更高。相反,WL组中VAT脂肪细胞体积萎缩程度更大,证明VAT比SAT具有更高可塑性。
作者对AT样本进行转录组以及Hi-C分析,过量和不足的热量摄入都可以重塑AT的染色质结构和转录模式。
接下来,作者通过差异基因在四种脂肪组织的表达以及功能富集研究了内脏RAD与SAT的代谢特征,发现四种脂肪组织具有固有的特征及代谢差异。
各脂肪组织间染色质区室和TAD边界的动态变化
接着作者通过进一步研究基因在A/B compartment和TAD边界的表达特征,在不同的营养状态下基因在各脂肪组织染色质区室以及TAD边界中的表达具有差异。例如,促炎基因TCF21在GOMs中特定TAD边界的消失使TCF21在GOMs中表达量大幅增加。各脂肪组织染色质结构的潜在差异引起了基因的差异表达。
不同营养状态下四种脂肪组织中染色质互作的重新配置和相关基因的转录对体重变化的影响
作者使用PSYCHIC算法分析了5kb分辨率的全基因组互作图谱,对四类脂肪组织在3种营养条件下的染色质互作研究发现,染色质互作重排有助于促进转录分化(图6a-b)。然后针对每个启动子进行调控潜力评分(RPS),并通过分析H3K27ac的分布特征,进一步度量了增强子的活性。鉴定出170个RPS与表达共变的基因。进行功能富集分析发现,一些腹部脂肪组织特异的基因与促炎和免疫反应密切相关。并且,在体重增加期间RPS和表达一致增强的23个已知炎症基因中15个存在“肥胖记忆效应”,即在体重减轻后RPS和表达持续升高。
哺乳动物脂肪组织局部空间区域同源基因的分化
接着作者使用29个原位Hi-C数据集和与其相应的RNA-seq数据集对七种哺乳动物的皮下脂肪组织局部空间区域的互作环境进化模式进行了比较分析。使用人类基因组作为参考,在人类基因组中鉴定了7种哺乳动物的949.94 Mb(或30.65%)的同源区域。结果显示,进化上更接近的物种在基因表达模式和局部空间环境方面具有更大的相似性(图7a-c)。然后采用Phylo-HMGP算法鉴定了在人类基因组中随着局部相互作用增加可接近性增加的大约20Mb区域,发现这些区域明显富集Alu元件。与其他非保守区域相比,这些人类特异性高IS区域包含14个转录因子结合基序(包括SREBF-1和-2,TCF-3和-4,HEY2和NFKB2等)。特别是SREBF-1和-2的识别motifs,这两个基因与胆固醇摄取和生物合成以及与长期能量储存密切相关,在人类特异性高IS区域显示出富集,而在其他非保守区域则不存在。
这一研究结果表明,局部空间区域的物种特异性变化与独特的TF结合位点等顺式调控元件之间存在联系。
人类和猪脂肪组织同源区域增强子调控模块比较
接下来,作者通过系统地评估正常情况下人类和猪基因组在四个AT之间染色质互作的差异,研究了基因在猪中的调控靶点的生物学意义效应是否可以外推到人类。通过研究三个人类SAT样本的公开Hi-C和RNA-seq数据发现,保守序列占了较高的比例(图8d)。例如,脂肪生成相关转录因子CEBPB和PPARG、稳态调节因子IGFBP5、炎症信号因子IL6ST 以及脂肪量扩张期间氧气和营养物质交换的介质VEGFA,这些基因在人类脂肪组织基因组中都有超过20个增强子,其中大部分在人类与猪之间的无论是在功能还是序列上都是保守的。
结果证明在决定肥胖表型的调控通路中存在进化上的相似性,并且这些通路可能包含一些非保守元素(图8f),这些元素在不同物种之间可能有所不同,可能导致脂肪组织生物学中的物种特异性变化,即不同物种之间脂肪组织的功能和特征可能存在差异。这个发现揭示了基因调控在物种进化和脂肪组织生物学中的重要作用,以及非保守元素在这些过程中的潜在贡献。它们可能是导致不同物种之间脂肪组织特征差异的关键因素。
基因复制过程中伴随着增强子的快速进化
基因复制是获得新功能和生理机能的主要因素。与种间同源基因相比,通过重复事件产生的种内同源基因通常在表达和染色质结构(局部空间背景和RPS)方面表现出更高的相似性。作者通过与稳定拷贝数基因家族相互作用的增强子比较,发现与人类特异性扩张基因家族相互作用的增强子进化得更快。这证明基因家族的扩张与快速进化的增强子,为物种特异性脂肪表型的形成提供了重要驱动力。
案例小结
该篇文章利用Hi-C技术、ChIP-Seq技术和RNA-Seq技术分析染色质的三维结构和基因表达谱,研究了猪4种脂肪组织在体重变化过程中染色质结构的变化进而对基因进行差异调控,以揭示脂肪组织中基因的调控机制。该篇文章从多个方面阐述了染色质结构的动态变化:包括染色质的区室变化、拓扑结构域、染色质环和启动子和增强子之间的相互作用。并且利用组蛋白修饰预测了启动子活性。利用人和猪同源基因,通过猪脂肪调控机制进而研究人类脂肪组织的调控机制,同时对种族内脂肪特异性做出了解释。这有助于我们理解脂肪组织在体重调节、肥胖和相关代谢疾病中的作用。此外,该研究还可以为研究人员提供关于脂肪组织的新靶点和治疗策略的线索。由于猪与人类在解剖结构、代谢特征和肥胖相关基因方面存在相似性。通过猪这种模型动物,可以更好地理解人类脂肪组织的生物学特性和相关疾病机制。因此研究猪脂肪组织的染色质结构变化可以为人类健康提供有价值的信息。
综上所述,在进行多组学分析时,可以有如下的思路:
(1)设计实验:确定研究的目标和问题,并设计实验方案。考虑使用多组学方法,如转录组学、表观基因组学和蛋白质组学等,以全面了解脂肪组织的染色质结构和功能变化。
(2)样本采集:选择适当的实验动物模型(如猪)和样本(例如脂肪组织),并采集不同体重增加和减少条件下的样本。确保样本的质量和数量足够进行多组学分析。
(3)转录组学分析:使用RNA-Seq技术对样本进行转录组学分析,以了解基因表达的变化。比较不同体重状态下的基因表达谱,识别差异表达的基因。
(4)表观基因组学分析:使用染色质免疫沉淀测序(ChIP-Seq),CUT&Tag或ATAC-Seq等技术,研究染色质的结构和修饰变化。分析组蛋白修饰和染色质可及性的变化,以了解脂肪组织的染色质动态。
(5)蛋白质组学分析:使用质谱分析等技术,研究脂肪组织中蛋白质的变化。比较不同体重状态下的蛋白质组成,识别差异表达的蛋白质。
(6)数据整合和分析:将转录组数据、表观基因组数据和蛋白质组数据等进行整合分析。寻找关联的变化模块和关键的调控通路,以揭示脂肪组织的动态变化机制。
(7)结果解读和验证:根据多组学分析的结果,解读脂肪组织的染色质结构和功能变化。进一步进行实验验证,例如基因敲除、基因超表达或药物处理等,以验证关键基因和通路的功能。
通过以上步骤,可以全面地研究脂肪组织的染色质结构动态变化,并揭示其在体重调节和相关疾病中的作用。这种综合的多组学研究方法有助于深入理解生物系统的复杂性。
References:
Jin L, Wang D, Zhang J, et al. Dynamic chromatin architecture of the porcine adipose tissues with weight gain and loss. Nat Commun. 2023 Jun 12;14(1):3457. doi: 10.1038/s41467-023-39191-0. PMID: 37308492; PMCID: PMC10258790.

