钙离子(Ca2+)是细胞中最丰富的信号分子之一。Ca2+调节许多细胞功能,包括增殖、分化、凋亡、分泌、收缩和受精等。[1]高尔基体作为Ca2+储存的关键细胞器之一,参与调节Ca2+稳态和随后的细胞内Ca2+信号传导。[2]此外,高尔基体中合适的Ca2+浓度对正常的蛋白质合成、加工和分选至关重要。[3]分泌途径钙ATP酶(Secretory-pathway Ca2+-ATPases, SPCA1)主要定位于高尔基体膜上,对维持高尔基体的正确结构和功能起重要作用。[4]SPCA1属于P-type IIA ATPases家族,利用ATP水解释放的能量将Ca2+从细胞质基质泵入高尔基体腔,转运Ca2+过程遵循典型的Post-Albers循环。[5]研究表明,SPCA1功能失常可能会引发海利-海利病(Hailey-Hailey disease,HHD,家族性良性慢性天疱疮)[6]和乳腺癌[7]的发生。因此,深入研究人源SPCA1蛋白(hSPCA1)介导的Ca2+转运机理具有重要的生物医学意义。
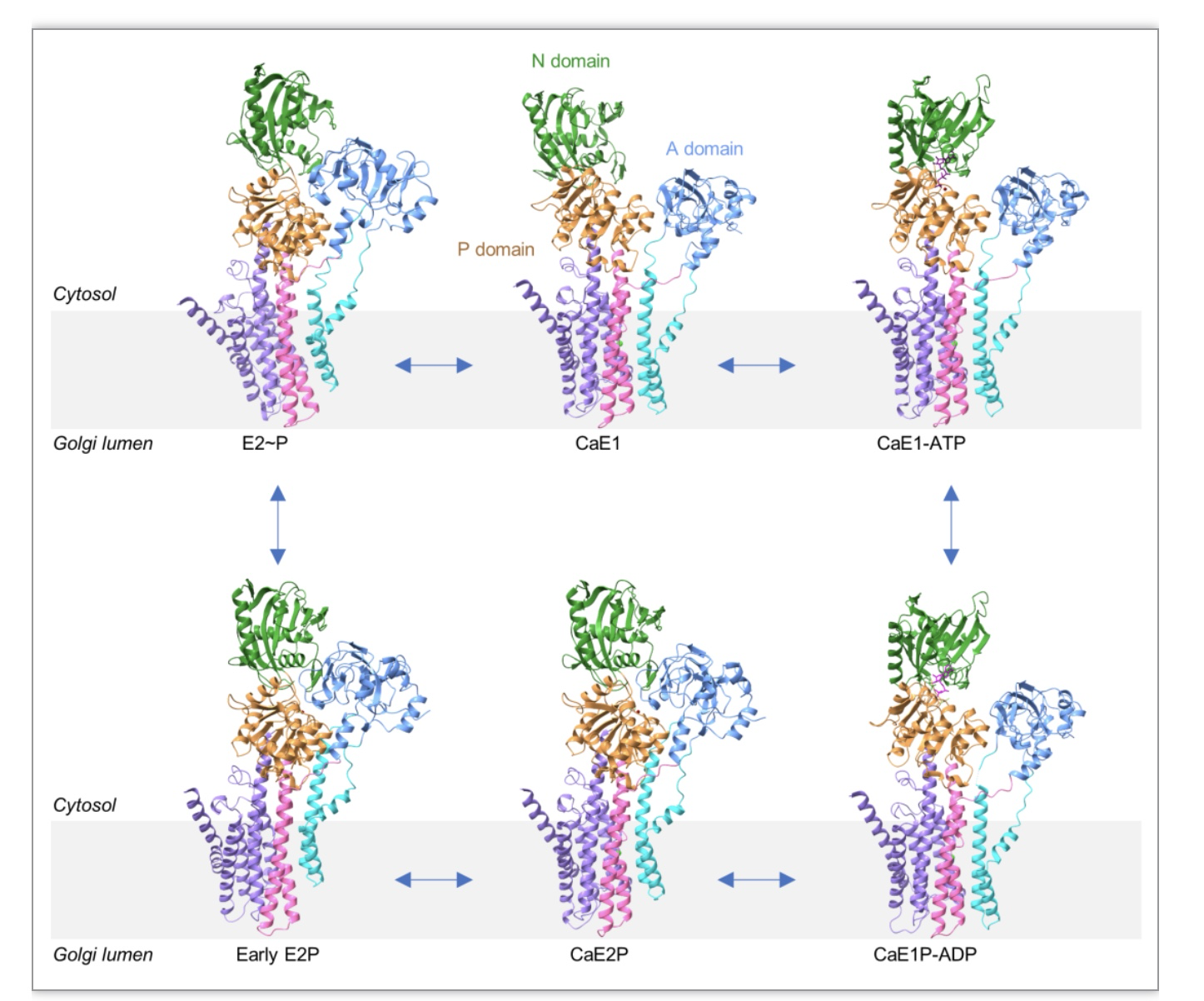
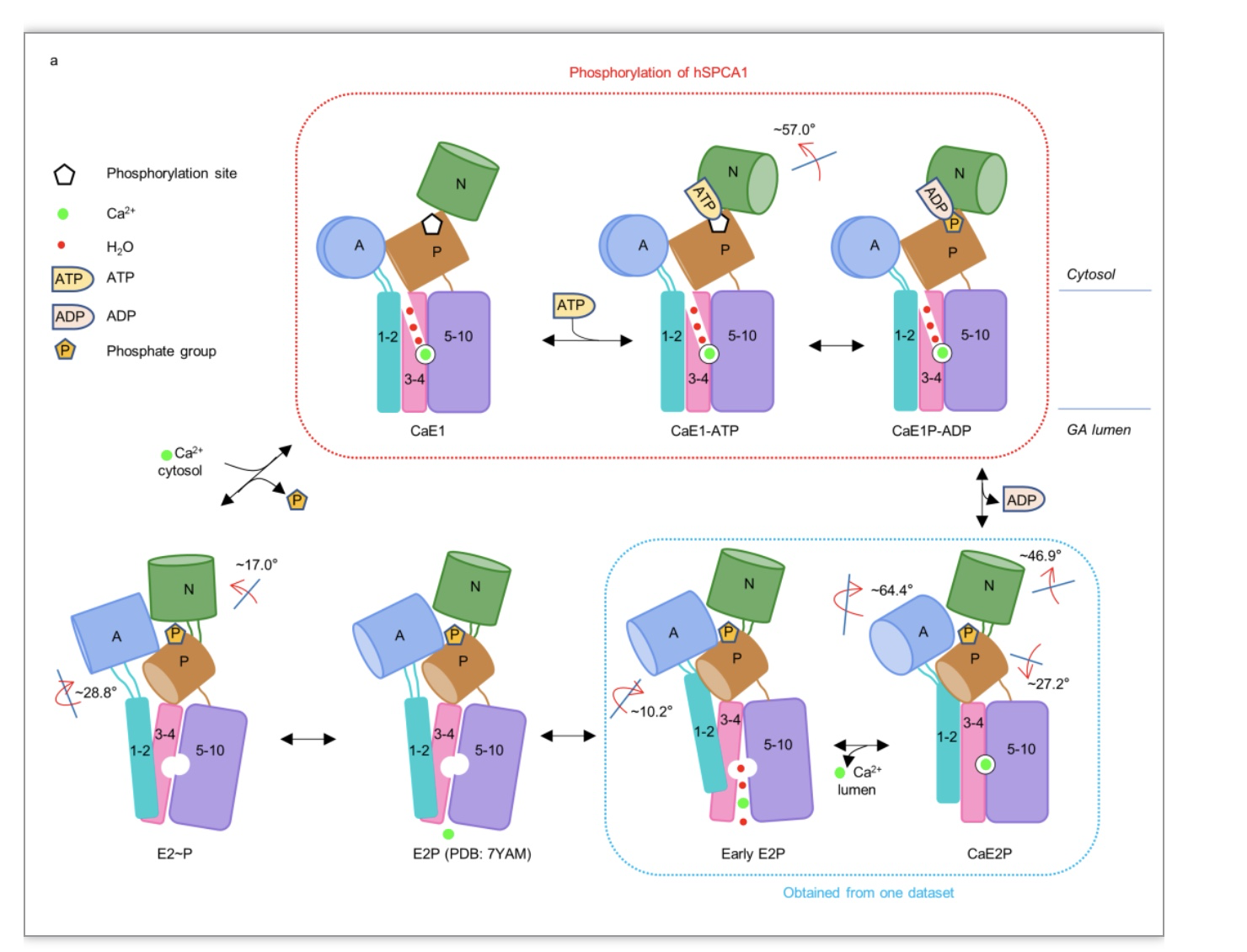
为了详细了解人源SPCA1(hSPCA1)的转运机制,研究团队首先通过外源重组表达、分离纯化出高质量的人源SPCA1(hSPCA1)蛋白,并与不同的ATP或磷酸盐类似物孵育;进一步利用冷冻电镜单颗粒技术成功解析出hSPCA1转运Ca2+过程中CaE1、CaE1-ATP、CaE1P-ADP、CaE2P、early E2P以及 E2~P的六个中间态近原子分辨率结构为了详细了解人源SPCA1(hSPCA1)的转运机制,研究团队首先通过外源重组表达、分离纯化出高质量的人源SPCA1(hSPCA1)蛋白,并与不同的ATP或磷酸盐类似物孵育;进一步利用冷冻电镜单颗粒技术成功解析出hSPCA1转运Ca2+过程中CaE1, CaE1-ATP, CaE1P-ADP, CaE2P, early E2P, 以及 E2~P的六个中间态近原子分辨率结构(图1)。
图1 hSPCA1转运底物过程中六个中间态的原子模型
结合hSPCA1的原子模型和分子动力学模拟,研究团队确定了hSPCA1的Ca2+结合位点,该结合位点由跨膜螺旋4上的Val303, Ala304, Ile306和Glu308, 以及跨膜螺旋6上的Asn738和Asp742等六个氨基酸组成,对应于SERCA的Ca2+结合位点II。hSPCA1对应于SERCA(sarcoplasmic/endoplasmic reticulum Ca2+-ATPase,SERCA)的Ca2+结合位点I的部分氨基酸被替代而破坏了位点I的Ca2+配位几何, 这也许可以解释为什么hSPCA1在每个循环中只转运一个Ca2+。
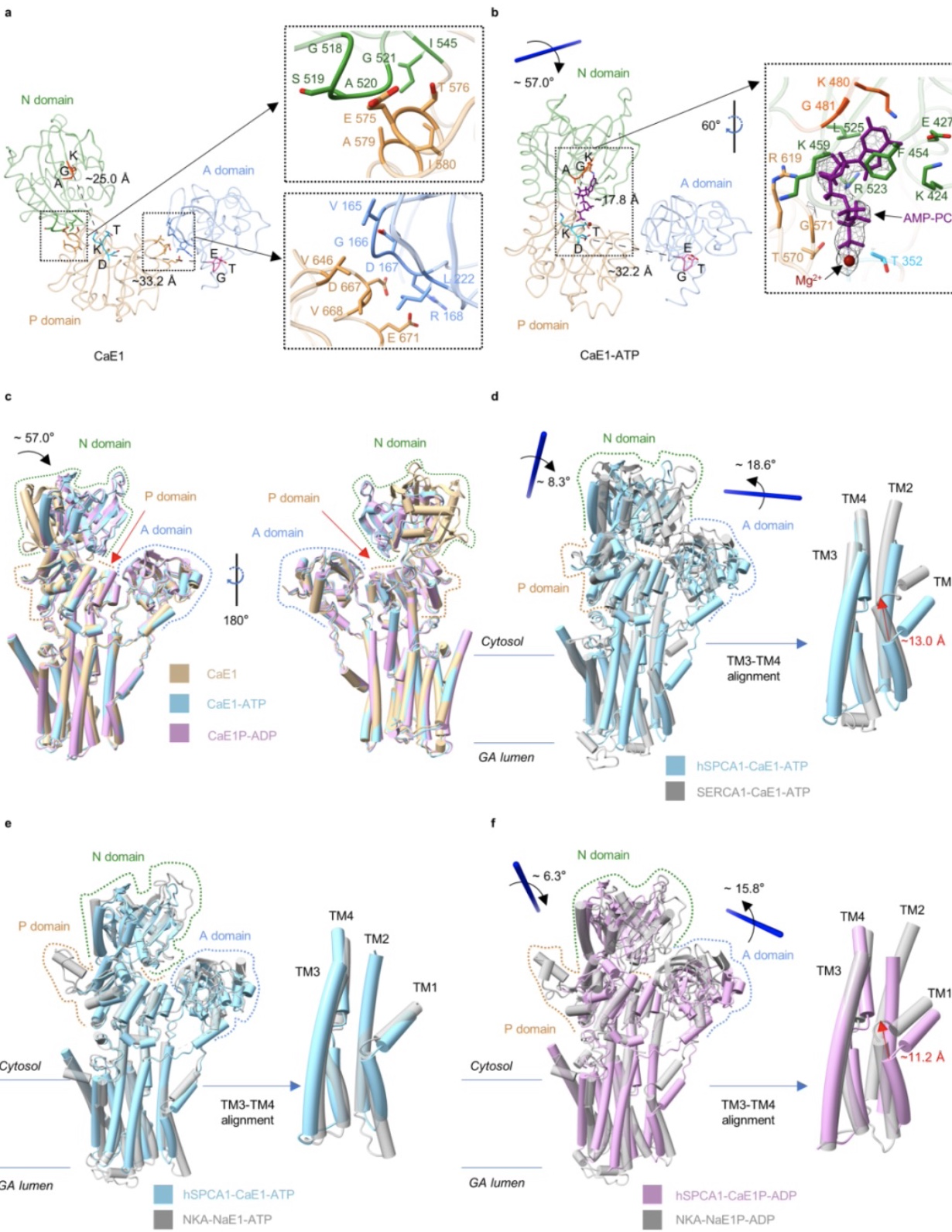
随后,研究团队分析了hSPCA1磷酸化过程CaE1→CaE1-ATP→CaE1P-ADP的构象变化,ATP类似物AMP-PCP的结合使hSPCA1的N结构域朝着P结构域旋转了~57°,其它区域几乎不动。CaE1P-ADP与CaE1-ATP的构象非常相似。通过hSPCA1、SERCA、以及钠钾ATP酶(Na+/K+-ATPases, NKA)等三种P-type II ATP酶的结构比较分析,研究人员发现,三种蛋白的胞质头部在结合底物的E1态都保持开放状态,SERCA和NKA的胞质头部分别在E1-ATP态和E1P-ADP态关闭,而hSPCA1的胞质头部在CaE1→CaE1-ATP→CaE1P-ADP状态转换过程始终保持开放,这或许是SPCAs区别于其他P-type II ATPases(如SERCAs和NKAs)的一个关键特征(图2)。
图2 hSPCA1的胞质头部在磷酸化过程中始终保持开放状态,而SERCA和NKA的胞质头部分别在CaE1-ATP态和NaE1P-ADP态关闭。
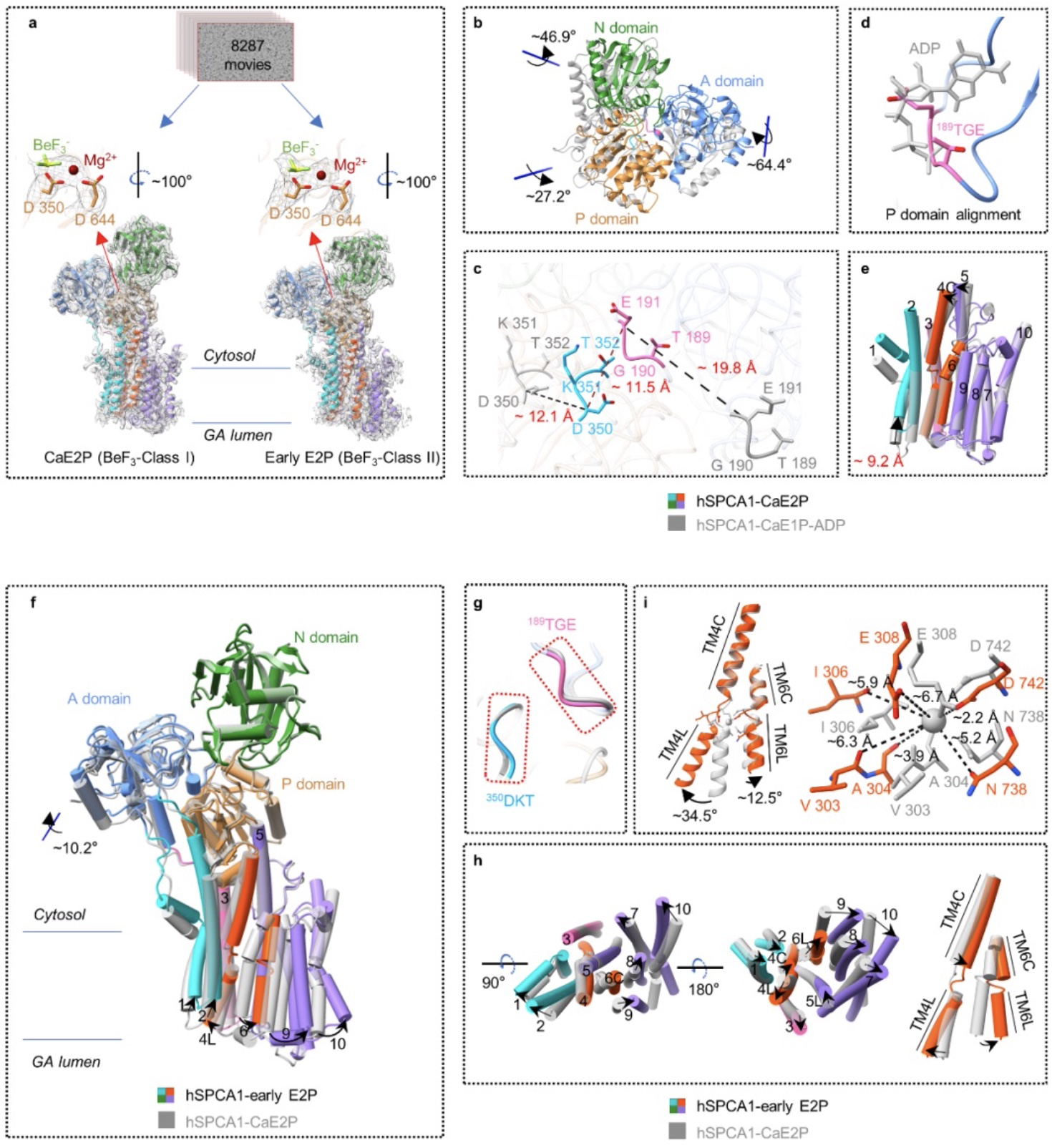
此外,该研究首次获得了CaE2P状态的结构,通过将该结构与CaE1P-ADP结构比对,研究人员发现从CaE1P-ADP→CaE2P,胞质区三个保守的结构域(A、P、N结构域)均显著重排,胞质头部关闭,ADP结合位点被A结构域占据,而跨膜区域只有少量重排,Ca2+结合位点保持完整,并且Ca2+被封闭在跨膜螺旋中(图3a-e)。
TGE 基序被认为与蛋白质去磷酸化密切相关,[9]并且在底物转运过程中会有明显的构象变化,[10,11]然而,这种运动与底物转运之间的联系还没有得到很好的阐明。CaE2P态hSPCA1结构分析显示:对去磷酸化过程非常重要的TGE 基序在Ca2+释放之前已经靠近磷酸化的天冬氨酸(图3c); 结合SERCA的CaE1P态结构信息怕[12],TGE 基序构象变化很可能发生在CaE1P→CaE2P转变过程中。更有趣的是,该研究通过电镜三维分类分析,获得了early E2P结构。通过对这两个结构的比对分析发现,从CaE2P→early E2P状态,胞质区只有A 结构域发生了~10.2°的旋转,而跨膜区整体出现了显著重排,跨膜螺旋4和6相互分离,破坏了Ca2+结合位点,并形成朝向高尔基体腔的开放口袋,Ca2+从该口袋进入到高尔基体腔中(图3f-i)。这些结果说明A 结构域的旋转构象变化可能在诱导Ca2+释放中起关键作用,对我们理解P-type II ATPases转运底物过程提供了关键结构信息。
图3 CaE2P与early E2P结构
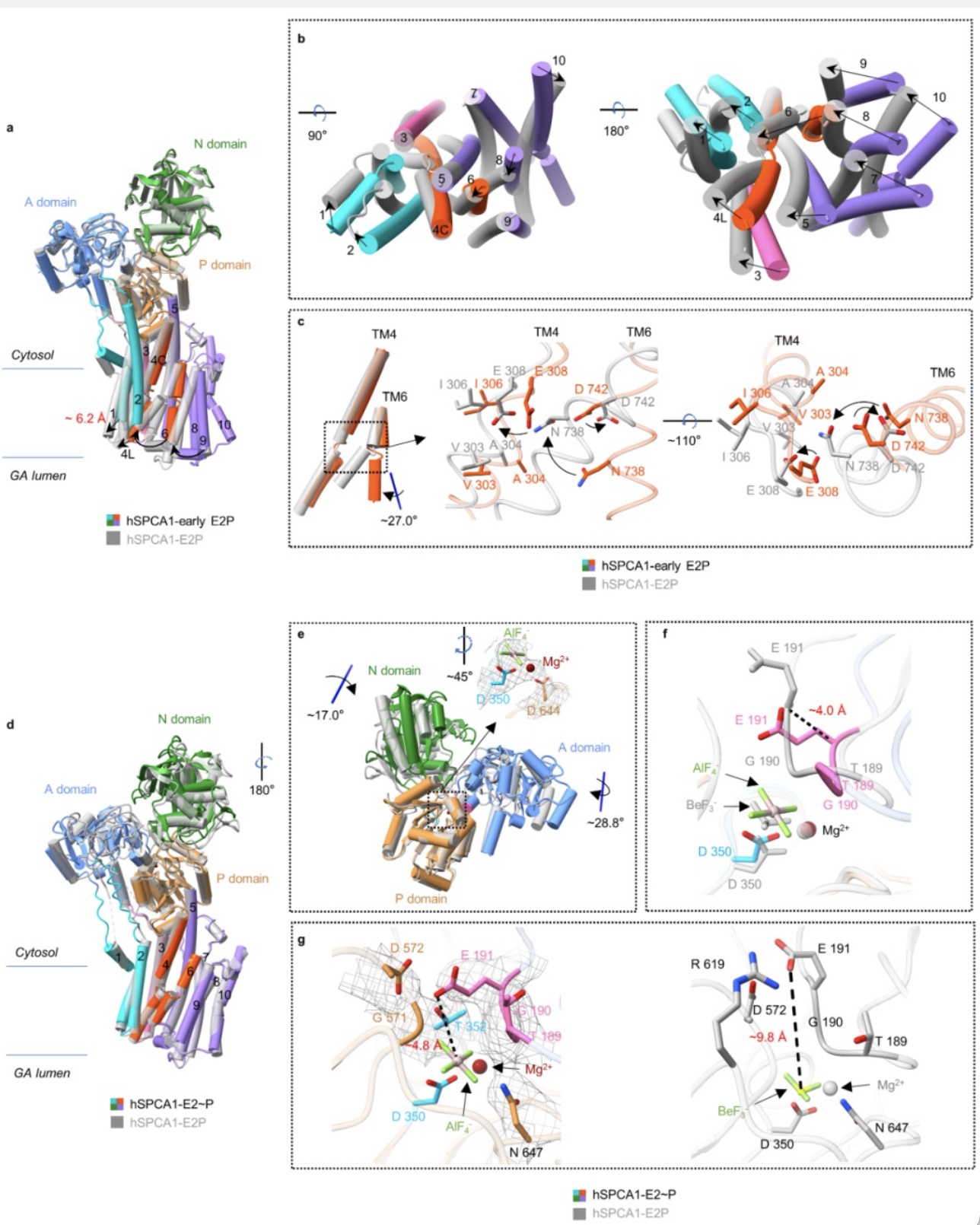
将early E2P结构与最近报导的E2P结构[8]比对分析得出,从early E2P至E2P,胞质头部几乎不动,而跨膜区域显著重排,跨膜螺旋[6-10]向跨膜螺旋4靠近,关闭了Ca2+释放通道,在此过程中,跨膜螺旋6扭转,扭曲了Ca2+结合位点,阻止了Ca2+的重新捕获(图4a-c)。为了了解hSPCA1去磷酸化过程中的构象变化,研究人员将hSPCA1蛋白与AlF4-孵育,成功获得了E2~P结构。在去磷酸化过程中,胞质区的A 结构域和N 结构域分别旋转了~28.8° 和 ~17.0°,而跨膜螺旋几乎不动(图4d-g),说明去磷酸化过程胞质区域的运动对Ca2+释放途径门控的影响非常小。
图4 E2P与E2~P结构比对
最后,基于六个不同构象的hSPCA1高分辨率三维结构,研究人员应用分子动力学模拟明确了Ca2+进入和离开hSPCA1的完整途径,全面揭示了hSPCA1转运Ca2+的工作机制(图5)。
图5 hSPCA1转运Ca2+的工作模型
综上,研究人员通过结构生物学、分子动力学模拟等技术手段,明确了hSPCA1的Ca2+结合位点和潜在的Ca2+进出通道,阐明了 hSPCA1区别于其他P-type ATPases的关键结构特征,揭示出Ca2+转运过程中的一系列构象变化,扩大了对P-type ATPases的理解,为开发针对hSPCA1的特异性激动剂和抑制剂提供了重要的结构信息,为治疗hSPCA1相关疾病提供理论基础和重要线索。然而,为了更加全面的理解hSPCA1转运Ca2+的动态过程,仍需要解析多个重要的中间结构,如E1,CaE1P和E2的结构,与hSPCA1特异性结合的小分子或许有助于这些结构的解析。