肝细胞癌(Hepatocellular carcinoma,HCC)严重威胁人们的身体健康,据世界卫生组织最新预测,到2030年将有100万人死于HCC。对于晚期HCC患者,治愈和长期生存前景仍十分暗淡[1, 2]。尽管近年来出现了针对PD-1或PD-L1的免疫检查点抑制剂(Immune checkpoint inhibitors,ICIs)在HCC患者中显示出部分疗效,但其总体临床有效率仍然很低,仅占HCC患者的20%左右 [3]。研究表明,HCC中Wnt/β-catenin信号通路的激活促进了肿瘤免疫逃逸和抗PD-1/PD-L1免疫治疗耐药,这与HCC的低临床获益显著相关 [4-7]。因此,开发一种能够靶向调控Wnt/β-catenin信号通路并联合ICIs阻断治疗的药物,以优化HCC的免疫治疗是迫切需要的。报道了一种同时靶向β-catenin和PD-L1可用于增强肝细胞癌的免疫治疗的球形外消旋超分子多肽,具有良好的HCC疗效和生物安全性,为HCC免疫治疗提供了新策略与思路。

在此项研究中,研究者通过层级自组装的方式,合成了一种命名为sBBI&PDP的外消旋超分子多肽(图1),主要由BCL9/β-catenin抑制剂的L型肽(Inhibitor of BCL9 / β-catenin,sBBI)和PD-1/PD-L1抑制剂的D型肽(PD-L1 predator,PDP)构建而成。
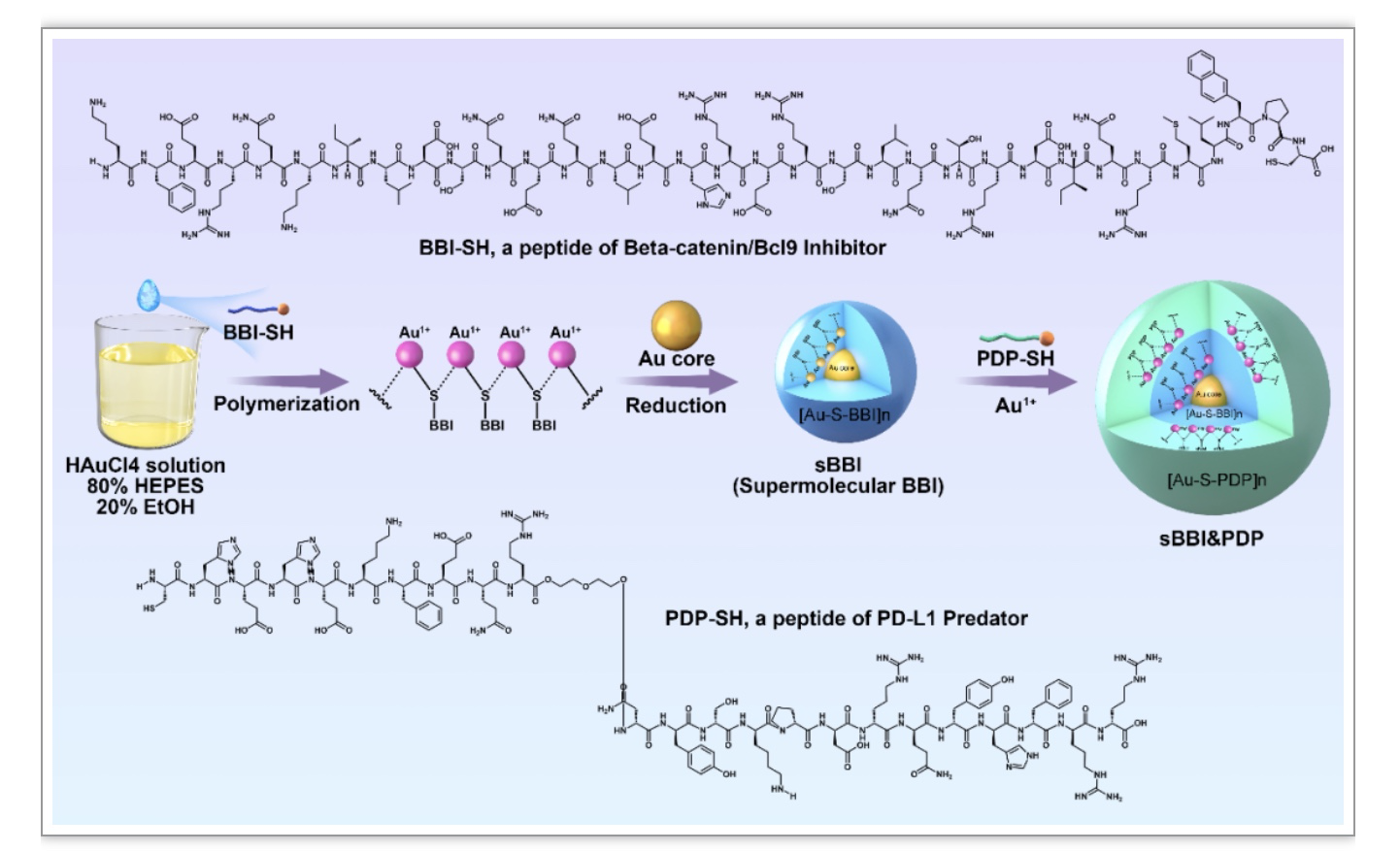
图1 sBBI&PDP的设计与合成
肿瘤细胞中高浓度的谷胱甘肽(Glutathione,GSH)可触发金纳米颗粒表面硫醇的释放 [8, 9]。在10 mM GSH环境下,sBBI&PDP的TEM颗粒直径和水合粒径显著变小,表明sBBI&PDP多肽发生了释放(图2A-B)。图2C高效液相色谱(HPLC)结果也显示,在PBS缓冲液(No GSH)中,24h内未检测到明显的肽吸收峰,sBBI&PDP保持稳定,而在10 mM GSH溶液中,可以观察到多肽的快速释放。此外,电感耦合等离子体质谱(ICP-MS)结果(图2D)显示,sBBI&PDP在生物体内的半衰期为8.5 h,1周后,大部分sBBI&PD纳米颗粒代谢出体外,仅肝、脾少量残留,说明sBBI&PDP是经单核巨噬细胞系统并可被机体清除的纳米颗粒。
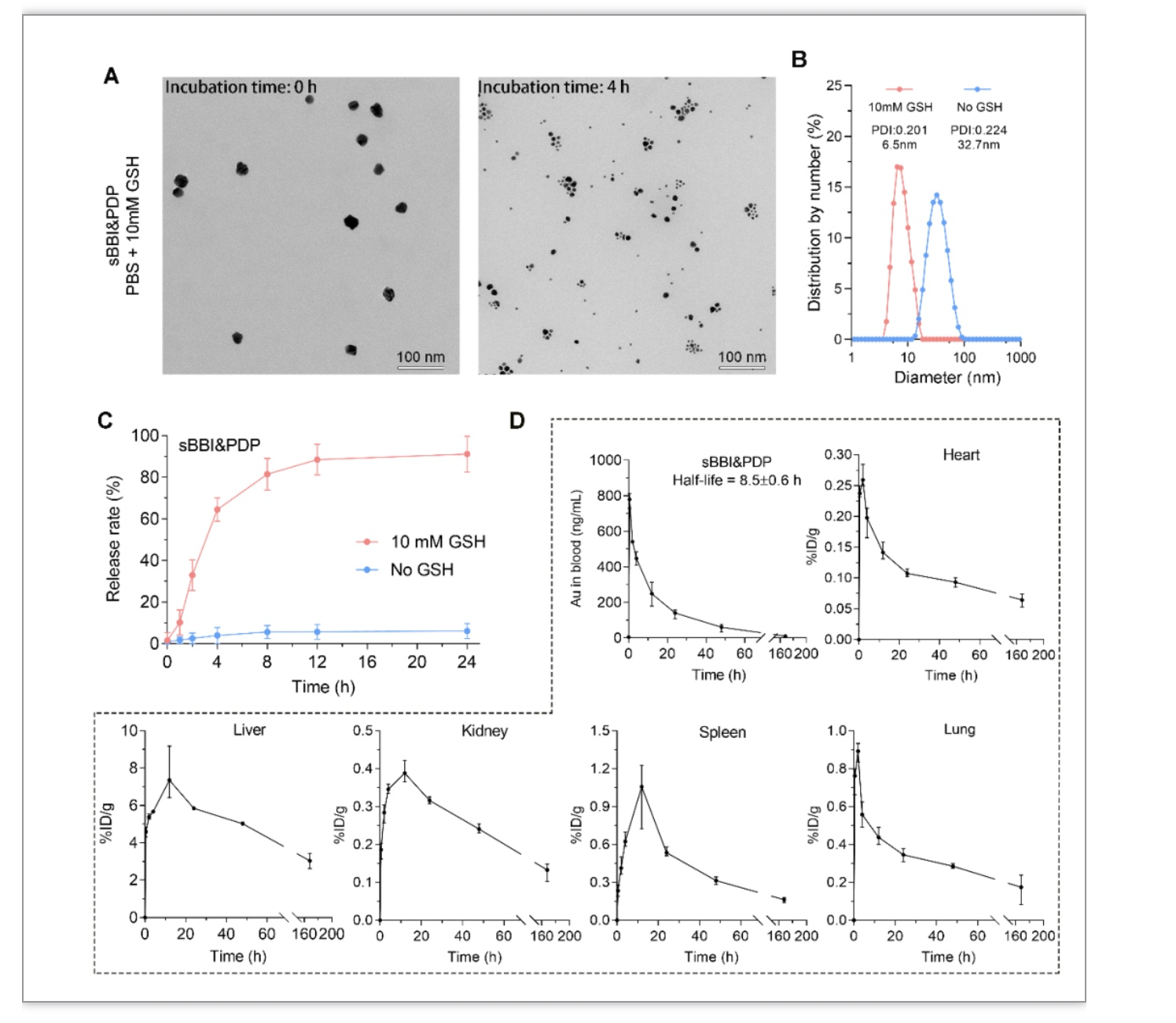
图2 sBBI&PDP的释放和药物代谢动力学
为探索sBBI&PDP在体内的抗肿瘤机制(图3),研究者通过建立同种原位肝癌小鼠模型,对治疗后的肝癌组织行蛋白质组学(Label-free)测序分析,发现sBBI&PDP与Control(生理盐水)和商品化PD-L1抑制剂(Anti-PD-L1)相比,存在大量的差异蛋白表达。进一步基因富集分析(GSEA)显示,与Control或Anti-PD-L1组相比,sBBI&PDP组的Wnt-β/catenin信号通路显著下调,对应的HCC组织β-catenin和CyclinD1的免疫组化结果与GSEA分析一致,在sBBI&PDP组显著下调。更重要的是,sBBI&PDP处理组的HCC组织在激活免疫反应相关T细胞方面显著上调。相应的免疫荧光双染色(IF)结果显示,CD3+/CD8+ T细胞显著上调,CD4+/CD25+ T细胞显著下调。以上表明sBBI&PDP在体内可以募集更多的CD8+ T细胞作用于HCC组织,并通过抑制Wnt/β-catenin和PD-L1增加CD8+ T细胞对HCC肿瘤的杀伤敏感性。
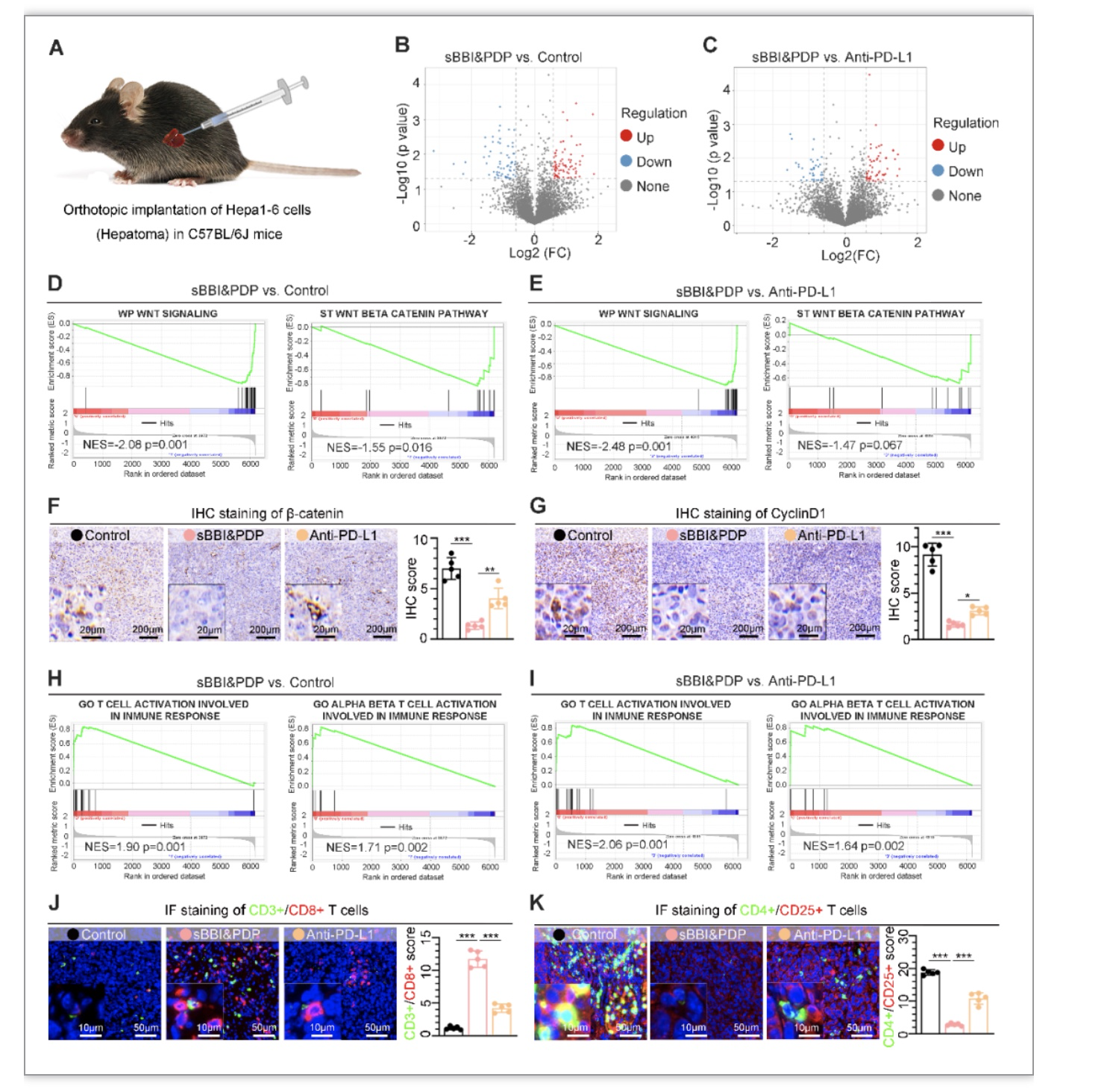
图3 sBBI&PDP在体内的抗肿瘤机制
为验证sBBI&PDP对肝癌的治疗作用,作者通过建立同种原位肝癌移植小鼠模型研究其疗效(图4)。sBBI&PDP给药期间对小鼠体重变化无显著差异,给药结束后的肝肿瘤照片照片对比,sBBI&PDP组的肿瘤结节数量显著更少或消失。对肝癌组织切片的HE染色和TUNEL染色分析,发现sBBI&PDP组的肿瘤坏死区域和凋亡细胞更多,PD-L1蛋白的IHC分析也显著下调。在3个月的Kaplan-Meier生存分析中,与sBBI、Anti-PD-L1、Au纳米颗粒或Control组相比,sBBI&PDP组HCC荷瘤小鼠的生存时间更久,中位生存时间分别为80天、55天、53天、41天和39天(p = 0.0058)。
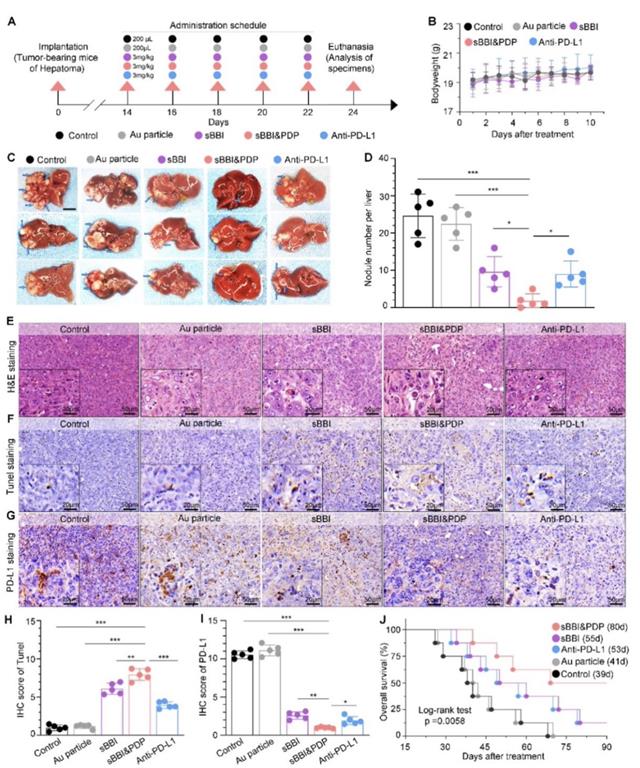
图4 sBBI&PDP在同种原位肝癌小鼠中的抗肿瘤疗效探索
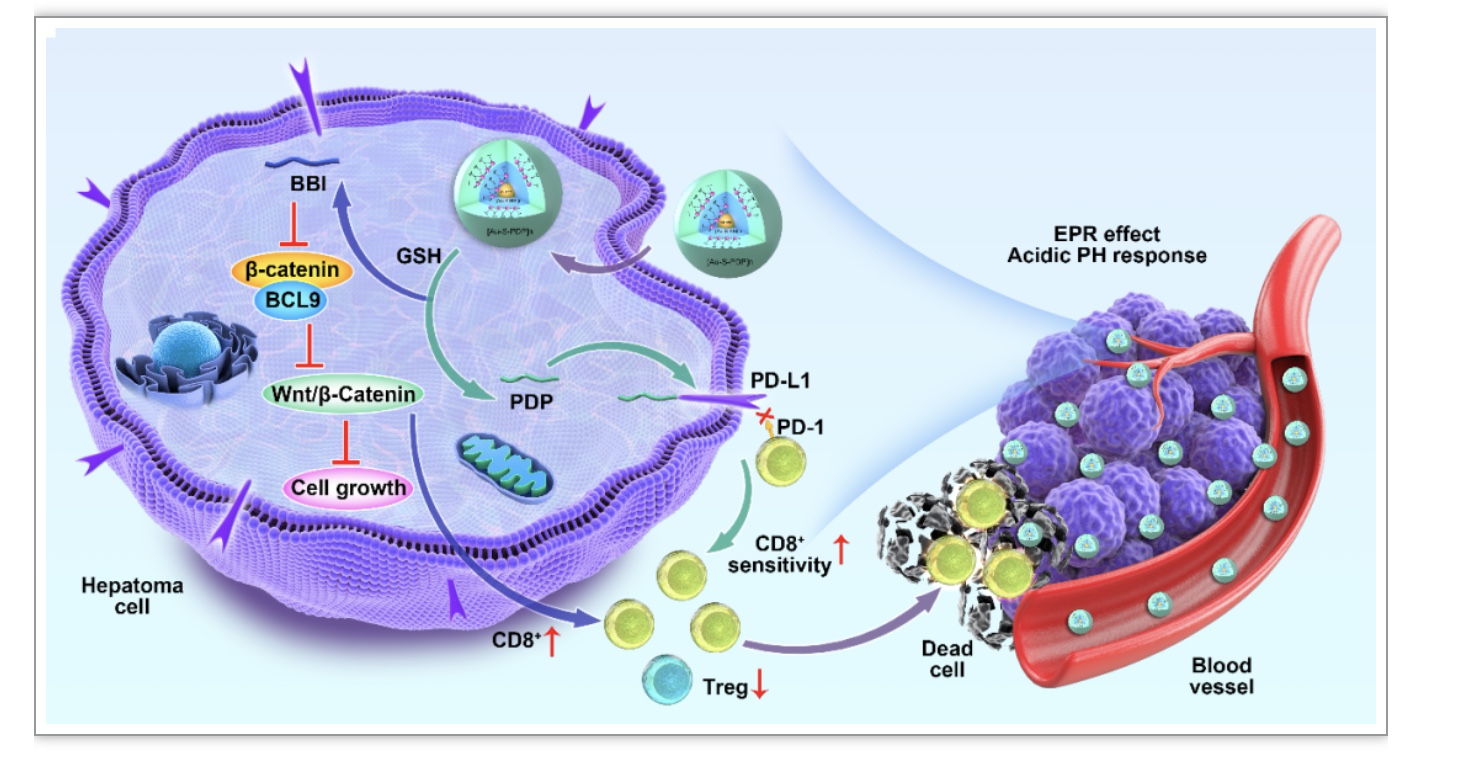
图5 sBBI&PDP 在肝癌细胞中的作用机制示意图
sBBI&PDP通过EPR效应和肿瘤酸性pH响应靶向肿瘤细胞,释放BBI多肽抑制肿瘤细胞中β-catenin和BCL9相互作用,从而抑制Wnt/β-catenin信号通路的激活,阻止肿瘤细胞的增殖,另外还可促进CD8+ T细胞浸润,增敏HCC免疫治疗;另一方面,释放PDP与肿瘤细胞PD-L1胞内段结合,阻断T细胞PD-1/PD-L1相互作用,缓解免疫耐受,增强CD8+T细胞杀伤肿瘤细胞效应(图5)。与单独sBBI、商品化PD-L1抑制剂或Wnt抑制剂相比,sBBI&PDP在C57小鼠同种原位HCC模型和人源免疫NSG小鼠肝癌异种移植瘤(HCC-PDX)模型中显示出更优的抗肿瘤效果。此外,sBBI&PDP还保持十分良好的生物组织相容性。

