与传统疫苗相比,mRNA 疫苗具有多项优势,包括易于开发、易于规模放大以及可快速生产。与其它疫苗类似,mRNA 疫苗药物产品在其生产过程中经历三个典型步骤,即上游生产、下游纯化以及最终配制mRNA 药物底物。本文将讨论这些步骤和每个工艺过程中的最新进展,以简化 mRNA 疫苗的生产。
mRNA 疫苗的上游生产包括以含有目的基因的质粒获得 mRNA 转录物。该反应称为体外转录反应 (IVT)。IVT 酶促反应依赖于 RNA 聚合酶,例如 T7、SP6 或 T3。RNA 聚合酶催化从含有目标基因的线性化 DNA 模板合成目的 mRNA。线性化 DNA 模板是通过内切核酸酶的限制性裂解含有目的基因的质粒而产生的,或者,在工业背景中不太常见的情况下,通过 PCR 扩增目的基因产生 mRNA 分子。IVT 反应的基本酶包括:(i) RNA 聚合酶 - 将 DNA 转化为 RNA,(ii) 无机焦磷酸酶 (IPP) - 增加 IVT 反应产量,(iii) 鸟苷酸转移酶 - 将 GMP 核苷添加到 mRNA 的 5' 端, (iv) 帽 2'-O-甲基转移酶(SAM) - 这种酶在 mRNA 5' 帽的 2' 位置添加一个甲基,(v) DNase I - 用于去除RNA样本中污染性基因组DNA和降解DNA模板的核酸内切酶,以及 (vi) poly (A) 尾聚合酶和 (vii) 修饰和未修饰的三磷酸核苷 (NTP)。这些酶有助于从含有目标基因的质粒在上游形成 mRNA 转录物。加帽酶包括 SAM 和鸟苷酸转移酶,它们在 mRNA 的 5' 端酶促形成 5' 帽,而poly (A) 尾聚合酶加尾酶形成poly (A) 尾。另一种 5' 加帽的方法是使用共转录方法,其中预先准备好 5' 帽,并以非酶促方式将此帽添加到 mRNA 中。
mRNA由上游生产阶段的IVT反应产生;然后通过下游工艺中的多个纯化步骤将其分离和纯化。IVT 反应混合物含有多种杂质,包括残留的 NTP、酶、错误形成的 mRNA 和 DNA 质粒模板。IVT mRNA 的实验室规模纯化涉及通过 DNase 酶消化去除 DNA,然后进行氯化锂 (LiCl) 沉淀的方法。基于实验室的方法不允许完全去除异常的 mRNA 物质,包括 dsRNA 和截短的 RNA 片段。去除这些杂质对于获得证明其预期功效和安全性的纯 mRNA 产品至关重要。低效的纯化技术会导致 mRNA 疫苗产品具有降低的翻译效率和不需要的免疫刺激特性。例如,当修饰的 mRNA 在递送至树突细胞之前通过反相 HPLC 纯化时,观察到 mRNA 转染和相关蛋白质产量增加 10-1,000 倍。
层析是生物制药行业普遍接受并广泛使用的纯化方法,用于纯化疫苗和生物药物产品。2004 年首次发表的 RNA 寡核苷酸大规模核酸纯化程序就使用了尺寸排阻层析法 (SEC)。SEC 具有多种优势,包括选择性、可放大性、通用性、成本效益以及获得的核酸产品的高纯度和产量。但是,SEC 无法去除具有相同大小的杂质,例如 dsDNA。离子对反相层析法 (IEC) 已被证明是一种出色的 mRNA 疫苗纯化技术。IEC 可以轻松地将目标 mRNA 从IVT 反应杂质中分离出来。这种分离方法依赖于目标 mRNA 和杂质之间的电荷差异。IEC 有几个优势,包括从目标 mRNA 中分离更长的 RNA 转录物、更高的结合载量、成本效益和可放大性。由于 IEC 是在变性条件下进行的,因此该过程较为复杂且对温度敏感。基于亲和的层析分离是另一种 mRNA 纯化方法。脱氧胸苷 (dT)-Oligo dT 是一种捕获 mRNA 聚腺苷酸尾的序列。含有 Oligo dT 的层析基球可用于 mRNA 疫苗的下游纯化。切向流过滤 (TFF) 可用于去除小尺寸杂质。作为 mRNA 疫苗的最后精纯步骤,疏水相互作用层析 (HIC) 步骤的加入可能非常有益。
带负电荷的 mRNA 分子应配制在基于脂质的药物递送系统中,以避免 mRNA 降解并提高其转染效率和半衰期。LNP 是最值得信赖、最可靠且经监管机构批准的基于脂质的非病毒载体系统,用于递送 mRNA 疫苗药物物质。mRNA LNP 是通过沉淀溶解在有机相中的脂质并将它们与水相中的 mRNA 混合而形成的。有机相中最常用的脂质是可电离脂质、胆固醇、辅助脂质和 PEG 脂质。同时,将 mRNA 溶解在低 pH 值的柠檬酸盐或醋酸盐缓冲液中。将水溶液和非水溶液混合使可电离脂质质子化,从而在可电离质子化脂质和阴离子 mRNA 之间引起静电吸引。这种相互作用同时与其它脂质的疏水相互作用相结合,并驱动mRNA-LNP 自发自组装,mRNA 封装在纳米颗粒的核心内。在 LNP 形成后,它们被洗滤,以去除非水溶剂,通常是乙醇,并将溶液 pH 值升高至生理 pH 值。微流控混合器能够形成具有低多分散指数和高 mRNA 封装效率的小尺寸 LNP。微流控混合是实验室规模和 GMP 级别最常用的 mRNA LNP 配制方法。可以通过简单地调整微流控设备设置以改变水相和非水相的流速和体积,从而获得所需尺寸和尺寸分布的 LNP。
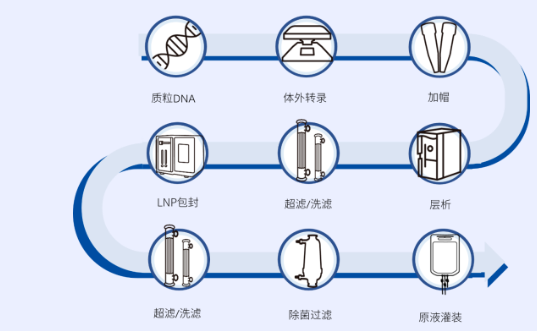
图1. mRNA疫苗生产过程的步骤和阶段。mRNA 疫苗生产可分为三个阶段:上游 mRNA 生产、下游 mRNA 纯化和mRNA 脂质纳米颗粒的配制。mRNA 的生产可以在一步共转录反应中进行,其中使用加帽试剂,或在两步反应中进行酶促加帽。较小的实验室规模 mRNA 纯化过程包括 DNase I 消化酶,然后是 mRNA 的 LiCl 沉淀。大规模纯化 mRNA 涉及利用行之有效的层析方法与切向流过滤 (TFF) 相结合。最后,mRNA 疫苗的配制包括在非水相中将 mRNA 水溶液与脂质溶液混合。这获得脂质纳米颗粒 (LNP) 的自组装,并将带负电荷的 mRNA 封装在 LNP 的核心内。
参考文献:
G.T.Szabo, A.J.Mahiny, I.Vlatkovic, COVID-19 mRNA vaccines: Platforms and current developments. Molecular Therapy, 2022, 30, 5.
M.Maeki, S.Uno, A.Niwa, et al., Microfluidic technologies and devices for lipid nanoparticle-based RNA delivery. Journal of Controlled Release, 2022, 344:80-96.
V.Gote, P.K.Bolla, N.Kommonieni, A Comprehensive Review of mRNA Vaccines. International Journal of Molecular Sciences, 2023.


