钙化性主动脉瓣疾病(Calcific aortic valve disease, CAVD)是一种老年人常见的心血管疾病。随着人口老龄化,CAVD的发病率正逐年上升,已经发展成为仅次于冠心病和高血压病的第三大心血管疾病。目前CAVD发病机制尚未明确,临床上缺乏有效药物防治CAVD。
机械敏感离子通道Piezo1是一类可受多种机械应力(包括拉伸、挤压力和剪切力等)激活而产生兴奋电信号的离子通道,是细胞感受压力的分子基础[1,2]。然而,Piezo1对CAVD发生发展的影响及其机制仍待探索。该研究揭示了Piezo1过度活化可增强YAP依赖的间质细胞谷氨酰胺分解,而其中的代谢产物乙酰辅酶A可导致促成骨分子RUNX2启动子上的组蛋白乙酰化修饰,从而促进主动脉瓣膜间质细胞(valve interstitial cells, VICs)成骨分化进而促进CAVD的发生发展,为CAVD的发病机制研究提供理论依据。

研究者首先通过q-PCR和免疫印迹检测钙化主动脉瓣和正常主动脉瓣中Piezo1的表达,发现在Piezo1在钙化主动脉瓣组织中高表达。然后利用免疫组化染色检测Piezo1在人主动脉瓣三层结构中(海绵层、纤维层和心室层)的分布。结果发现,与正常主动脉瓣相比,钙化主动脉瓣的Piezo1表达升高,主要集中在海绵层,其次是纤维层和心室层。另外,Piezo1在两种主动脉瓣膜组织的主动脉侧内皮层中均显示相对高的表达。免疫荧光则进一步揭示了在钙化主动脉瓣中Piezo1与成骨标记物runt相关转录因子2 (runt-related transcription factor, RUNX2)的共定位(图1)。
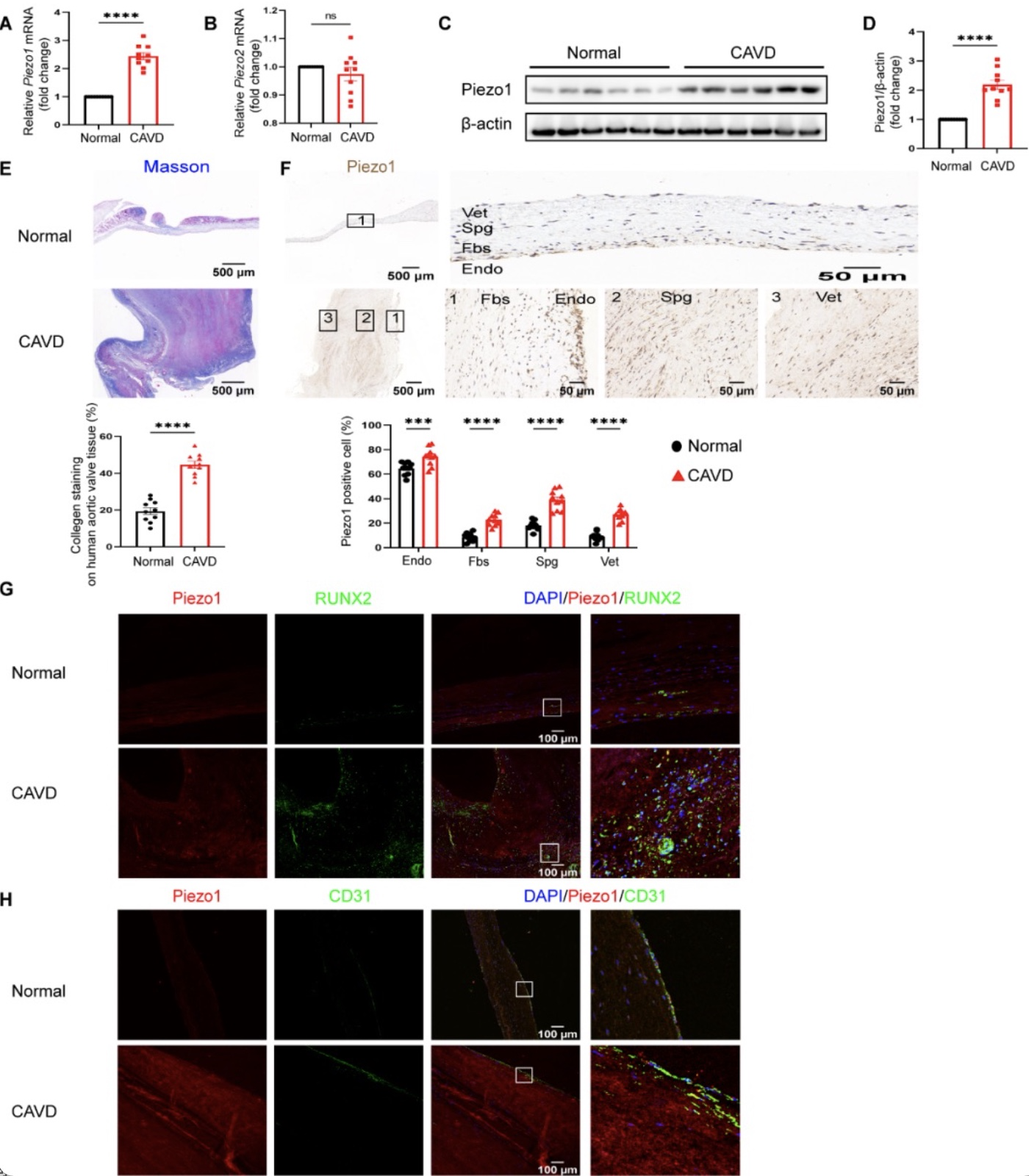
图1 Piezo1在钙化主动脉瓣膜中高表达
为明确主动脉瓣受到的高强度血流剪切力是否可以激活瓣膜Piezo1的表达并诱导瓣膜病变,以及抑制Piezo1是否可延缓主动脉瓣膜病变,研究者构建了两种CAVD模型:升主动脉缩窄术模型(Ascending aortic constriction, AAC)和直接导丝损伤模型(Direct wire injury, DWI)。然后对两种模型术后小鼠随机分组:一组隔天腹腔注射Piezo1抑制剂Dooku1 (10 mg/kg);另一组隔天腹腔注射等量的生理盐水。8周后,与各自的Sham组对比,AAC和DWI小鼠的主动脉瓣流速峰值显著增加,瓣膜增厚并出现结节病变,以及Piezo1和RUNX2的表达升高。而Dooku1可抑制瓣膜Piezo1的表达,延缓瓣膜病变(图2)。
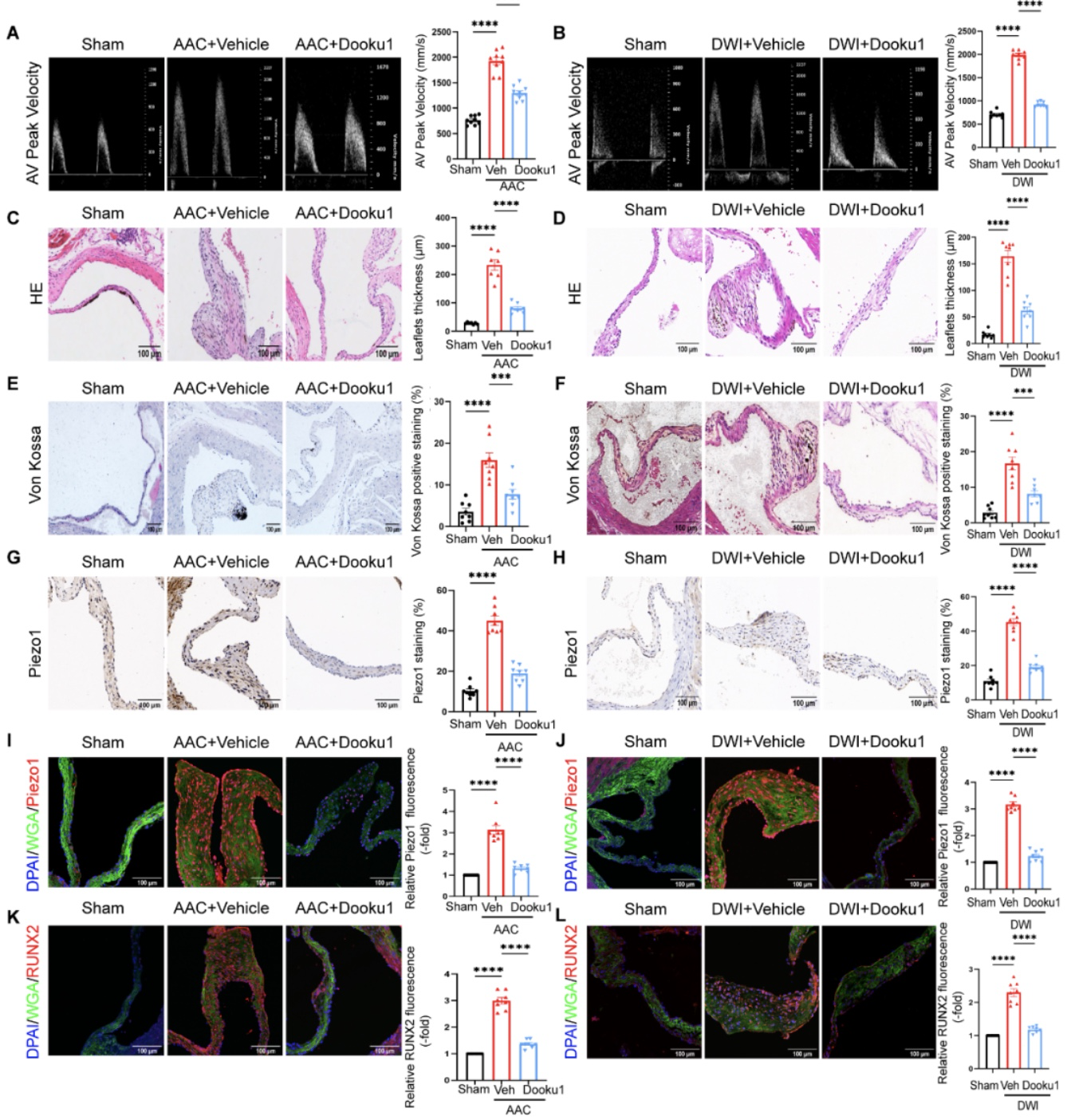
图2 抑制Piezo1可延缓AAC和DWI诱导的瓣膜病变
为明确Piezo1活化对人主动脉瓣膜间质细胞成骨分化的影响。研究者使用Piezo1特异性激动剂Yoda1刺激正常瓣膜组织和钙化瓣膜组织来源的VICs,发现Yoda1可诱导VICs的成骨相关因子ALP、RUNX2、BMP2的表达升高,且来自钙化瓣膜组织的VICs对Yoda1诱导的成骨反应表现更强。而使用Dooku1抑制或siRNA沉默Piezo1可减轻主动脉瓣膜间质细胞的成骨反应(图3)。
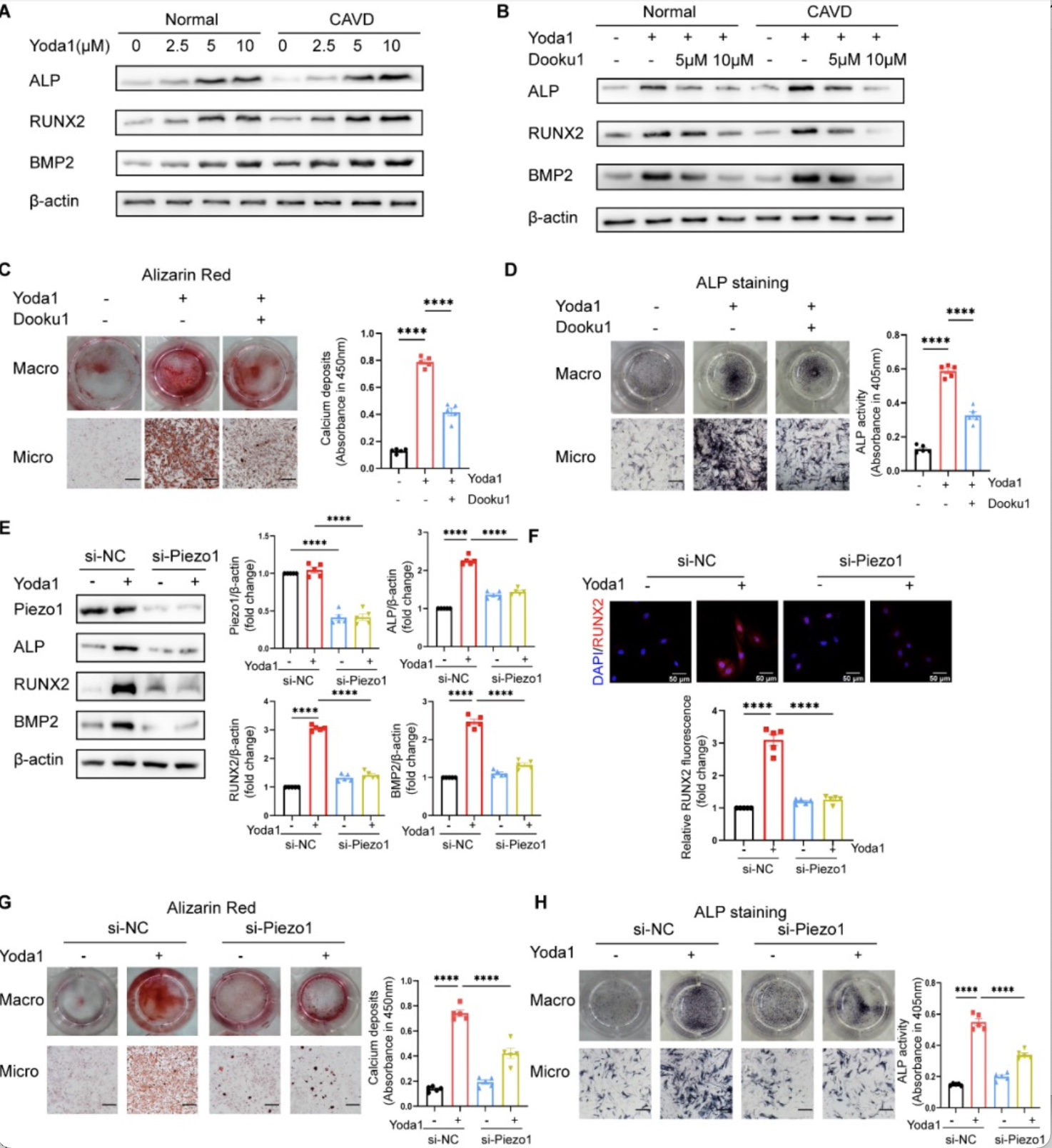
图3 Piezo1特异性激动剂Yoda1可诱导主动脉瓣膜间质细胞的成骨分化
已有研究表明机械应力激活的机械转导信号通路可以通过yes相关蛋白(yes-associated protein, YAP)调节细胞谷氨酰胺代谢重塑[3]。但在人主动脉瓣膜间质细胞中Piezo1激活是否与YAP依赖的谷氨酰胺代谢相关仍然有待研究。
研究者通过对主动脉瓣膜间质细胞中的谷氨酰胺酶1 (Glutaminase1, GLS1)表达水平以及细胞内代谢物谷氨酰胺和谷氨酸含量的检测,研究者发现Yoda1可促进GLS1表达升高,增强谷氨酰胺代谢,这种效应在钙化瓣膜来源的VICs中表现更明显。由于研究先前发现YAP在VICs中是Piezo1的下游因子,因此接下来将探究YAP是否在调节Piezo1对谷氨酰胺代谢重编程的调控中起关键作用。研究者发现抑制或沉默YAP可抑制Yoda1诱导的GLS1表达和谷氨酰胺代谢。这些结果表明Piezo1-YAP机械转导信号通路可调控谷氨酰胺代谢。
已知GLS1介导谷氨酰胺裂解为谷氨酸,然后谷氨酸进入柠檬酸循环(TCA),产生许多中间代谢物,如乙酰辅酶a。而最近研究表明,乙酰辅酶a是组蛋白乙酰化的乙酰载体,在表观遗传学调控中发挥重要作用。为进一步明确GLS1介导的谷氨酰胺代谢对主动脉瓣间质细胞成骨分化的作用及其机制。研究者使用GLS1抑制剂BPTES处理VICs。结果发现BPTES可减轻Yoda1诱导的VICs成骨分化。接下来,研究者检测了用或不用BPTES预处理的Yoda1诱导的VICs中乙酰辅酶A的浓度,发现Yoda1可诱导VICs中乙酰辅酶A产生增加,而BPTES抑制了乙酰辅酶A的产生。此外,免疫印迹表明Yoda1促进了VICs的H3K27Ac表达水平,而BPTES则抑制了Yoda1诱导的H3K27Ac表达水平。而进一步的ChIP-PCR分析发现Yoda1可增加RUNX2基因启动子中的H3K27Ac富集,而这可被BPTES抑制。同时,研究者也使用了siRNA沉默GLS1,得到相似的结果,即沉默GLS1可抑制Yoda1诱导的RUNX2启动子上的H3K27Ac富集,从而抑制了成骨相关基因RUNX2的表达,抑制主动脉瓣膜间质细胞的成骨分化(图5)。

图5 GLS1-介导的谷氨酰胺代谢通过组蛋白乙酰化调控主动脉瓣膜间质细胞的成骨分化
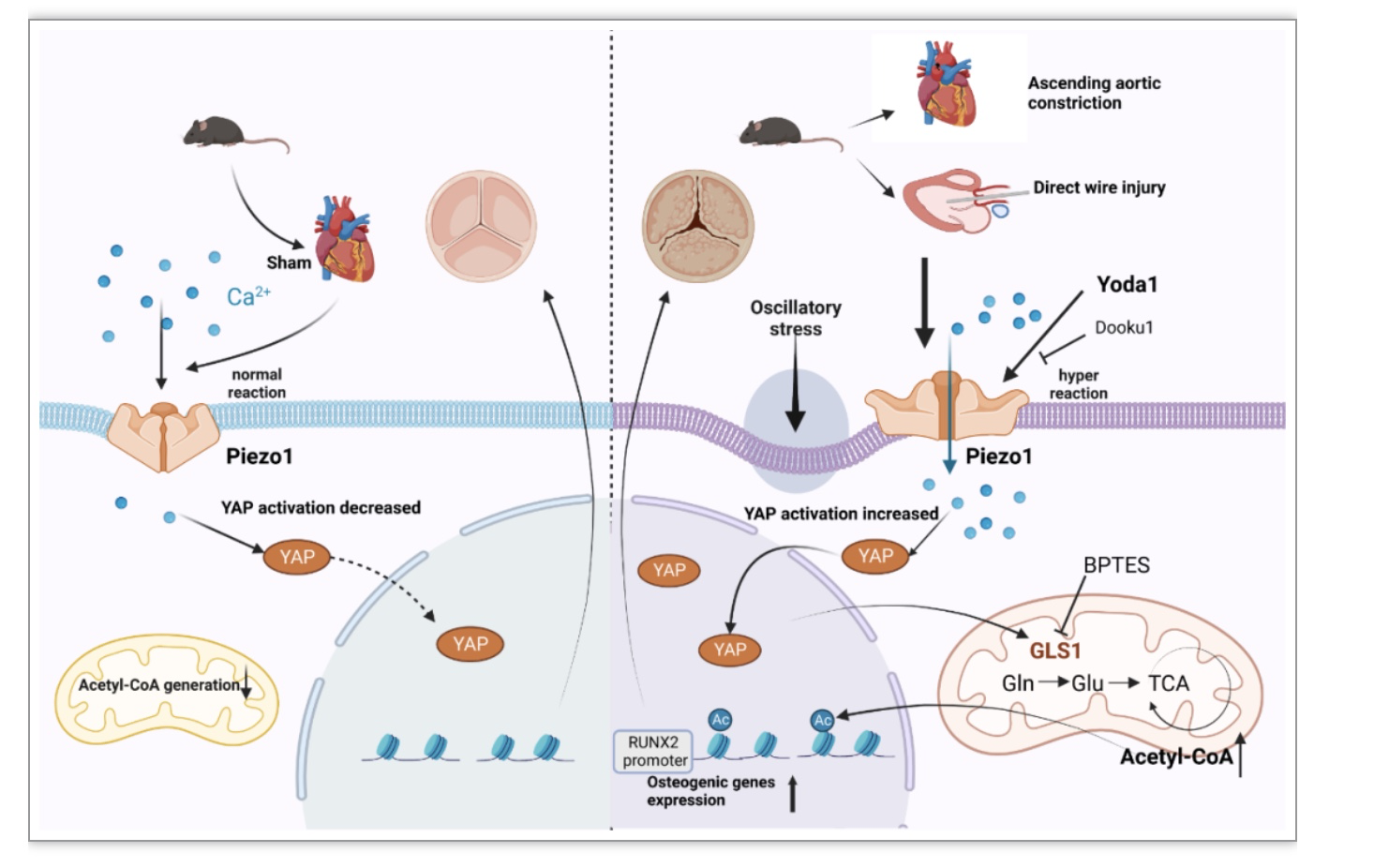
图6 文章总结图
该研究重点关注Piezo1对瓣膜间质细胞的影响,而内皮细胞作为主动脉瓣膜的屏障经常受血流剪切力的刺激,也可存在Piezo1的激活。因此,Piezo1的激活对内皮细胞的影响及其下游对瓣膜钙化的机制仍需进一步探索。

