HS3ST1基因已被全基因组关联研究(GWAS)确定为阿尔兹海默症患者(AD)的遗传风险位点,该酶在AD患者中过量表达,但HS3ST1基因如何促进AD进展的分子机制尚不清楚。
在这一项研究中发现3-O-硫酸化HS含量显著增加,3-O-硫酸化是HS的一个亚群组,研究已经表明3-O-硫酸化HS可以加速 tau的细胞内吞作用。研究结果表明,HS3ST1基因负责AD患者脑组织中升高的3-O-硫酸化HS(Tetra-1)的生物合成从而增加tau的内吞作用。这份研究结果首次揭示了特殊的3-O-硫酸化HS在AD中的作用机制,为进一步研究AD发病机制和对其治疗有重大帮助。另外,这项发现也为今后发展新的AD检测方法提供了分子基础。
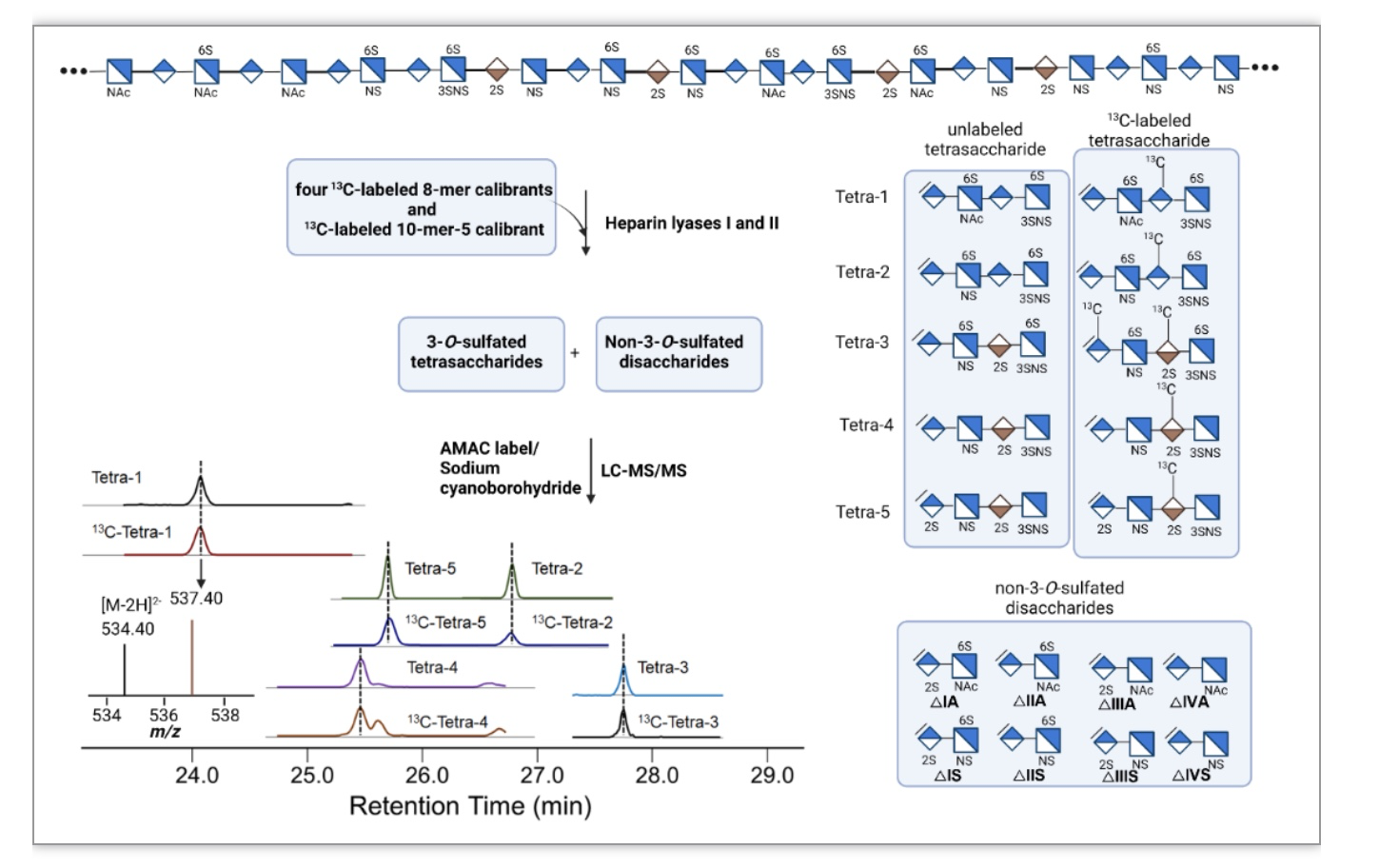
作者团队开发了一种高灵敏的LC-MS/MS分析技术可用于对3-O-硫酸化HS鉴定。 利用13C-标记的3-O-硫酸化的寡糖(八糖和十糖)作为标准品实现了对生物体中低丰度和结构不稳定的3-O-硫酸化的HS四糖结构的表征和定量。作者合成了五种13C-标记的3-O-硫酸化寡糖,包括四种八糖和一种十糖,每个寡糖结构中含有一种特殊结构的3-O-硫酸化的四糖。当生物体中的HS和五种3-O-硫酸化的寡糖标准品经过heparin lyases降解后,寡糖标准品会产生五种13C-标记的3-O-硫酸化的四糖结构,这五种四糖结构作为tracer实现了对HS中未标记的3-O-硫酸化四糖结构表征和定量。因为具有相同结构未标记的四糖在LC上与13C-标记的四糖保留时间一致,然后进行MS/MS分析。通过比较13C-标记的四糖和未标记四糖的MRM峰面积实现定量分析。13C-标记的四糖的分子量比其未标记对应物高6 Da或12 Da。HS经过heparin lyases降解后主要产生八种二糖和微量的3-O-硫酸化四糖,所以在分析过程中,作者还添加了13C-标记的二糖校准品,以确定非3-O-硫酸化二糖的组成。开发的分析方法能实现单个分析过程中检测13种结构,包括了五种3-O-硫酸化四糖和八种非3-O-硫酸化二糖。
图1 3-O-硫酸化HS产物分析示意图
作者分析了四种神经退行性疾病组和健康对照组的大脑额叶皮层中3-O-硫酸化HS的水平。疾病组包括preclinical AD、end-stage AD、frontotemporal lobar degeneration with tau pathology(FTLD_tau)、和Lewy body dementia(LBD)。作者发现在疾病组特定3-O-硫酸化四糖的量发生了变化。实验结果表明在end-stage AD组,Tetra-1(△UA-GlcNAc6S-GlcA-GlcNS3S6S)显著增加(4.24±2.56 ng/mg),相比于对照组(0.60±0.23 ng/mg),增加了7倍(P<0.0005)。End-stage AD组中Tetra-1的质量百分比(1.5±0.66%)比对照组(0.54±0.15%)高2.8倍,表明end-stage AD组中HS的Tetra-1结构域浓度升高。在preclinical AD组,Tetra-1也显著增加(1.72±1.07 ng/mg,P<0.01)。在AD和其他神经退行性疾病患者组中,其他3-O-硫酸化四糖的数量也有显著增加,但增加的程度小于AD组中的Tetra-1。作者还测量不同疾病组中的HS的总量。结果表明preclinical AD和end-stage AD组的HS总量显著增加。
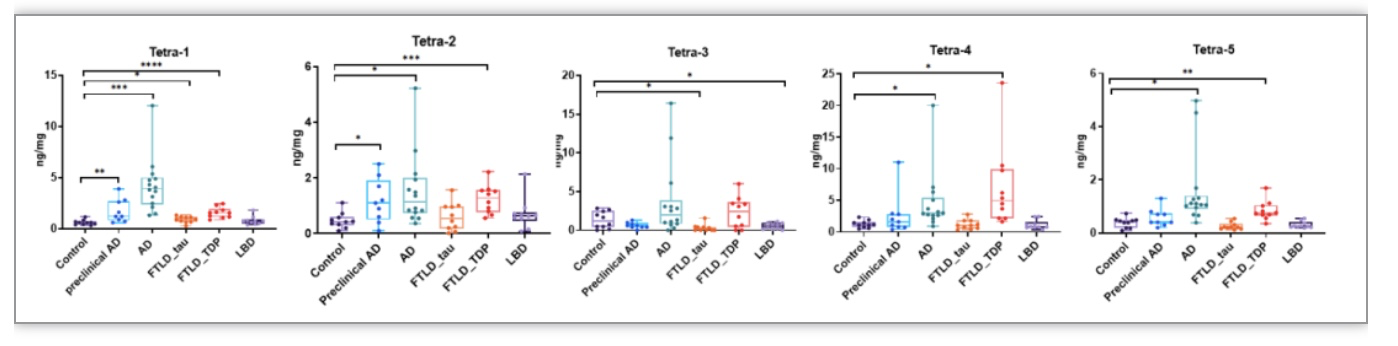
图2 四种神经退行性疾病组和健康对照组的大脑额叶皮层中3-O-硫酸化HS的水平
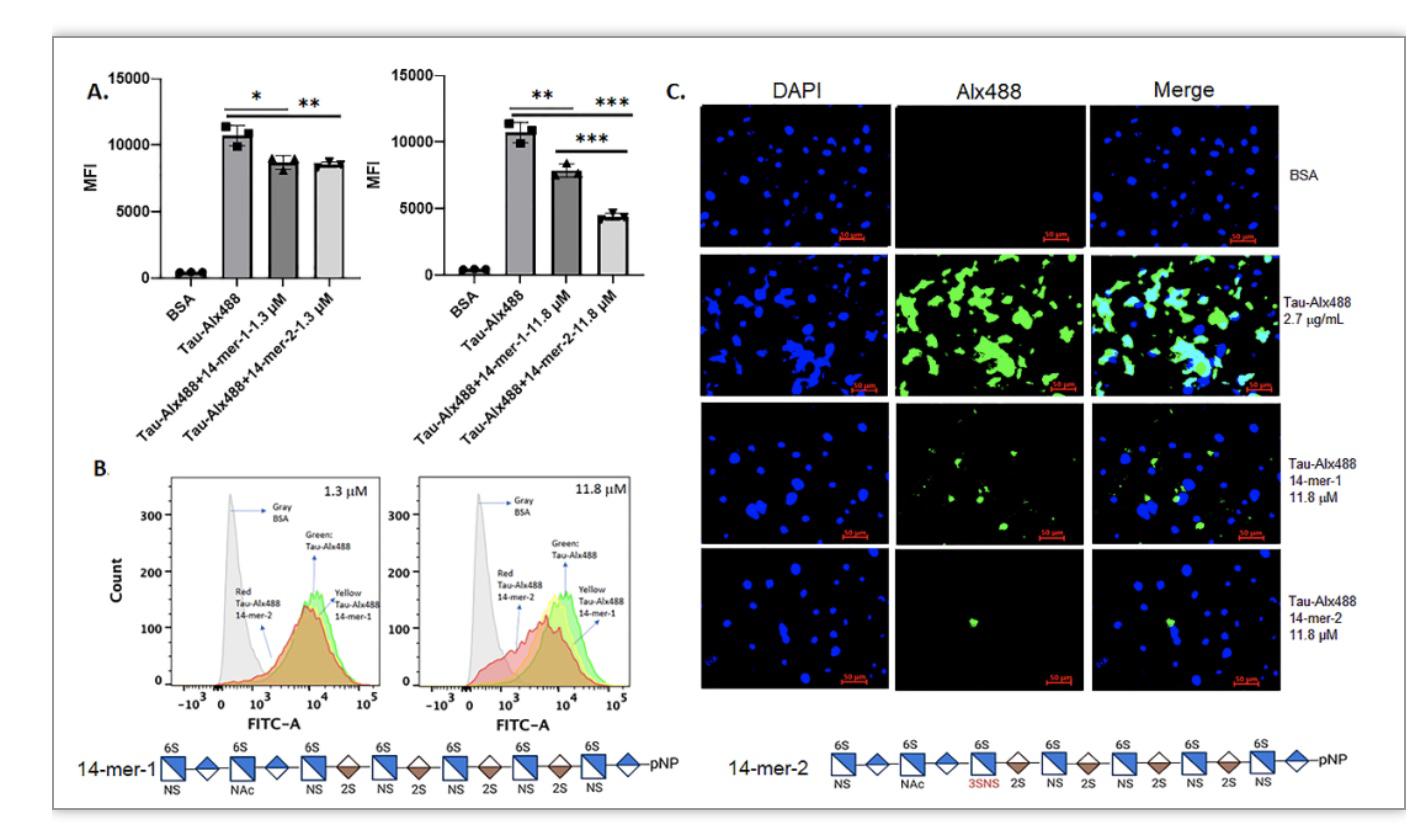
在AD中3-O-硫酸化HS水平升高的一个病理影响是特殊的HS结构增加了tau的细胞内吞作用,促进tau在细胞间传播。为了验证这一假设,作者想知道外源性的3-O-硫酸化HS是否能够阻断tau的细胞内吞作用。研究团队合成了两个十四糖(不含有Tetra-1结构域的14-mer-1和含有Tetra-1结构域的14-mer-2)来研究3-O-硫酸化HS对tau细胞内吞作用的影响。含有Tetra-1结构域的14-mer-2模拟AD大脑中3-O-硫酸化HS的结构。实验结果表明在11.8 μM浓度下14-mer-2对MLE(小鼠肺上皮)细胞tau的内吞抑制作用高于14-mer-1(~2倍)。通过SPR测定,与14-mer-1相比(137 nM),14-mer-2具有更高的结合亲和力(14.4 nM)。此外,团队还证明MLE细胞中的HS含有Tetra-1结构域。实验结果进一步验证了具有Tetra-1结构域的HS与内源性细胞表面的HS竞争结合tau,从而可以抑制细胞tau的内吞作用。
图3 14-mer对tau细胞内化的抑制作用。
作者的研究结果为进一步深入研究HS在AD进展中的贡献以及开发AD的治疗方法和生物标志物提供了大量证据。外源性的3-O-硫酸化HS寡糖可以与tau相互作用从而抑制tau 的细胞内摄取和细胞间传播。然而将高度硫酸化的寡糖通过血脑屏障传输到神经元细胞使这种潜在的治疗方法具有一定的挑战性。另一种替代方法是设计能够穿越屏障并抑制3-OST-1活性的小分子抑制剂。已经报道了一种小分子基底能够抑制3-OST-1活性,从而可能阻断Tetra-1结构域的合成。作者研究结果还表明Tetra-1可以作为AD诊断潜在的标志物。为了开发诊断技术,作者接下来的研究目标是在AD患者的血液,脑脊髓液或者尿液中监测HS的变化。
总结起来,作者报道了一种LC-MS/MS方法,用于分析患有AD和其他神经退行性疾病的患者脑组织中HS的结构组成。作者的实验结果成功建立了特定的3-O-硫酸化HS结构域和HS3ST1基因之间的联系。作者的研究结果为研究AD进展机制提供了一个新的分子靶点。