作为生物体的主要遗传物质,DNA包含着丰富的遗传信息。细胞的正常生长依赖于基因组的完整性和稳定性。细胞内的DNA经常受到内源和外源各种因素的破坏,比如DNA复制错误、染色体分离错误、氧化应激、化学物质、辐射、生物病原体等。这些因素会导致基因组出现各种损伤,比如点突变、单链和双链断裂等。随着进化过程的推进,生物体逐渐形成多种完善的DNA损伤修复系统,以有效应对不同原因导致的DNA损伤。DNA双链断裂(DNA double-strand breaks,DSBs)是最具细胞毒性的DNA损伤之一。在真核生物中,DSBs主要有两种修复方式,分别是非同源末端连接(Non-homologous end-joining,NHEJ)和同源重组修复(Homologous recombination repair,HR)。其中,HR因需要同源模板进行修复而具有高保真性,其对于维持基因组的完整性至关重要,但目前对于细胞如何精确调控同源重组修复还不是很清楚。

研究发现糖酵解途径的关键酶——甘油醛-3-磷酸脱氢酶(GADPH)可以在DNA双链断裂诱导剂,如电离辐射(IR)等的作用下被Src信号介导进入细胞核。入核的GAPDH与去乙酰化酶HDAC1发生相互作用,将HDAC1从其抑制分子Maspin上解离,从而释放HDAC1的活性。HR的关键蛋白RAD51在被HDAC1去乙酰化后更稳定地存在于DNA双链断裂位点,促进同源重组修复(图1)。这一研究结果不仅明确了乙酰化修饰对于RAD51蛋白稳定性及同源重组修复效率的重要性,同时还揭示了GAPDH除了糖酵解酶之外,其蛋白本身在HR修复中的重要调节作用。这为全面理解细胞内代谢酶和同源重组修复的精确调控提供了新的认识。
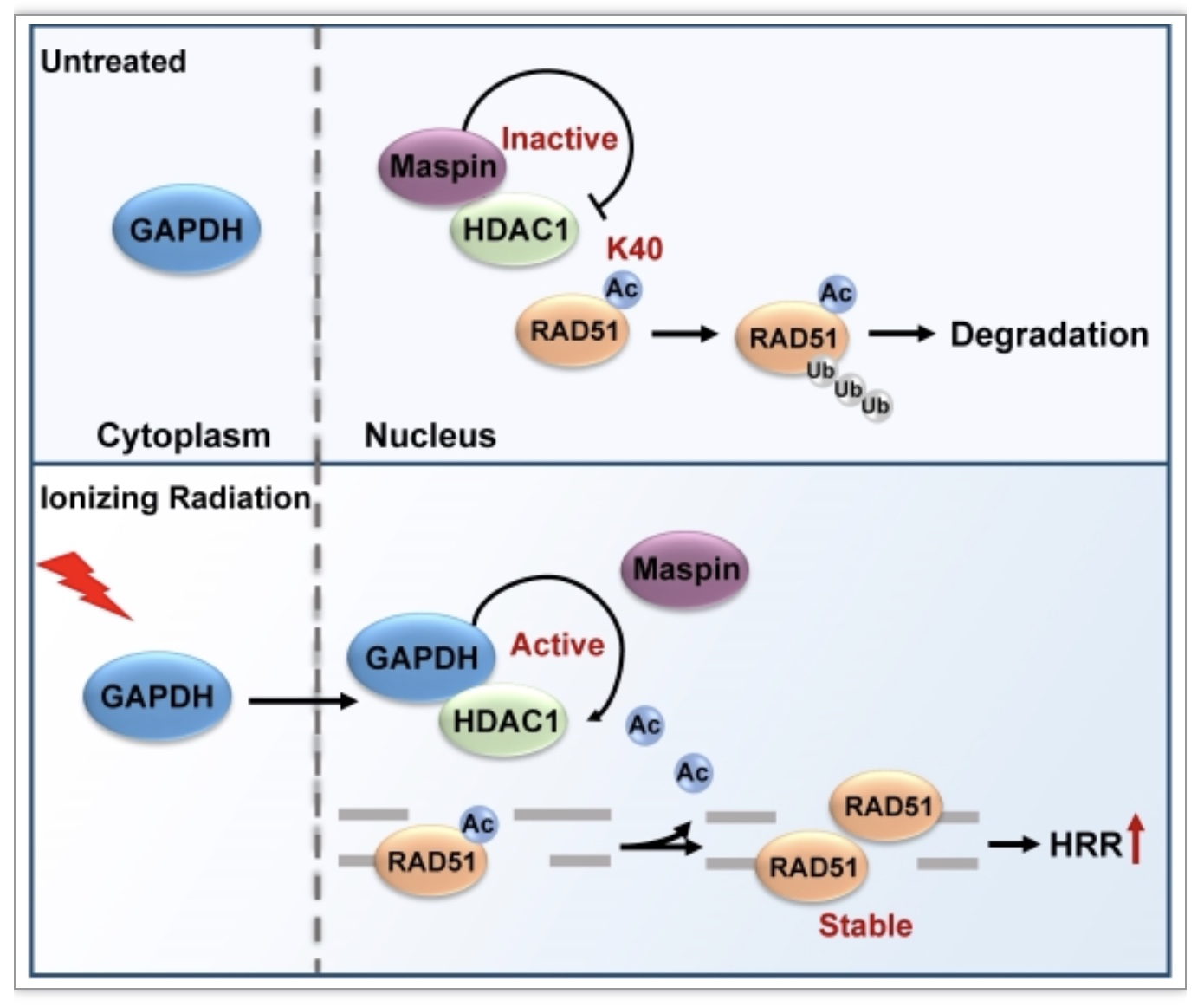
图1 GAPDH参与同源重组修复机制图
研究者首先发现DSB诱导剂及电离辐射(IR)的处理均引起了细胞中GAPDH的入核,先前研究表明在诱导DNA 单链损伤后,Src信号被激活进而引起胞质中GAPDH的入核,结合已有研究,研究者检测到IR处理后同样诱导了Src 信号的激活,证明Src 信号在这一过程中的重要作用。随后,研究者发现在不同的DSB诱导条件下,内源的GAPDH与DSB损伤标志蛋白gH2A存在相互作用,提示GAPDH可能与DSB修复相关(图2)。
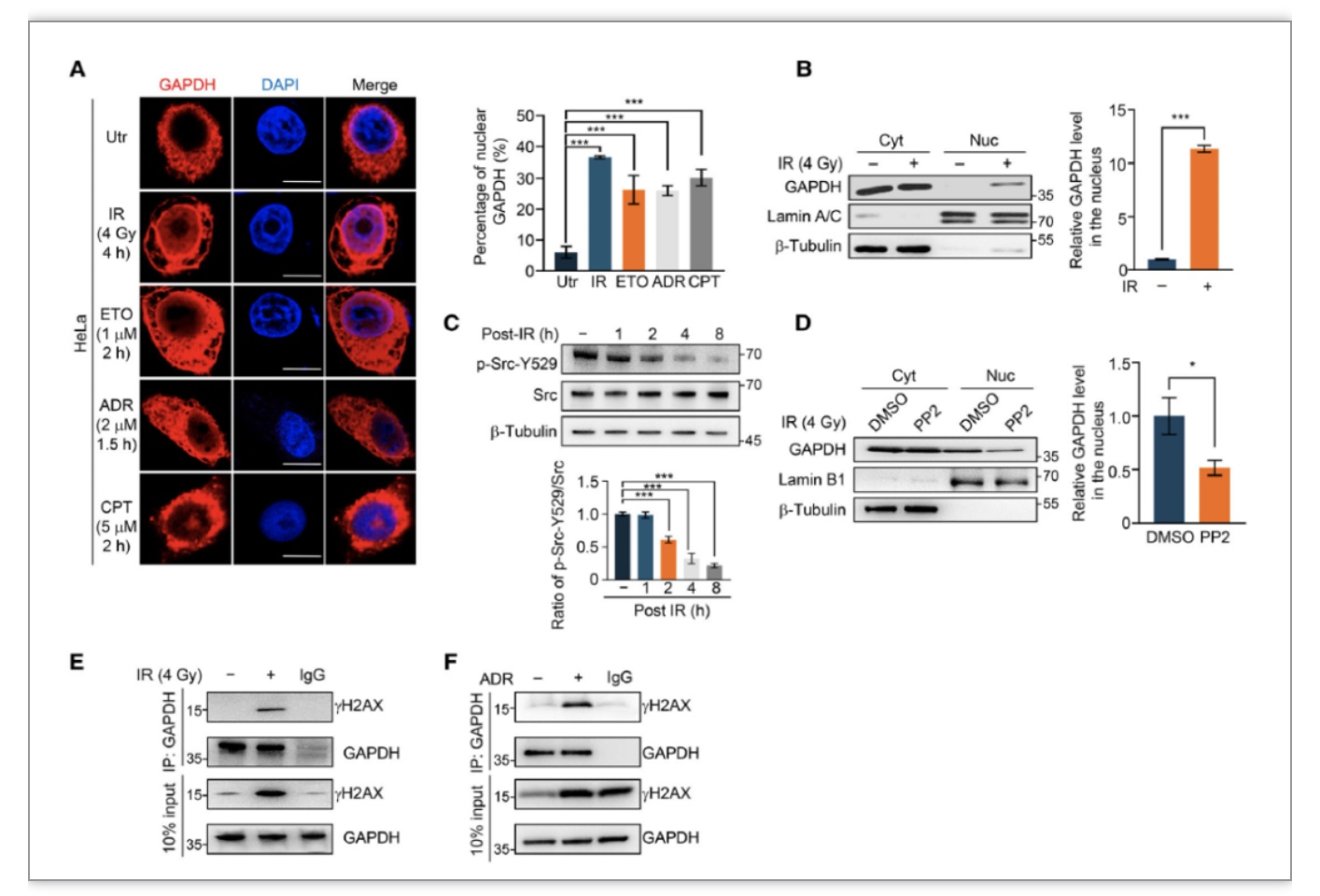
图2 GAPDH响应DNA双链断裂损伤进入细胞核
为了进一步评估GAPDH在DSB修复中的作用,研究者发现敲降GAPDH显著降低了ADR和电离辐射IR处理后的细胞存活率,并通过免疫荧光及中性彗星发现IR处理后GAPDH敲降细胞中DNA损伤的积累。随后,作者检测了IR处理后不同时间点gH2AX水平,发现GAPDH敲降细胞中所有时间点都存在更多的gH2AX,证明了GAPDH在DSB修复中发挥重要作用(图3)。并且研究者发现在敲低GAPDH后,同源重组修复中的关键蛋白RAD51的水平降低,IR诱导形成的foci点也相应减少。蛋白质稳定性检测后也发现GAPDH的缺失降低RAD51的蛋白质稳定性(图4)。
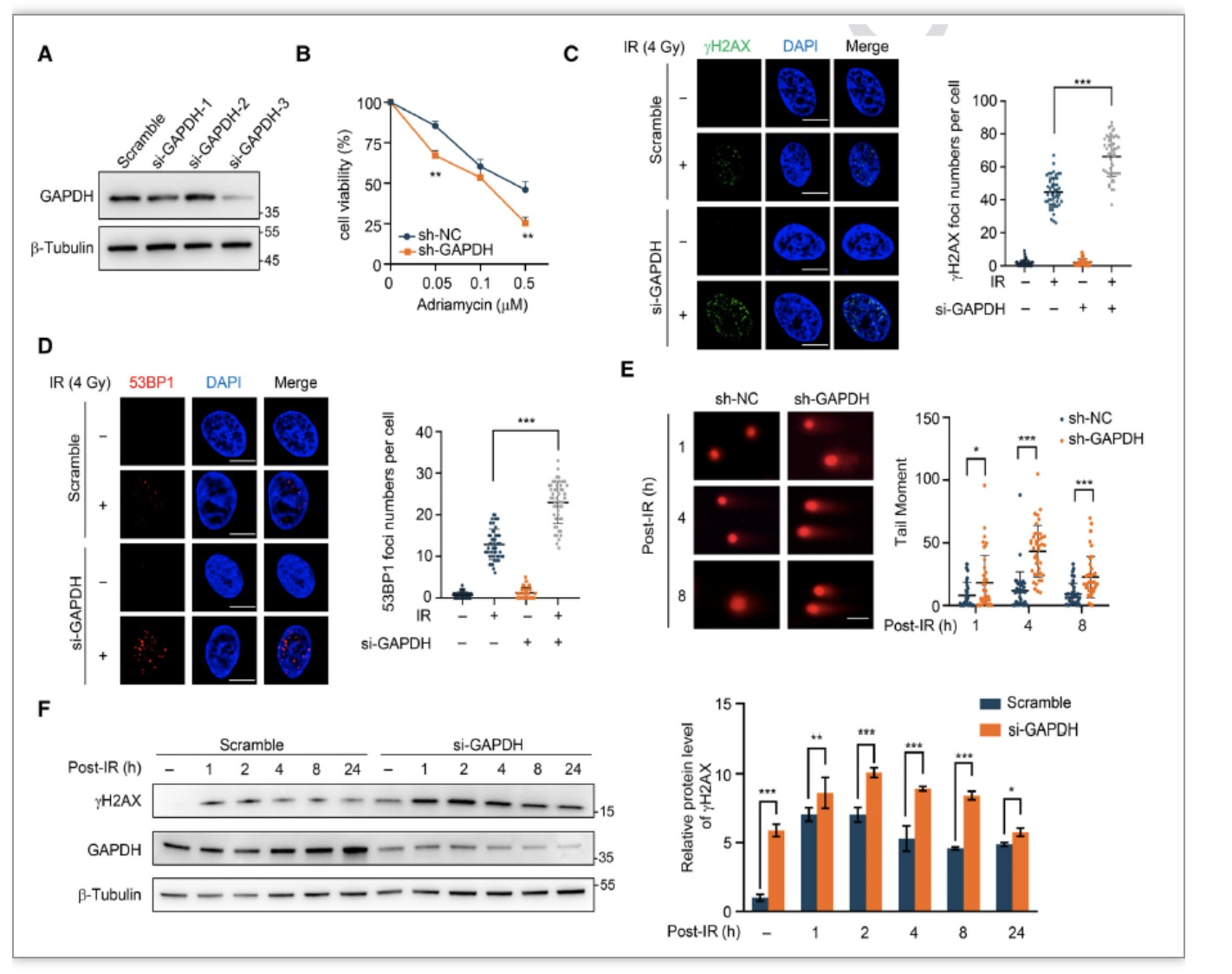
图3 GAPDH响应DSB修复
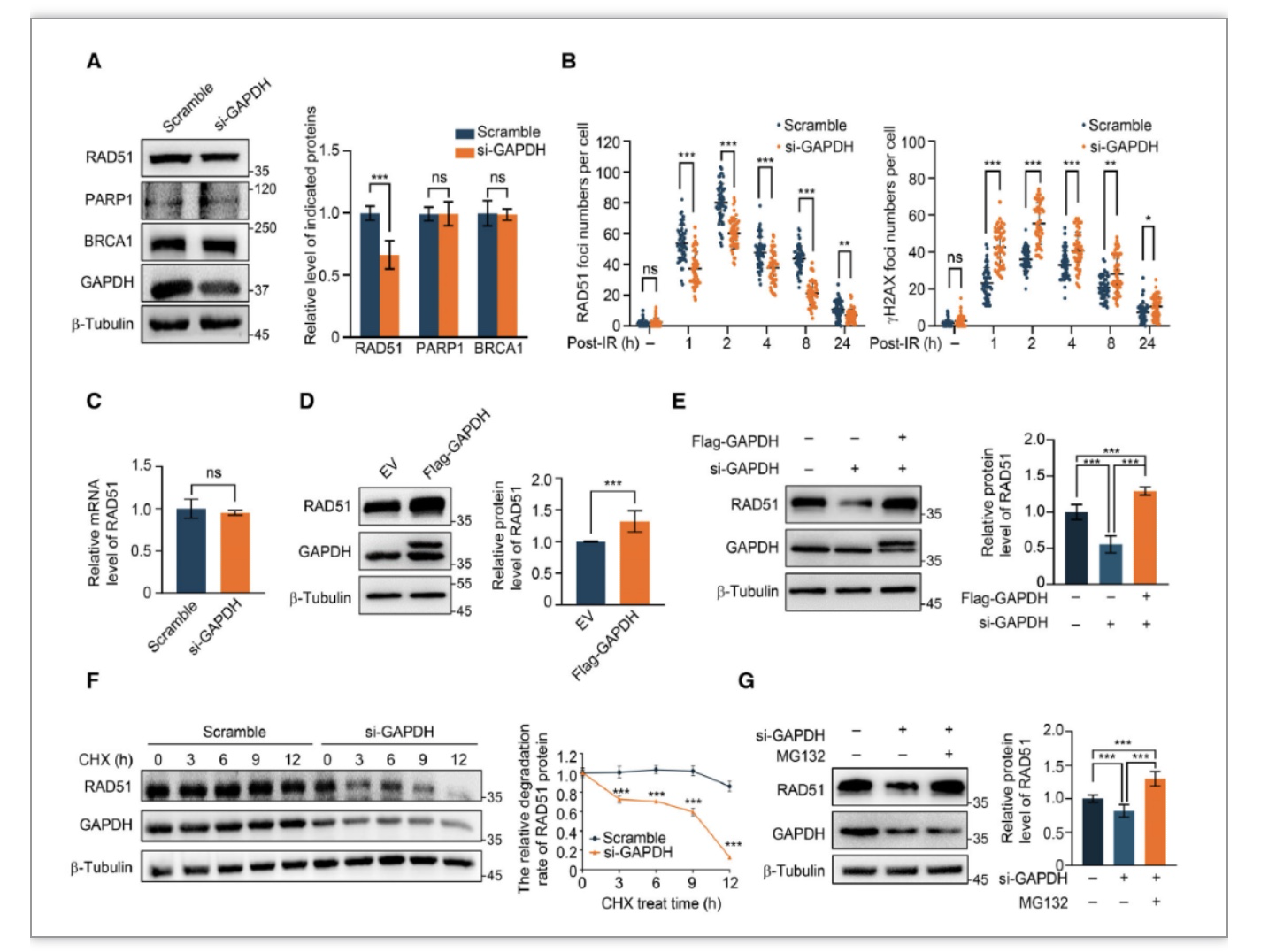
图4 GAPDH调节RAD51的蛋白质稳定性
前期已有报道去乙酰化酶抑制剂TSA,VPA等处理会引起RAD51蛋白水平降低,为了进一步评估RAD51是否发生乙酰化修饰及乙酰化修饰对RAD51蛋白稳定性的作用,研究者首先检测到TSA处理降低了RAD51蛋白稳定性,并证明了RAD51能够发生乙酰化修饰。通过体外乙酰化修饰以及质谱分析,明确了五个RAD51的乙酰化位点,接着通过分别构建相应位点的突变体,证明了RAD51中Lys40的乙酰化通过泛素蛋白酶体途径促进了RAD51的降解(图5)。
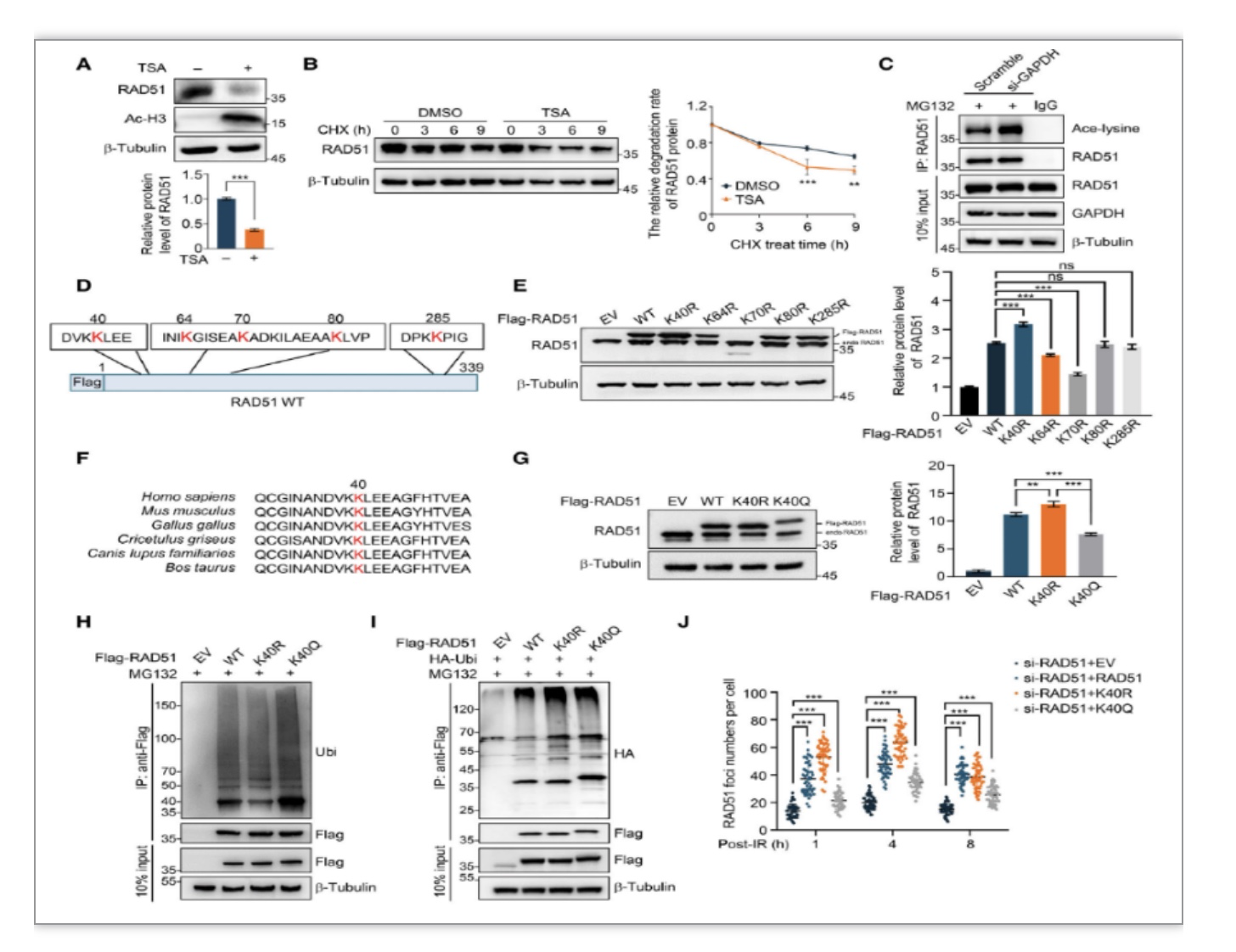
图5 RAD51 K40位点乙酰化修饰影响其蛋白质稳定性
随后,研究者发现GAPDH与组蛋白去乙酰化酶1(HDAC1)存在相互作用,并明确了敲降GAPDH后HDAC1酶活的降低研。并且研究者进一步证明在DSB发生后,GAPDH与HDAC1活性抑制蛋白Maspin竞争性结合HDAC1,从而正向调控HDAC1酶活(图6)。同时研究者还发现HDAC1的乙酰化酶活性对于f调控RAD51蛋白水平非常重要。为了进一步探究HDAC1在GAPDH调控DSB机制中的具体作用,研究者利用免疫荧光等实验发现过表达HDAC1可以回补GAPDH的敲低后RAD51的蛋白水平,并且降低了DSB损伤标志物gH2AX的水平。综上,研究者阐明了了HDAC1是介导GAPDH调控的RAD51表达及HR修复的去乙酰化酶(图7)。
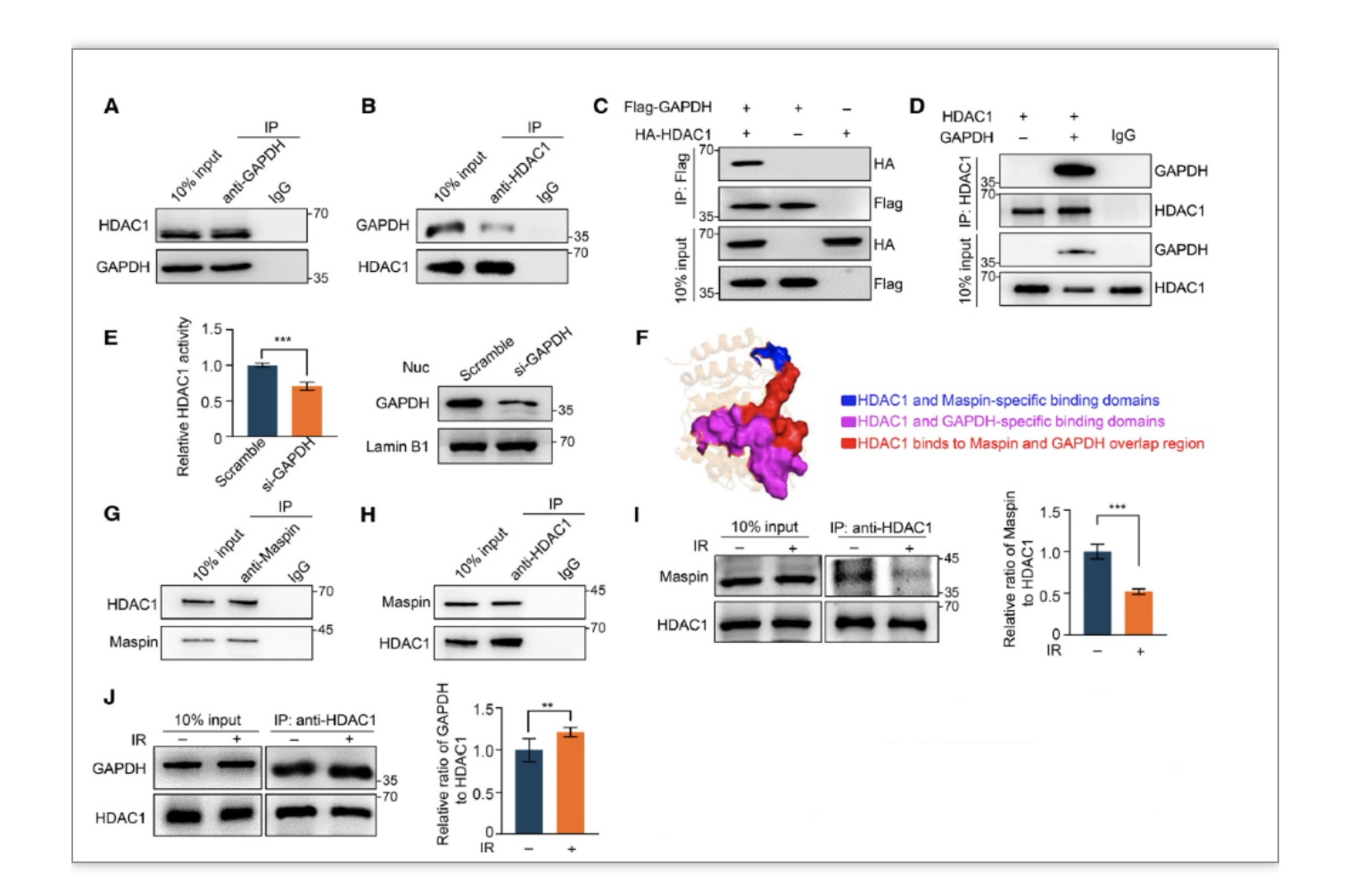
图6 GAPDH与Maspin竞争结合HDAC1

图7 HDAC1去乙酰化RAD51并介导GAPDH在HR中的功能
综上所述,该研究表明GAPDH通过与HDAC1结合并增强其活性来调节RAD51乙酰化和稳定性,揭示了GAPDH在酶活之外参与HR修复的重要机制。由于重组普遍存在的IR抗性与同源重组修复的增强相关,这一发现为开发GAPDH靶向癌症治疗方法奠定了基础。

