脱发是一种全球范围内广泛发生的毛发异常脱落,包括病理性脱发、长期压力、衰老等多种原因引起的脱发。最新调查显示,全球面临脱发低龄化和普遍化,其中男性脱发更为常见。脱发由于影响形象和职业路径而给患者带来较为严重的心理负担。然而,对于多种类型的脱发和毛发再生的细胞分子机制仍缺乏深入研究。研究结果显示miR-205通过同时靶向肌动蛋白网络中的多种重要组分和调节子,并以此改变毛囊隆突干细胞(bulge stem cells-BuSCs)和hair germ (HG)毛发祖先细胞的硬度和肌动蛋白收缩性等力学特性,从而促进年轻和老年小鼠毛发再生。这项研究结果为治疗脱发和促进毛发再生提供了新的思路。

毛发的再生依赖于毛囊周期正常有序的循环。毛囊周期包括休眠期(telogen)、生长期(anagen)和衰退期(catagen)[1]。毛囊干细胞的更新和分化在毛囊周期正常有序的循环中起着至关重要的作用。干细胞和其微环境通过不断地感受和应答外源和内源的信号来调控组织再生。对于机械力,细胞能够通过调控细胞外微环境,例如胞外基质的硬度(stiffness),和细胞内机械力生成机器-细胞骨架这些物理特性来对其作出反应[2]。因此,硬度和肌动蛋白收缩性是动物细胞用来构建组织所必需的力学特性。休眠期毛囊干细胞,包括隆突干细胞(BuSCs)和HG毛发祖先细胞,它们在毛发再生中具有不同的功能。例如,毛发再生起始于HG细胞而不是BuSCs的激活和增殖[3]。然而,它们是否拥有不同的力学特性,力学特性的改变是否与毛发再生相关这几个重要问题仍然不完全清楚。同时,直接观察干细胞在组织维护和再生过程中的动态行为一直是个很大的挑战。易睿课题组的汪晶晶博士利用双光子激光活体动物追踪扫描,发现在休眠期和生长期早期,BuSCs处于相对静止稳定状态,大小没有明显改变,也没有细胞分裂发生。与之相反的是,休眠期HG细胞处于体积增大和缩小的动态变化过程中(图1a,b)。原子力显微镜检测发现,HG细胞相对柔软(图1d)。利用细胞免疫染色技术发现,肌动蛋白网络强度和其收缩性比BuSCs细胞弱,表现为F-actin网络重排,水平降低。同时和肌动蛋白收缩性直接相关的磷酸化MLC2(pMLC2)蛋白水平降低(图1e, f)。然而,从休眠期转换到生长期时,HG细胞减少缩小的频率 (图1c),同时重排肌动蛋白网络、减弱肌动蛋白收缩性(表现为pMLC2水平降低),细胞硬度降低,使得机械力传导因子YAP在细胞核中积累,细胞重新进入细胞周期进行分裂引发毛发再生(图1)。这些结果将不同的力学特性与毛囊干细胞的行为与功能联系起来。然而,是否能够通过调控毛发干细胞的力学特性来控制其动态行为和功能仍然未知。
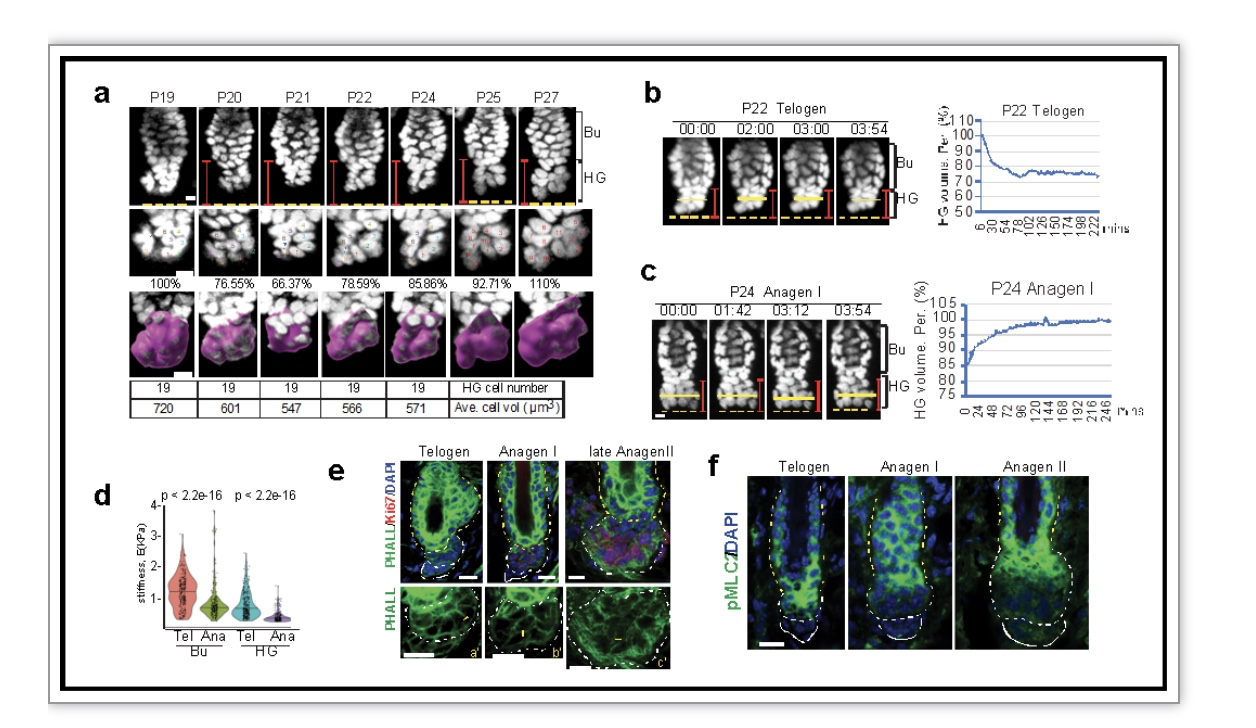
图1.不同分区的毛囊干细胞在激活过程中显示出不同的机械硬度和肌动蛋白收缩性
通过基因组高通量同时捕捉miRNA和靶标基因mRNA的直接相互作用并发现miR-205能够同时靶向肌动蛋白网络中的许多重要组分和调节子。因此miR-205可能有能力调控肌动蛋白网络的力学特性。利用细胞免疫染色检测和其他功能分析发现miR-205参与了调控毛囊干细胞的激活和毛发再生过程。从休眠期到生长期转变的过程中,BuSCs和HG 细胞中miR-205表达量上调。遗传学和双光子激光扫描显微术研究表明诱导miR-205高表达能促进年轻和老年小鼠毛发再生,提前进入毛发生长期(图2a,b)。同时发现miR-205能够减小BuSCs和HG细胞的硬度(图2c)。细胞免疫染色结果显示miR-205能够减弱肌动蛋白收缩性,表现为肌动蛋白网络水平降低,网络重排和pMLC2水平降低(图2d,e)。此外,研究者发现miR-205能够减弱HG区域的收缩性、激活HG细胞使其提前进入细胞周期,分裂增殖(图2f,g)。

图2. MiR-205调控毛囊干细胞力学特性促进发毛再生
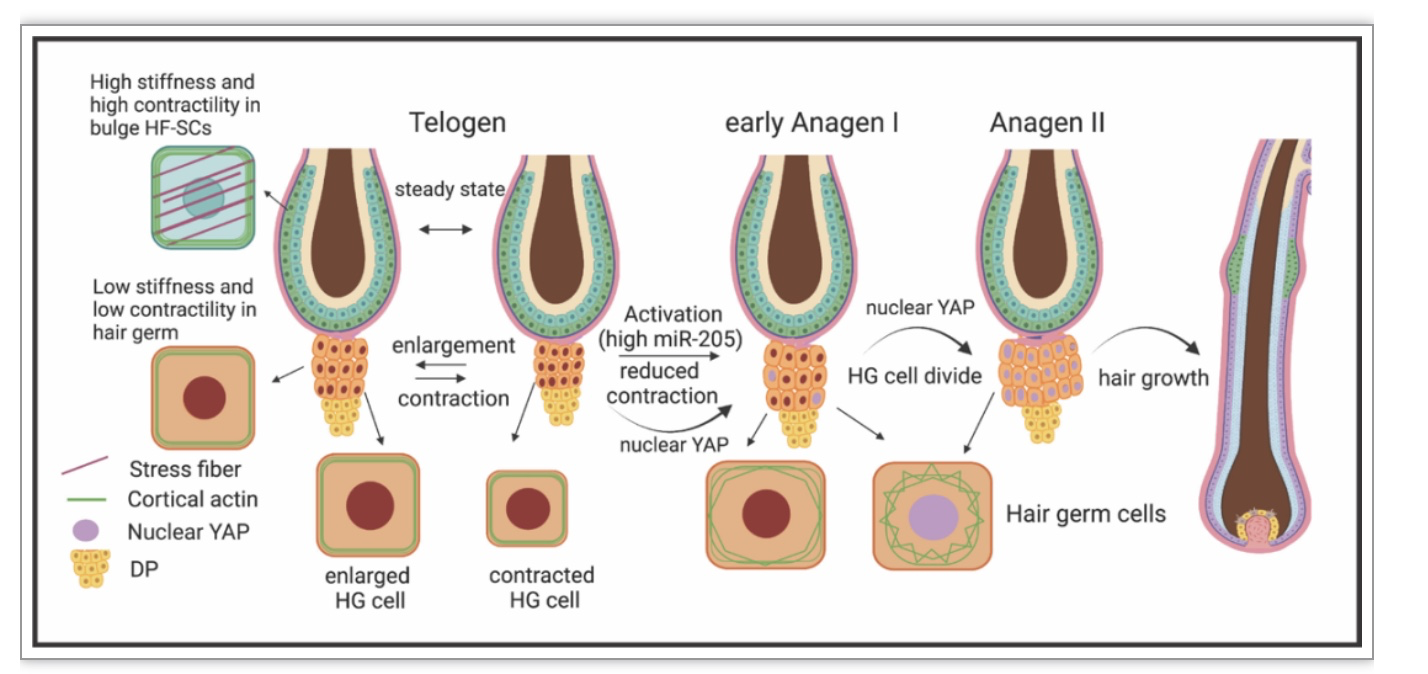
综上所述,这项研究首次揭示了不同区域毛囊干细胞包括BuSCs和HG拥有不同的力学特性,包括硬度和肌动蛋白收缩性,以控制细胞的大小和行为动态,使它们在毛发再生过程中表现出不同的功能。MiR-205能够通过降低BuSCs和HG的硬度以及肌动蛋白收缩性等力学特性、减弱HG区域的收缩性、增加机械力传导因子YAP在细胞核中的累积从而促进毛发再生。该研究揭示了干细胞感应和应答机械力改变并以此调控功能的新机制。后续研究会继续分解深层调控机制以及探索能否将研究结果转化为促进人类毛发再生的新方法。

