肺泡上皮细胞(AECs)是维持肺功能稳定的重要细胞[1],也是肺衰老的主要靶细胞。AECs衰老是许多慢性肺部疾病的共同病理机制。单细胞转录组分析揭示了特发性肺纤维化患者肺部存在大量衰老AECs [2]。消除衰老细胞可抑制肺纤维化[3]。因此,靶向衰老AECs对于治疗年龄相关性慢性肺疾病至关重要。
该研究探讨了环氧二十碳三烯酸(EETs)在抗AECs衰老中的作用,发现EETs可通过Trim25增强Keap1泛素化降解,促进Nrf2入核发挥抗氧化作用,进而抑制内质网应激(ERS),减轻AECs衰老。该研究创新性提出EETs可作为一种新型内源性抗衰老物质,为防治年龄相关慢性肺部疾病提供新思路。

为了阐明衰老AECs中EETs的变化,作者采用BLM、H2O2或阿霉素体外建立衰老AECs模型[4, 5]。LC-MS/MS显示衰老的MLE12细胞中14,15- EET含量降低(图1A-B)。在衰老的MLE12细胞中,EETs合成酶Cyp2j6 mRNA增加,而表达丰度最高的Cyp2j9 mRNA没有变化(图1C-D)。而EETs降解酶sEH蛋白表达显著增加,并与p16和γH2AX的表达呈正相关(图1E-H)。
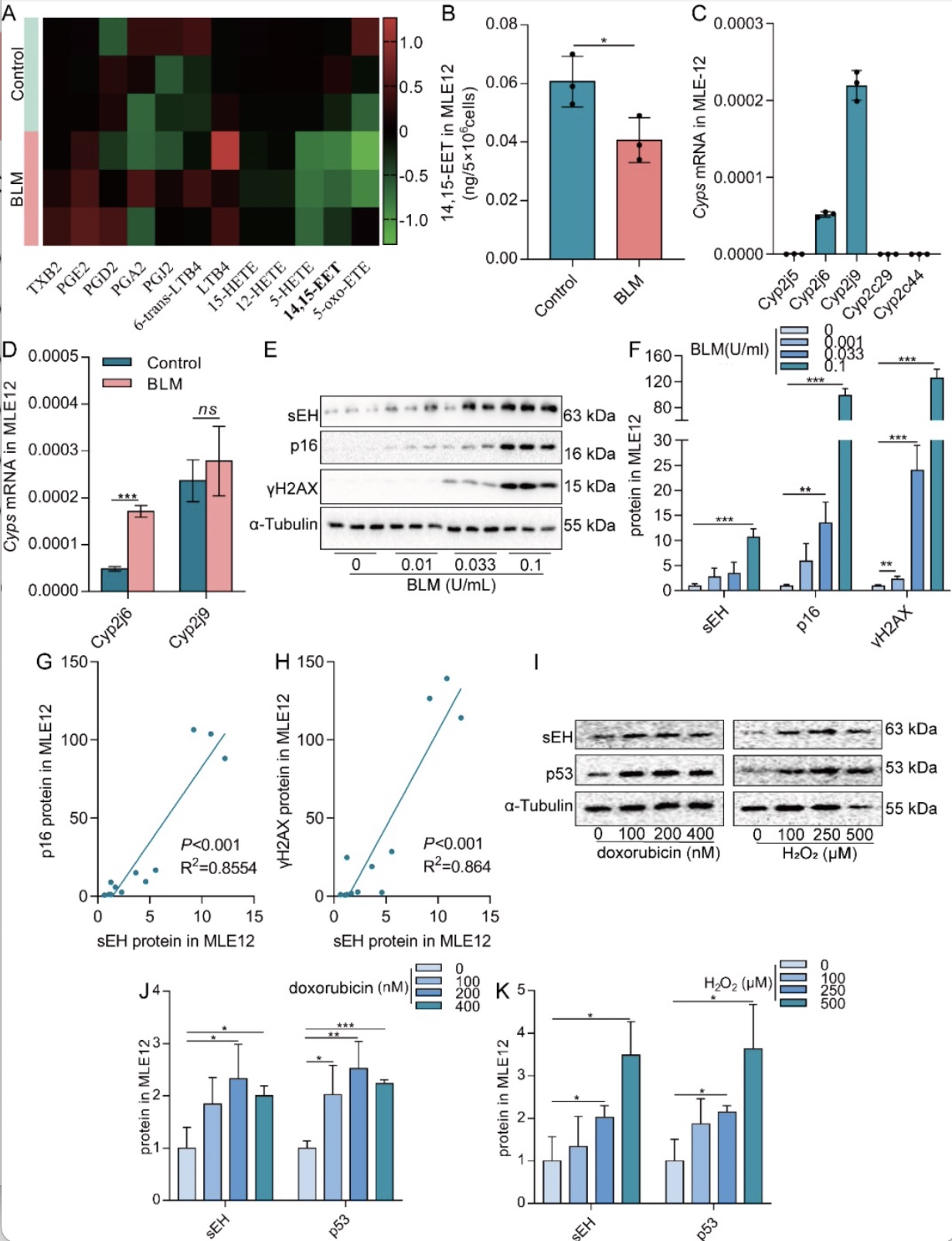
图1 AECs衰老与EETs含量降低相关
(图源:CY Zhang et al., Redox biology, 2023)
进一步采用sEH抑制剂TPPU、过表达CYP2J2或外源性EETs处理MLE12细胞,观察到不同手段增加胞内EETs均可显著减少β-gal阳性细胞数量及衰老相关蛋白的表达(图2A-N),同时发现14,15-EET可降低BLM诱导的MLE12细胞的SASP组分Tnf-α、Il-1β、Il-8、Mcp1和Mmp12的mRNA表达(图2O)。这些结果提示EETs具有减轻AECs衰老的作用。
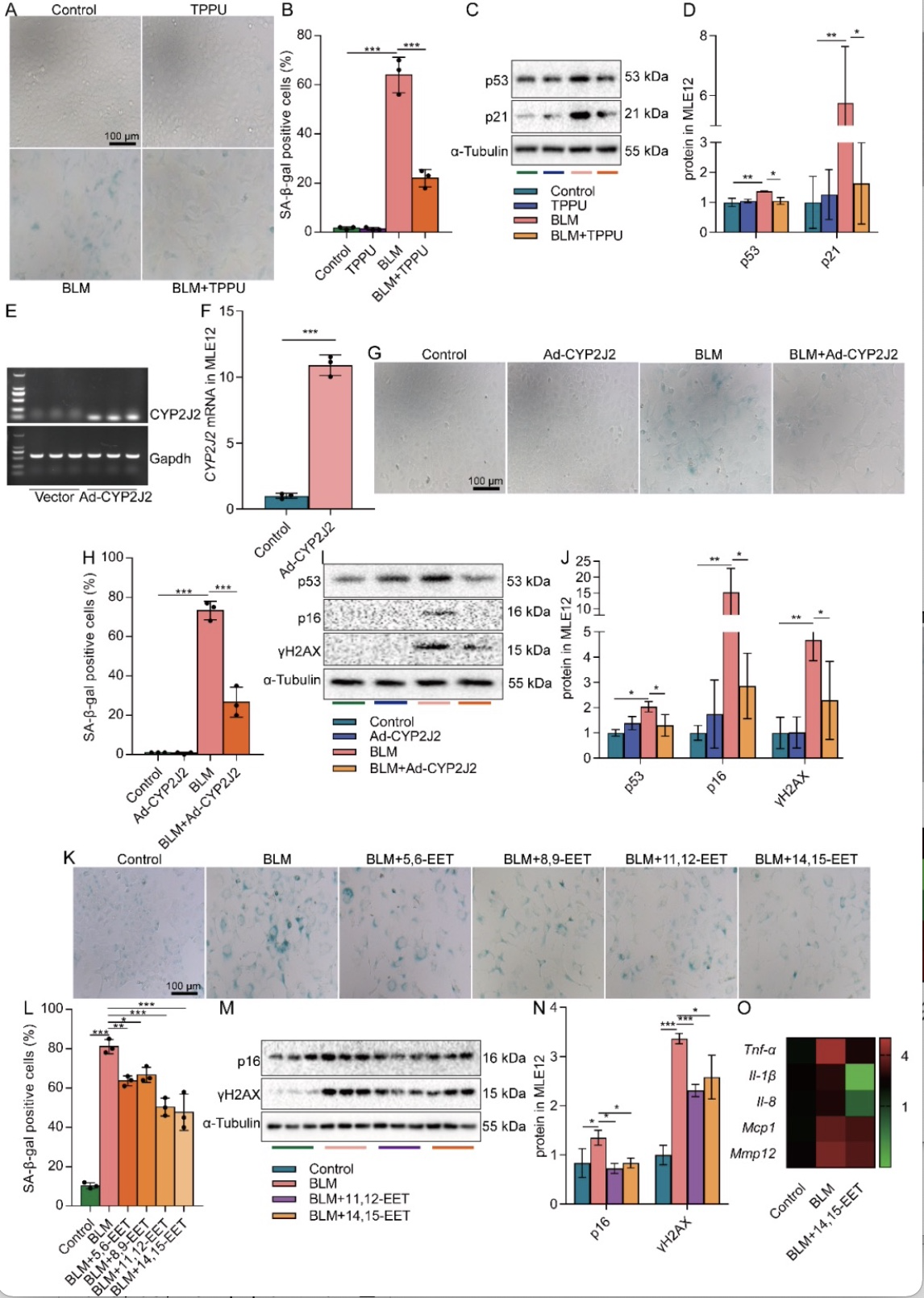
图2 增加EETs可减缓AECs衰老
(图源:CY Zhang et al., Redox biology, 2023)
ERS是细胞衰老不可或缺的机制之一[6]。作者发现在BLM处理的MLE12细胞中ERS增强。Ad-CYP2J2(图3A-B)、TPPU(图3C-D)或外源性EETs(图3E-F)可降低衰老MLE12细胞中ERS相关XBP1s和ATF6蛋白的表达,使用ERS诱导剂衣霉素(TM)激活ERS可以消除外源性EETs和TPPU的抗衰老作用(图3G-L)。表明EETs可通过抑制ERS缓解AECs的衰老。进一步作者发现EETs通过Nrf2发挥抗氧化作用(图4A-C)。在抑制Nrf2后,EETs减缓AECs衰老及减轻ERS的作用被消除(图4C-E)。表明EETs通过Nrf2发挥抗氧化作用,从而减轻AECs的ERS和衰老。
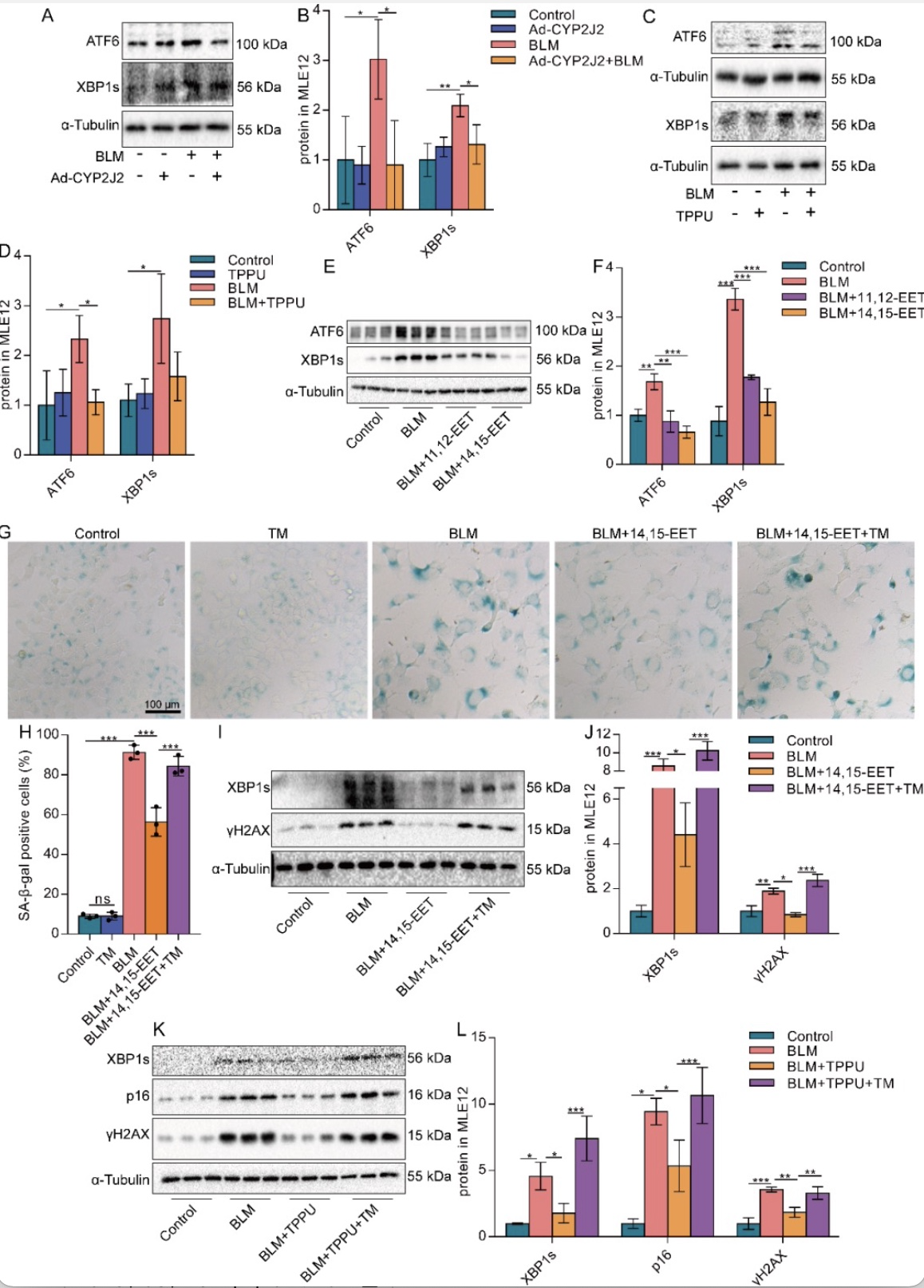
图3 EETs通过抑制ERS减缓AECs衰老
(图源:CY Zhang et al., Redox biology, 2023)
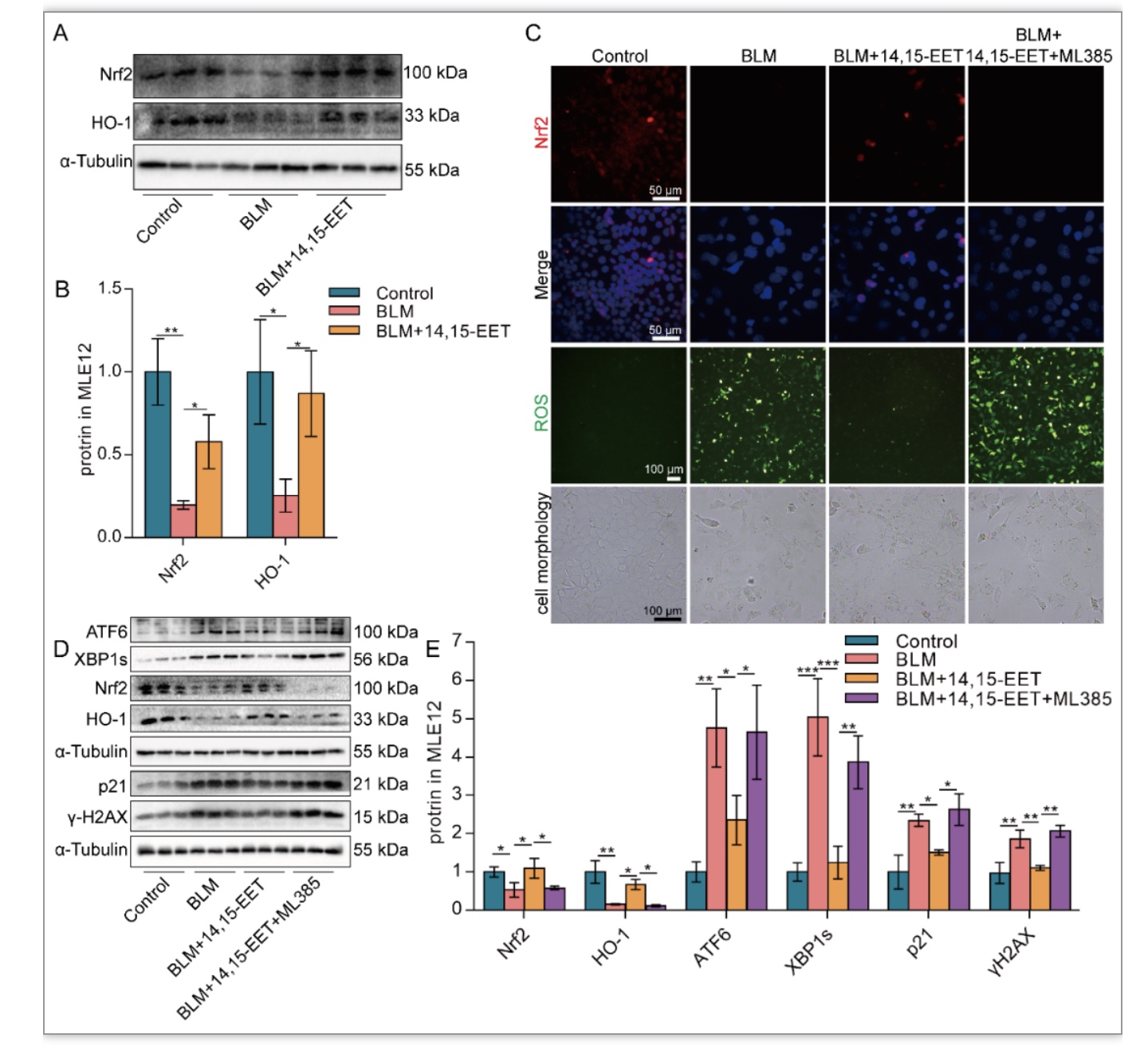
图4 EETs通过Nrf2发挥抗氧化作用减缓AECs的ERS和衰老
(图源:CY Zhang et al., Redox biology, 2023)
Keap1是Nrf2的负调控因子,可以与Nrf2形成聚合物,阻止Nrf2进入细胞核[7]。作者为了进一步探讨EETs促进Nrf2入核及表达是否与Keap1有关。通过Real-time PCR及Western blot等系列实验发现14,15-EET通过促进Keap1泛素化降低衰老MLE12细胞中Keap1蛋白水平(图5A-D)。并且进一步发现EETs可通过上调E3泛素连接酶Trim25的表达,促进Keap1泛素化(图5E-I,图6),减缓AECs衰老(图7)。
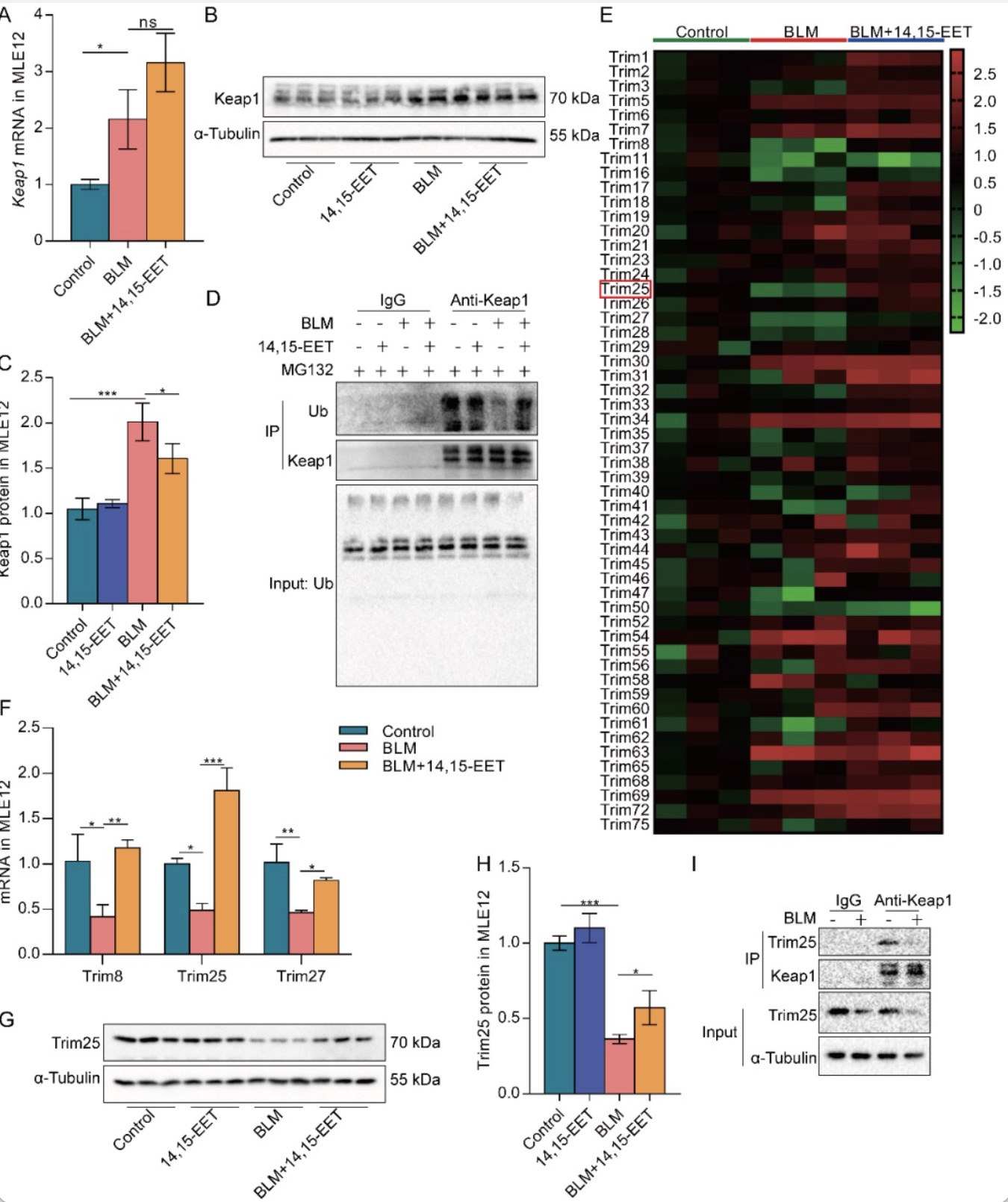
图5 EETs可增加Keap1泛素化水平和E3泛素连接酶Trim25的表达
(图源:CY Zhang et al., Redox biology, 2023)
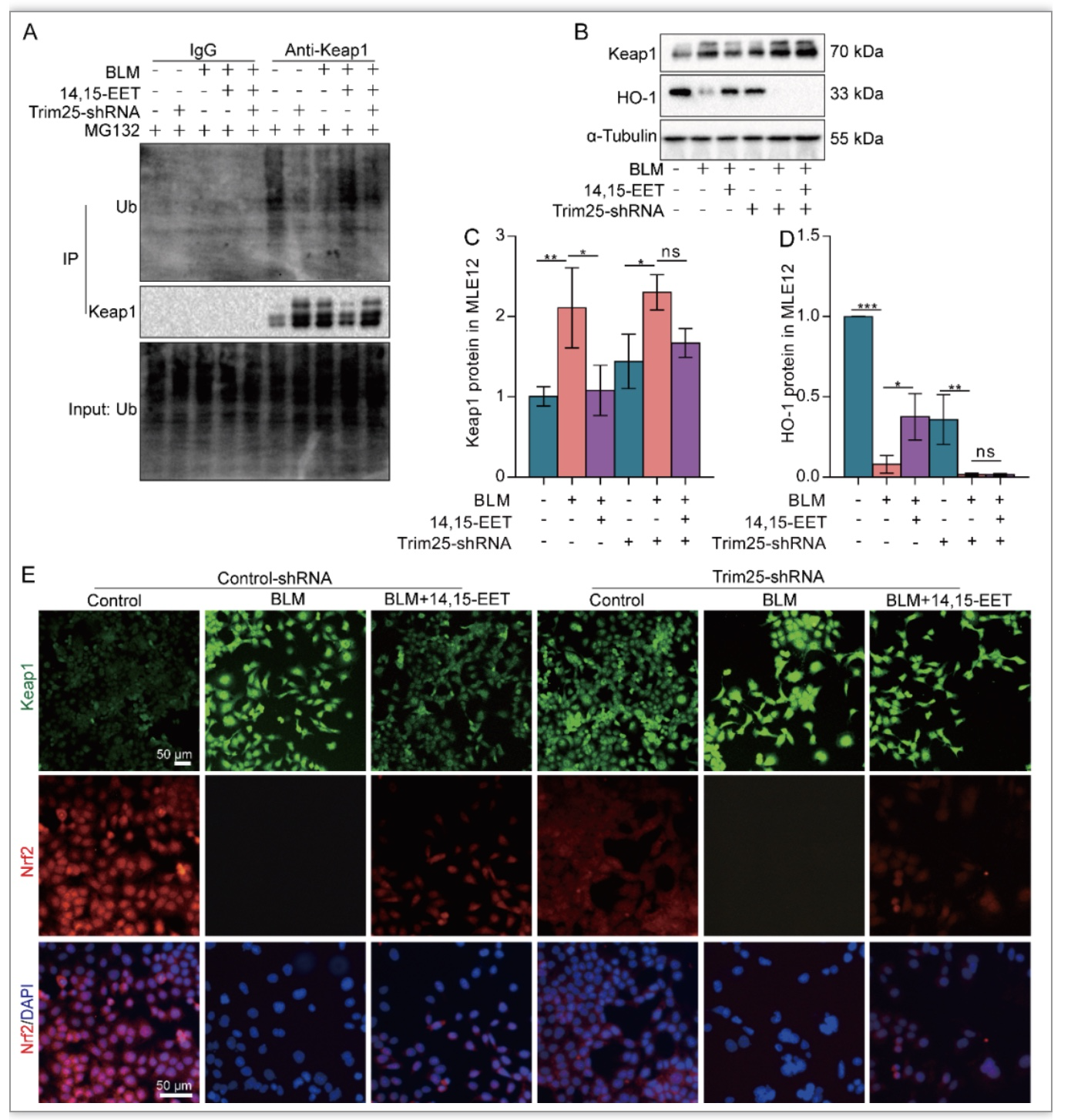
图6 EETs通过Trim25泛素化Keap1促进Nrf2入核
(图源:CY Zhang et al., Redox biology, 2023)
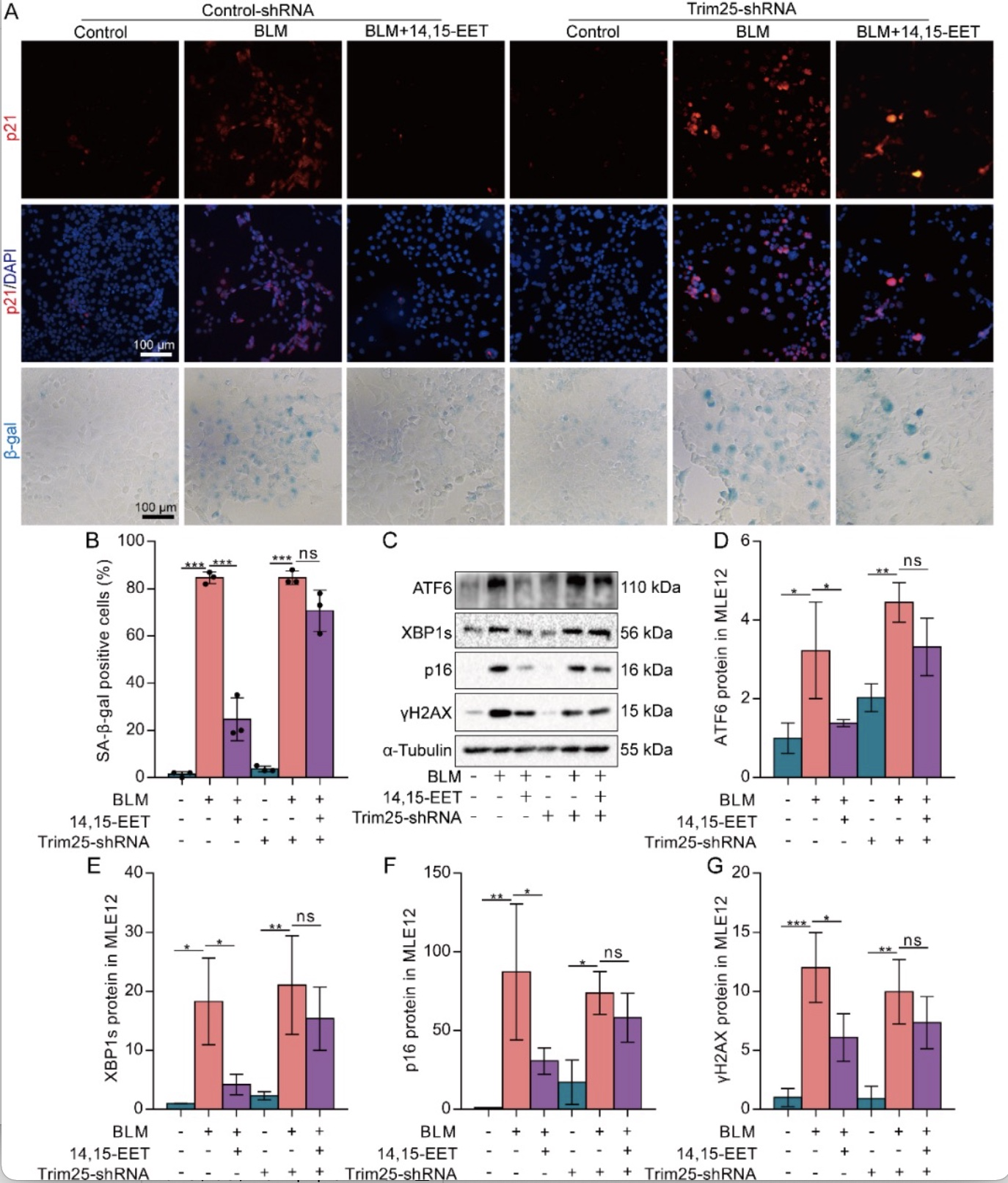
图7 EETs通过Trim25/Keap1/Nrf2轴抑制ERS,减缓AECs衰老
(图源:CY Zhang et al., Redox biology, 2023)
基于以上研究,作者认为EETs可以减缓AECs的衰老。那么EETs能否减轻肺衰老及年龄相关肺纤维化呢?因此作者首先采用D-gal诱导小鼠早衰模型[8, 9],采用TPPU抑制EETs降解酶sEH(图8A)。结果发现TPPU抑制EETs降解可以减轻D-gal诱导的小鼠肺衰老(图8B-J)。进一步在D-gal诱导的衰老小鼠基础上使用低剂量BLM(0.5 mg/kg,该剂量的BLM在年轻小鼠中未引起显著的肺纤维化)诱导衰老小鼠肺纤维化,发现TPPU治疗的衰老小鼠对BLM诱导肺纤维化的易感性降低(图9)。表明抑制EETs降解可减轻衰老小鼠实验性肺纤维化。
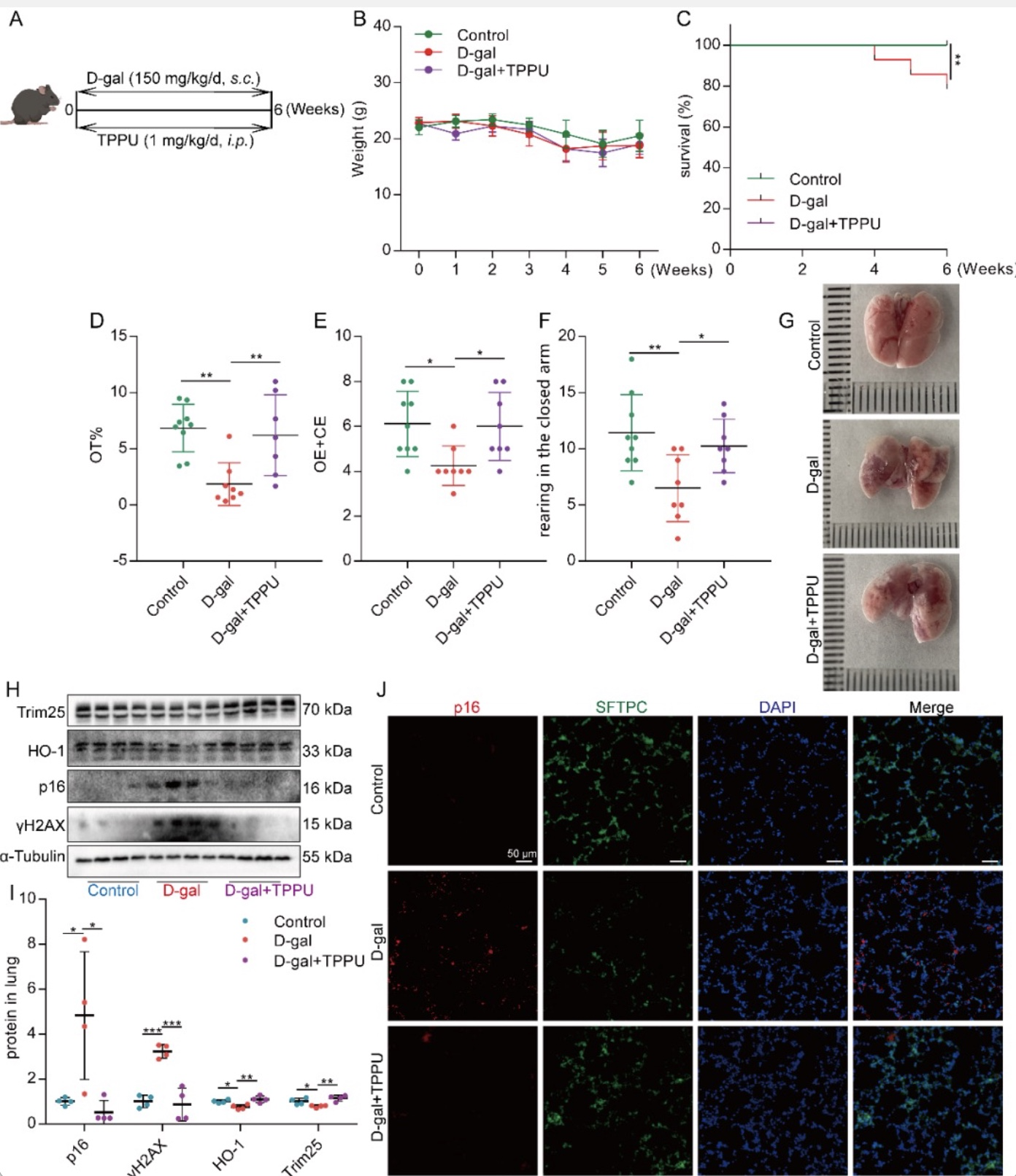
图8 抑制EETs降解可减轻D-gal诱导的小鼠肺衰老
(图源:CY Zhang et al., Redox biology, 2023)
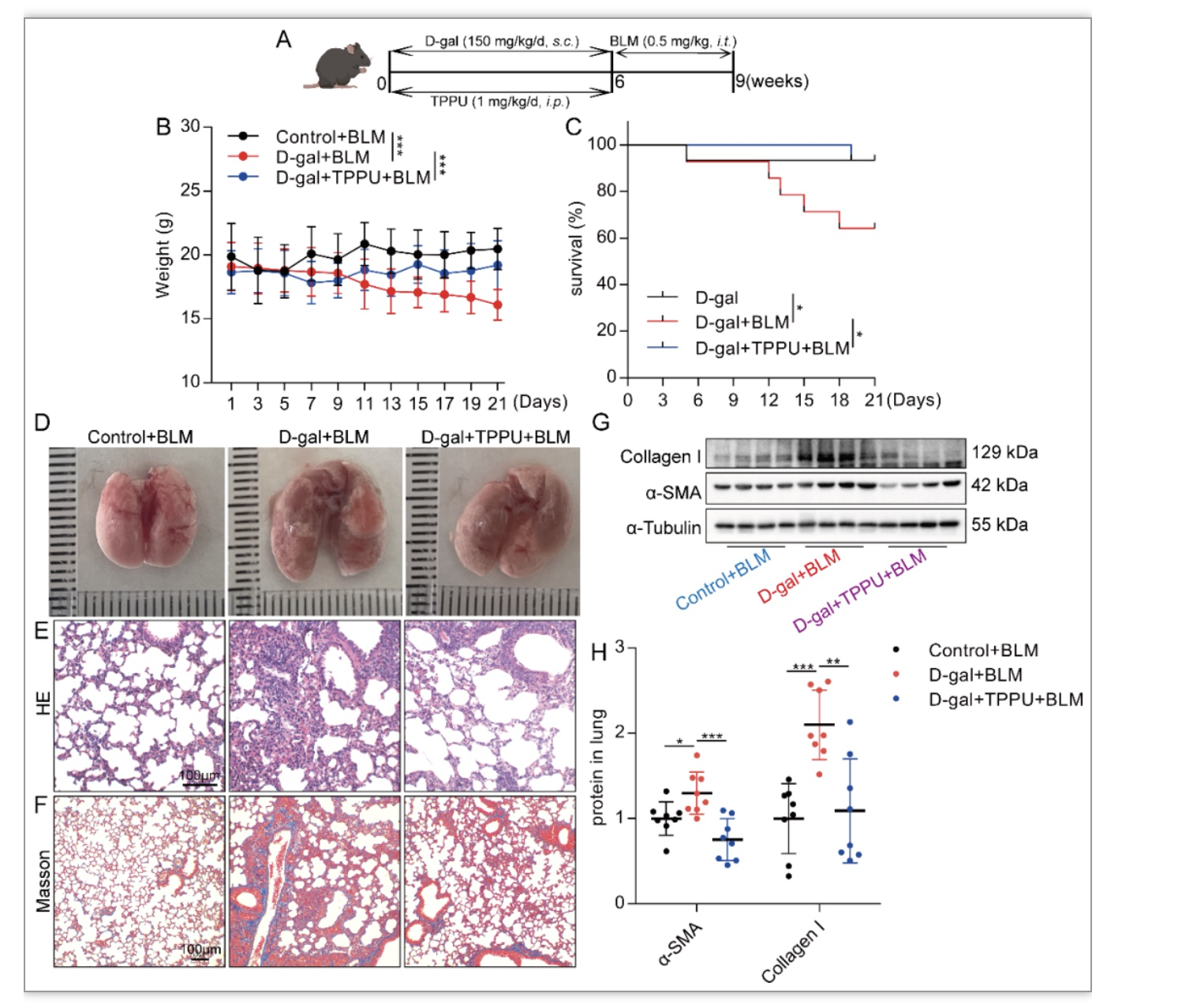
图9 抑制EETs降解可减轻衰老小鼠实验性肺纤维化
(图源:CY Zhang et al., Redox biology, 2023)
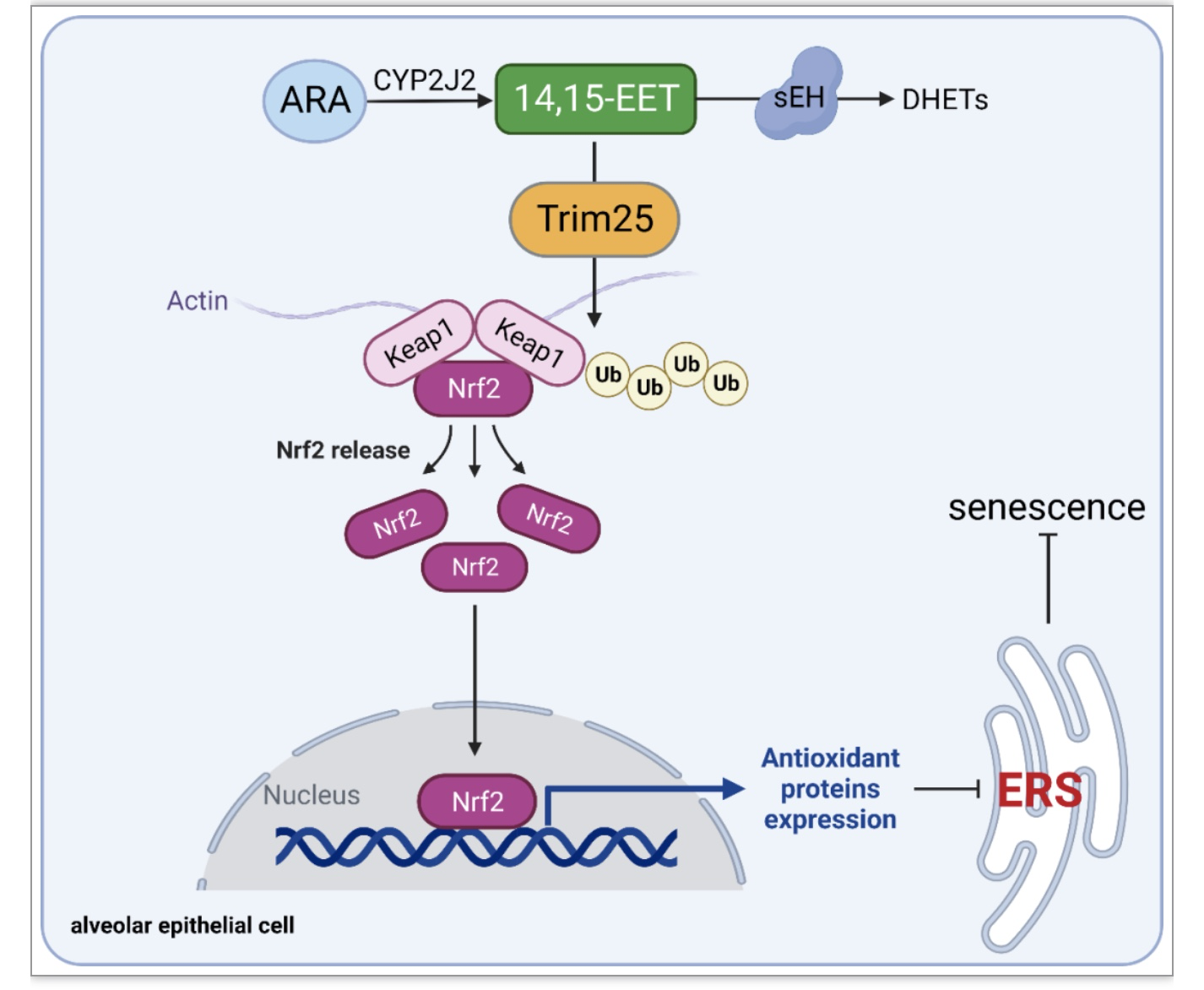
图10 EETs减缓肺泡上皮细胞衰老机制图
(图源:CY Zhang et al., Redox biology, 2023)
综上所述,本研究发现EETs通过Trim25泛素化降解Keap1,并促进Nrf2核转位,从而发挥抗氧化作用,抑制ERS,减缓AECs衰老(图10),并且发现TPPU抑制EETs降解酶sEH可显著降低早衰小鼠对BLM诱导的肺纤维化的易感性。该研究创新性提出EETs可作为一种新型内源性抗衰老物质,为防治年龄相关慢性肺部疾病提供新思路。然而,14,15-EET如何促进Trim25表达尚不清楚。EETs是否通过与细胞膜上的胞内受体PPARγ、PPARα或G蛋白偶联受体40结合,或调节酪氨酸激酶活性,或与炎症因子相互作用,发挥胞内生物学效应仍有待进一步探索。

