
研究团队通过分析子宫内膜异位症和反复着床失败女性子宫内膜组织的芯片数据,发现不孕症患者子宫内膜METTL3 mRNA水平较低,而且ROC曲线显示,METTL3能较好地区分对照组与子宫内膜源性不孕症患者(图1)。上述结果提示,METTL3依赖的m6A修饰可能在子宫内膜源性不孕症的发生发展中发挥重要作用。
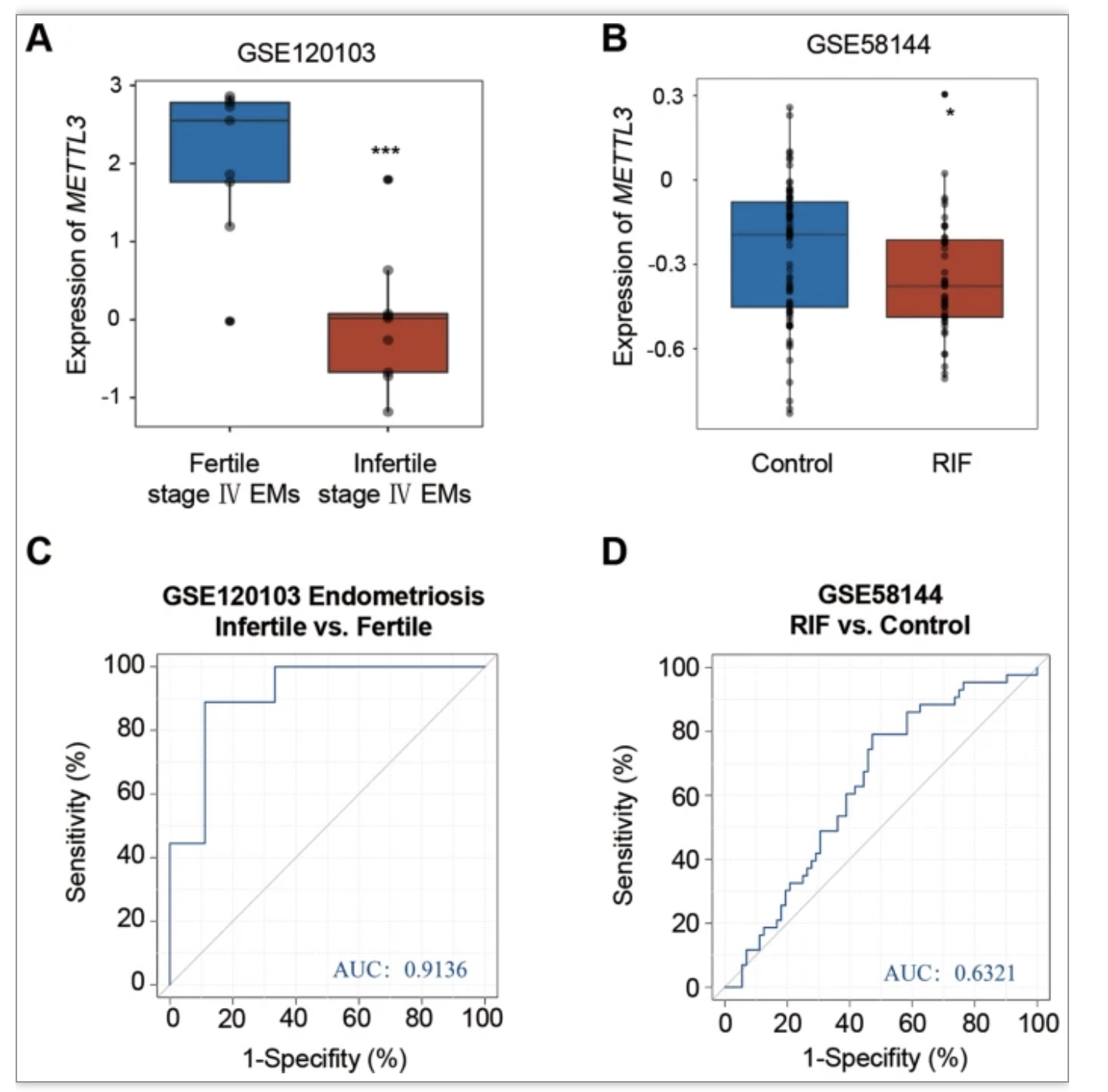
图1 METTL3子宫内膜异位症或反复着床失败的不孕女性子宫内膜中的表达情况
为了探讨METTL3依赖的m6A修饰对胚胎着床的影响,研究团队构建了子宫内膜Mettl3特异性缺失的小鼠模型(PgrCre Mettl3fl/fl)。通过连续6个月的合笼,发现子宫Mettl3缺失的小鼠无幼崽出生。研究者进一步观察了Mettl3缺失小鼠胚胎植入的情况,发现妊娠第5天小鼠在尾静脉注射芝加哥蓝后,Mettl3缺失小鼠子宫角未见着床点。以上结果提示Mettl3缺失影响了胚胎的植入。为了进一步阐明胚胎植入失败的原因,研究者检测了妊娠第4天小鼠、Pollard模型小鼠子宫内膜容受性相关的指标,结果显示:Mettl3缺失小鼠子宫上皮细胞E-cadherin水平显著上调,提示子宫上皮细胞极性显著上调;子宫基质细胞Ki67水平显著下调,提示子宫基质细胞增殖能力显著下调(图2)。蜕膜反应实验结果显示Mettl3缺失小鼠子宫蜕膜化有缺陷(图2)。以上结果显示,Mettl3缺失通过影响子宫内膜容受性和蜕膜反应,导致胚胎植入的失败。
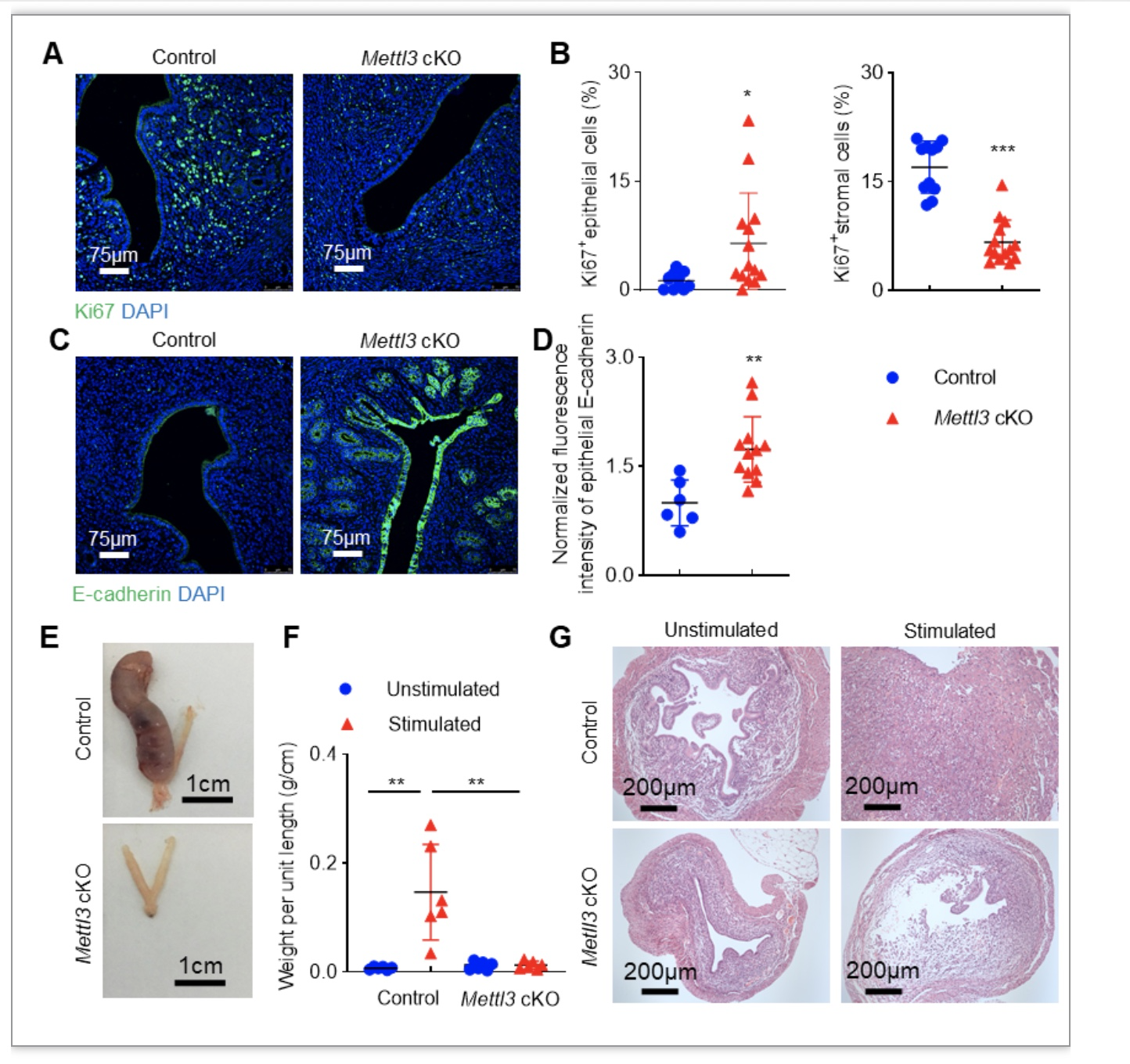
图2 Mettl3缺失小鼠子宫容受性和蜕膜化受损
在胚胎植入过程中,孕酮和雌激素通过它们的同源核受体,即孕激素受体(PR)和雌激素受体(ER),精密调控子宫上皮和基质细胞的功能,维持子宫容受性和蜕膜化等生物学过程[8]。为了探讨METTL3依赖的m6A修饰调控子宫容受性和蜕膜化的分子机制,研究者收集了妊娠第4天小鼠的子宫角,开展RNA-seq分析。结果显示,与野生型小鼠相比,上皮细胞调控、雌激素反应相关信号通路在Mettl3缺失小鼠子宫中显著上调,而孕激素反应信号通路显著下调(图4)。研究者进一步通过RNA-seq分析和qPCR验证,发现与野生型小鼠相比,大多数雌激素反应基因在Mettl3缺失小鼠子宫中显著上调,大多数孕激素反应基因在Mettl3缺失小鼠子宫中显著下调。免疫组化结果显示,Mettl3缺失小鼠子宫ER水平与野生型小鼠无明显差异,Mettl3缺失小鼠子宫PR蛋白水平较野生型小鼠显著下调(图4),PR下游靶基因c-Myc蛋白水平均显著下调。为了确定m6A修饰在子宫内膜容受性中的作用,我们进一步开展了m6A-seq分析和RNA稳定性实验,结果显示,Mettl3缺失小鼠子宫内膜雌激素反应基因Elf3和Celsr2 mRNA的 3'UTR处的m6A水平较野生型小鼠显著下调,其mRNA降解的速率显著降低(图4)。这些结果表明,METTL3依赖性m6A修饰的缺陷或通过增加雌激素反应基因Elf3、Celsr2 mRNA的稳定性,导致子宫雌激素信号通路的过度激活,以及抑制PR的蛋白水平引起孕激素下游信号通路的抑制。
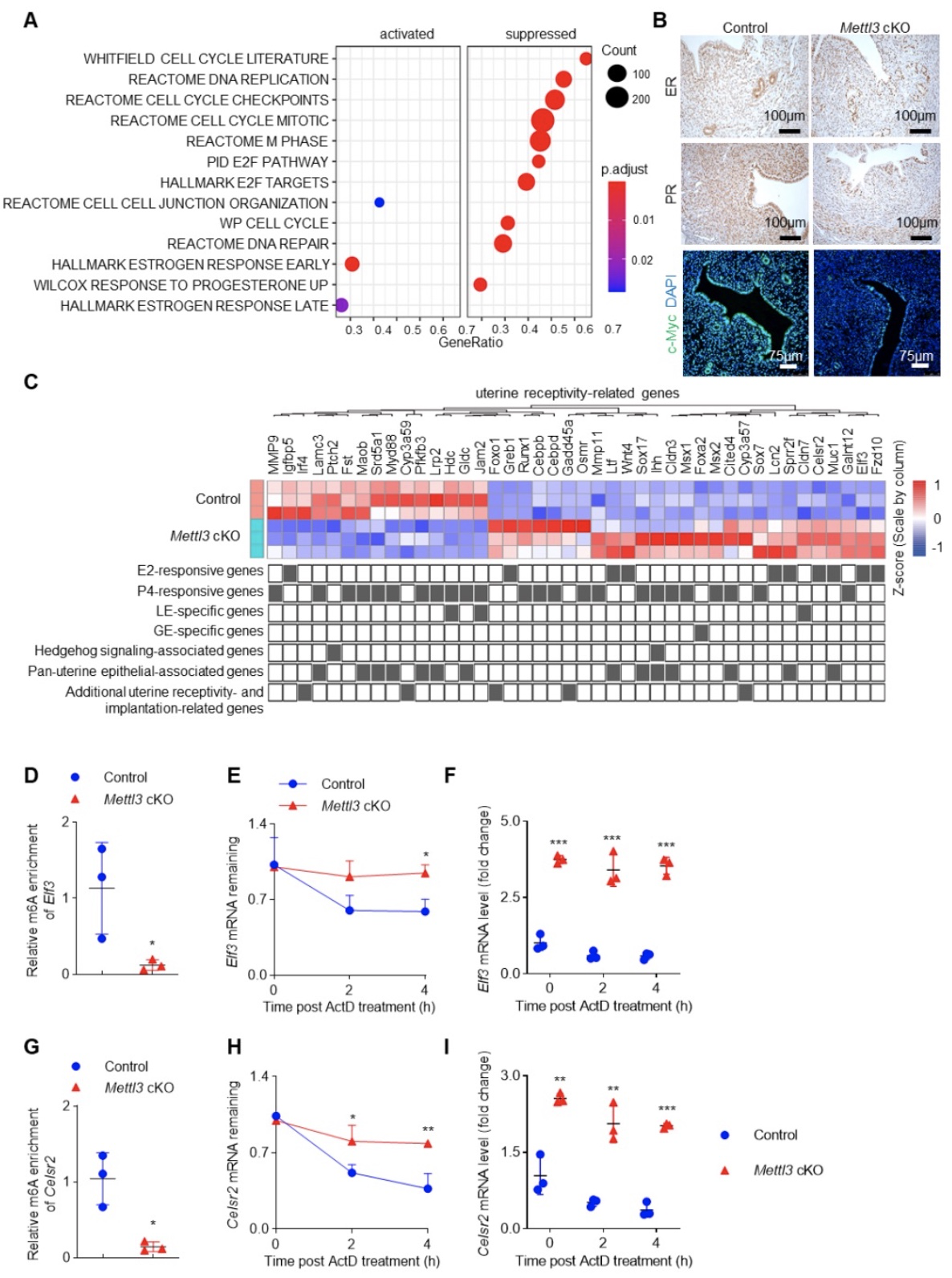
图3 Mettl3缺失对小鼠雌孕激素信号通路活化的影响
为了阐明METTL3是否调节人子宫内膜中E2和P4信号通路的稳态平衡,研究者分析了两个独立队列GSE58144和GSE4888的人子宫内膜METTL3与PGR、MYC、ELF3之间的相关性,其结果与小鼠模型的结果一致(图4)。以上结果提示,在人类子宫内膜相关疾病,孕激素信号的抵抗和雌激素信号的激活可能与子宫内膜中METTL3水平的降低有关。
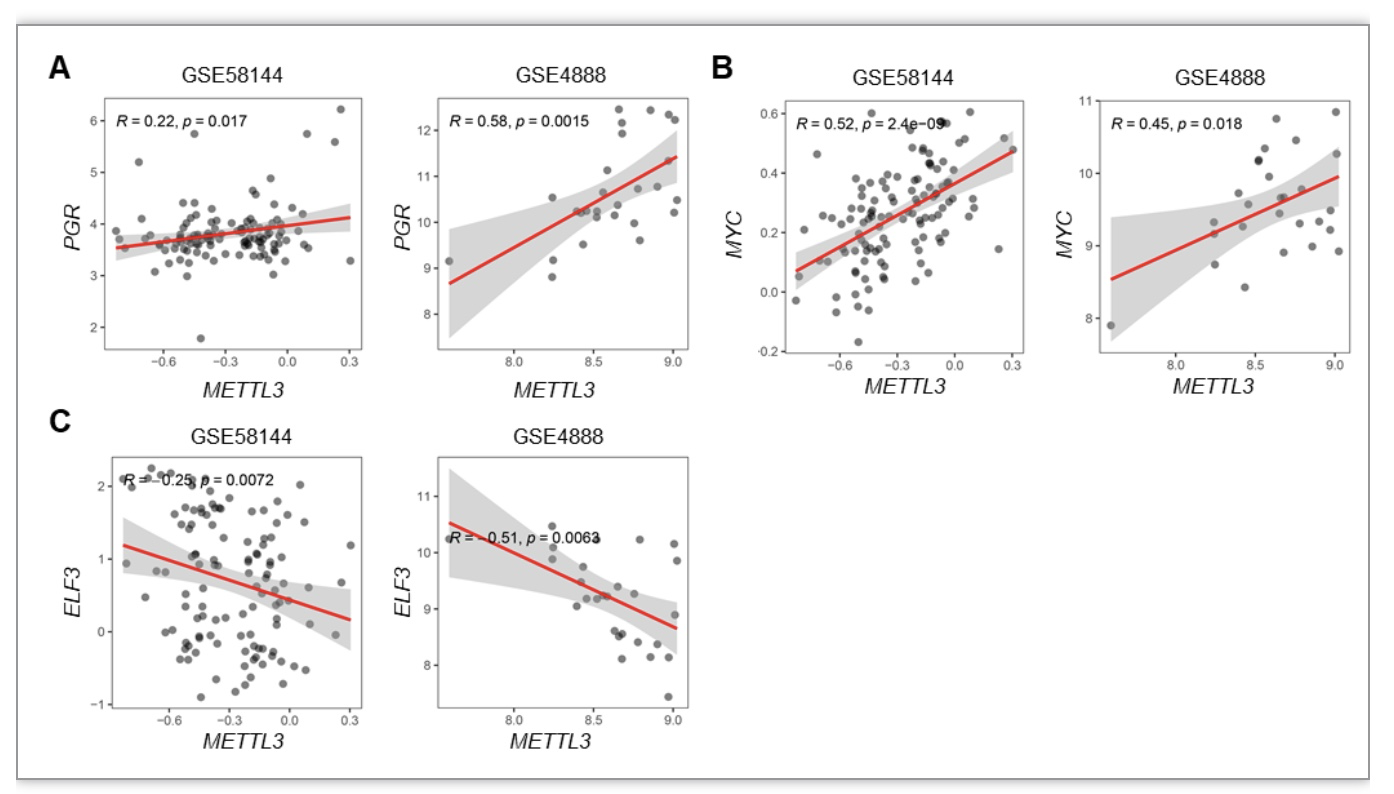
图4 人子宫内膜METTL3水平与雌孕激素靶基因PR、MYC、ELF3水平相关
综上所述,该研究初步阐明了子宫内膜中METTL3依赖的m6A修饰参与子宫内膜容受性和蜕膜化维持,促进胚胎植入的重要机制。本研究为子宫内膜源性疾病的诊断和治疗提供新的见解。

