CAR-T(chimeric antigen receptor T cell)细胞在治疗B细胞恶性瘤和在其它肿瘤中具有广泛的研究。CAR-T细胞包含CD4+CAR T和CD8+ CAR T细胞,它们的功能特征既有相似也有区别[1,2]。在有些临床前肿瘤模型中CD4+CAR-T细胞表现出比CD8+CAR-T细胞更强的抗肿瘤能力,但是在有些肿瘤中CD4+CAR-T较CD8+CAR-T反应性更低[3-5]。这种差异是否由肿瘤内在的因素导致尚不清楚,且CD4+CAR-T反应性肿瘤中仍然不清楚其清除肿瘤的机制。作者用体内成像技术发现anti-CD19 CD4+CAR-T细胞在治疗响应性B细胞淋巴瘤时,只有少于1/3的肿瘤细胞死于穿孔素颗粒酶通路,而大部分死亡的肿瘤与CD4+CAR-T细胞没有直接接触,这些细胞的死亡主要由CAR-T细胞来源的IFN-γ介导,IFN-γ能在肿瘤微环境中扩散并直接作用于肿瘤细胞促进肿瘤细胞的凋亡。该研究揭示肿瘤对IFN-γ的敏感性决定了CD4+CAR-T细胞治疗的有效性。

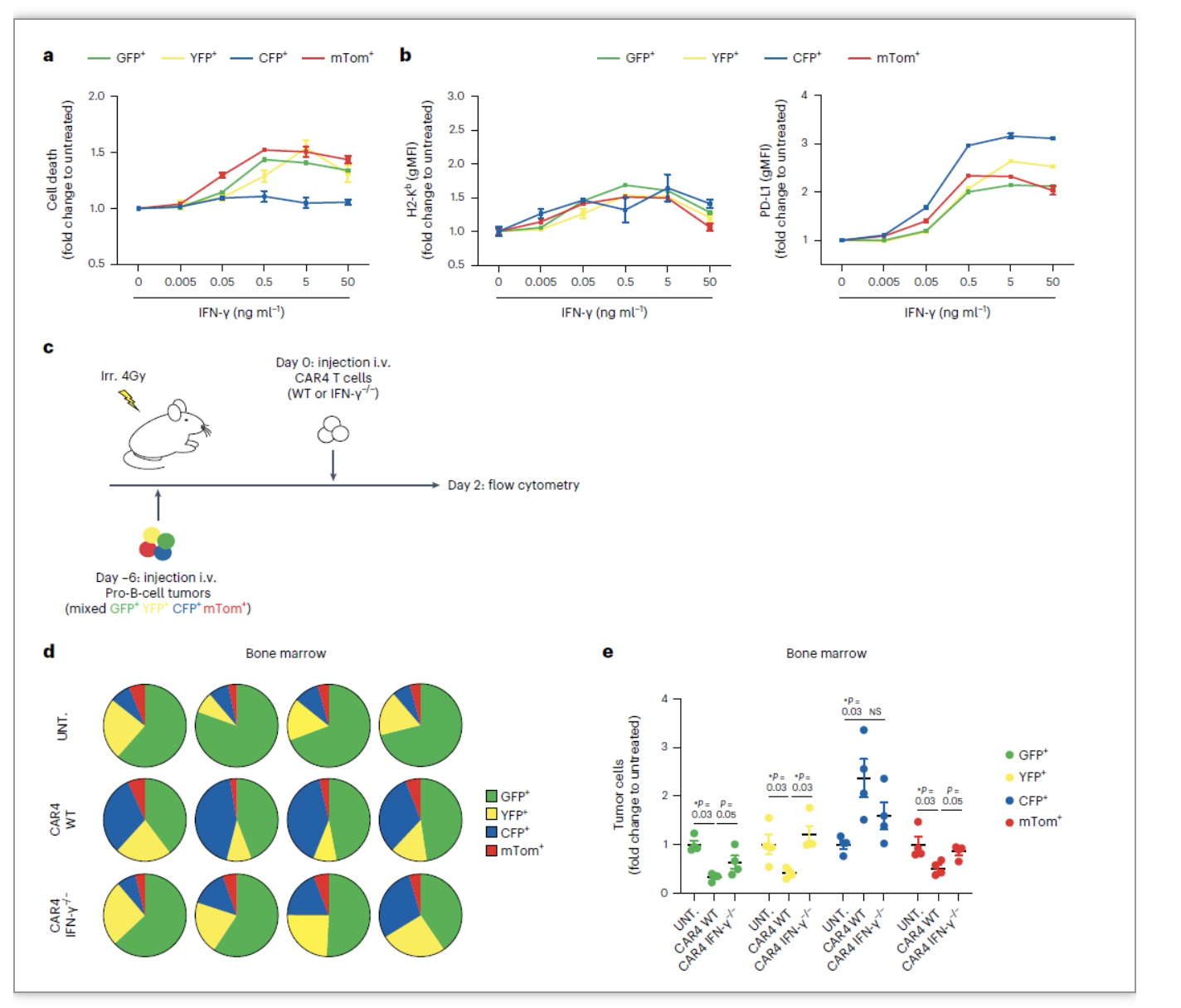
在临床前B细胞恶性肿瘤或实体瘤肿瘤模型中,CD4+CAR T(CAR4 T)细胞治疗表现出很高的差异性。作者先前的研究发现CD4+CAR T细胞在Myc-driven B-cell lymphoma (Eμ-myc)模型中治疗效率很低,而CD8+CAR T细胞在该模型中能够很好的缓解肿瘤进展。为检测CAR4 T在其它B细胞恶性肿瘤中的作用,作者用Abelson-driven pro-B-cell tumor model建立pro-B-cell tumors,随后进行CAR4 T治疗。结果发现CAR4 T能够明显延长pro-B tumors小鼠的生存期,显著降低骨髓、外周血中pro-B tumors的数量而对Eμ-myc B细胞瘤没有影响。并且作者发现在不同B细胞瘤模型下,CAR4 T细胞表面CD19和ICAM的表达没有影响,可见这种治疗的差异性不是由于CD19和ICAM改变导致的。作者通过体内FRET实验发现,CAR4 T细胞能显著提高Pro-B细胞瘤的凋亡。
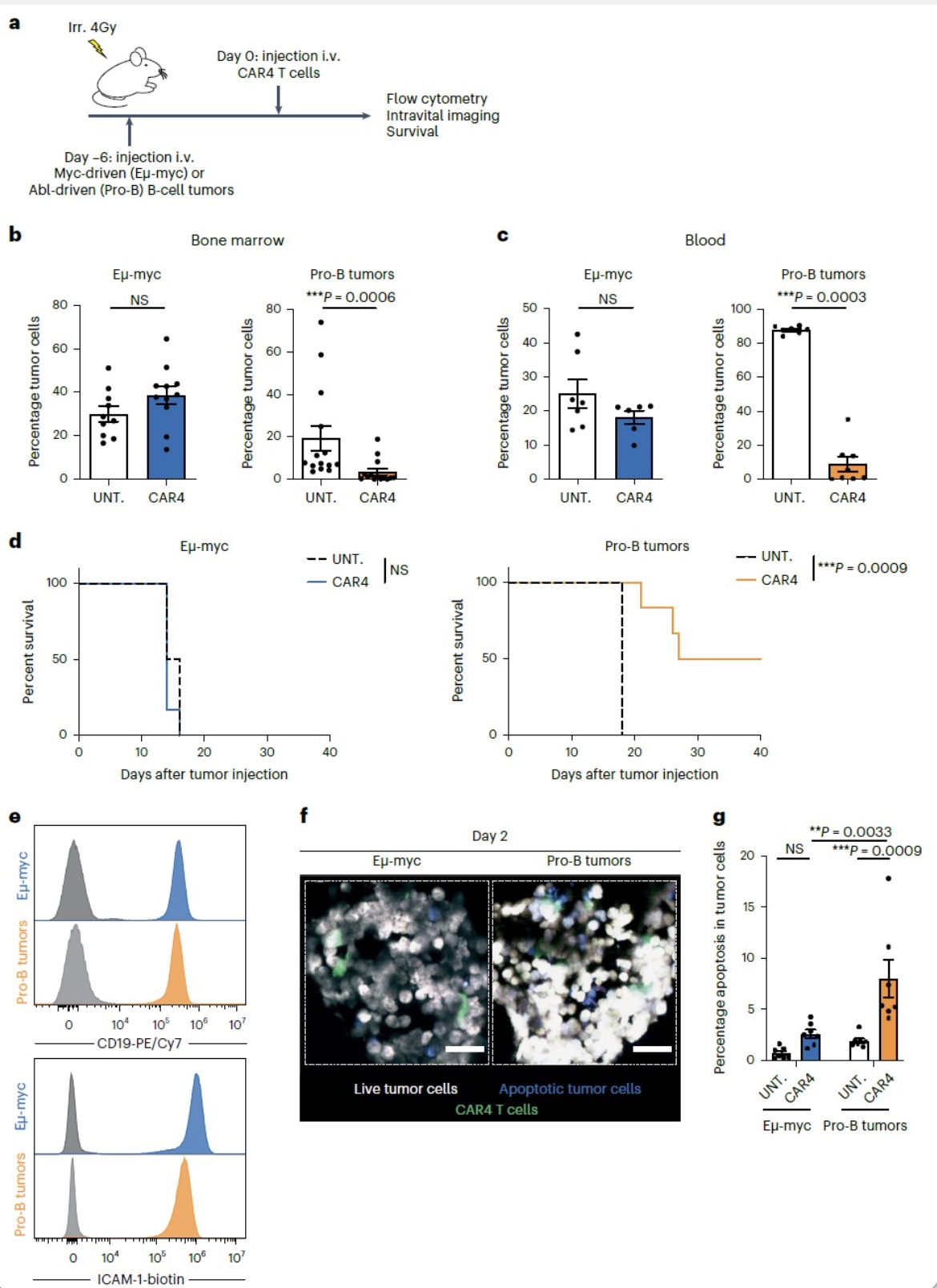
IFN-γ在抗肿瘤免疫中具有重要作用,为探究CAR4 T细胞产生的IFN-γ是否在控制Pro-B细胞瘤中发挥作用。作者用WT CAR4 T和IFN-γ缺陷CAR4 T细胞治疗Pro-B细胞瘤,发现CAR4 T细胞缺陷IFN-γ后抗肿瘤能力显著减少,小鼠生存期变短。体内FRET实验检测肿瘤凋亡情况,同样发现IFN-γ缺陷的CAR4 T细胞诱导肿瘤凋亡水平减少。值得注意的是在缺陷IFN-γ CAR4 T细胞与野生型CAR4 T细胞相比其表面激活性分子和抑制性分子均无明显差异。通过体内成像实验发现,IFN-γ KO CAR4 T细胞与肿瘤之间的接触较WT细胞有少量增加。综合上述实验,作者得出CAR4 T细胞来源的IFN-γ在诱导肿瘤细胞死亡,控制Pro-B细胞瘤进展中发挥重要作用。
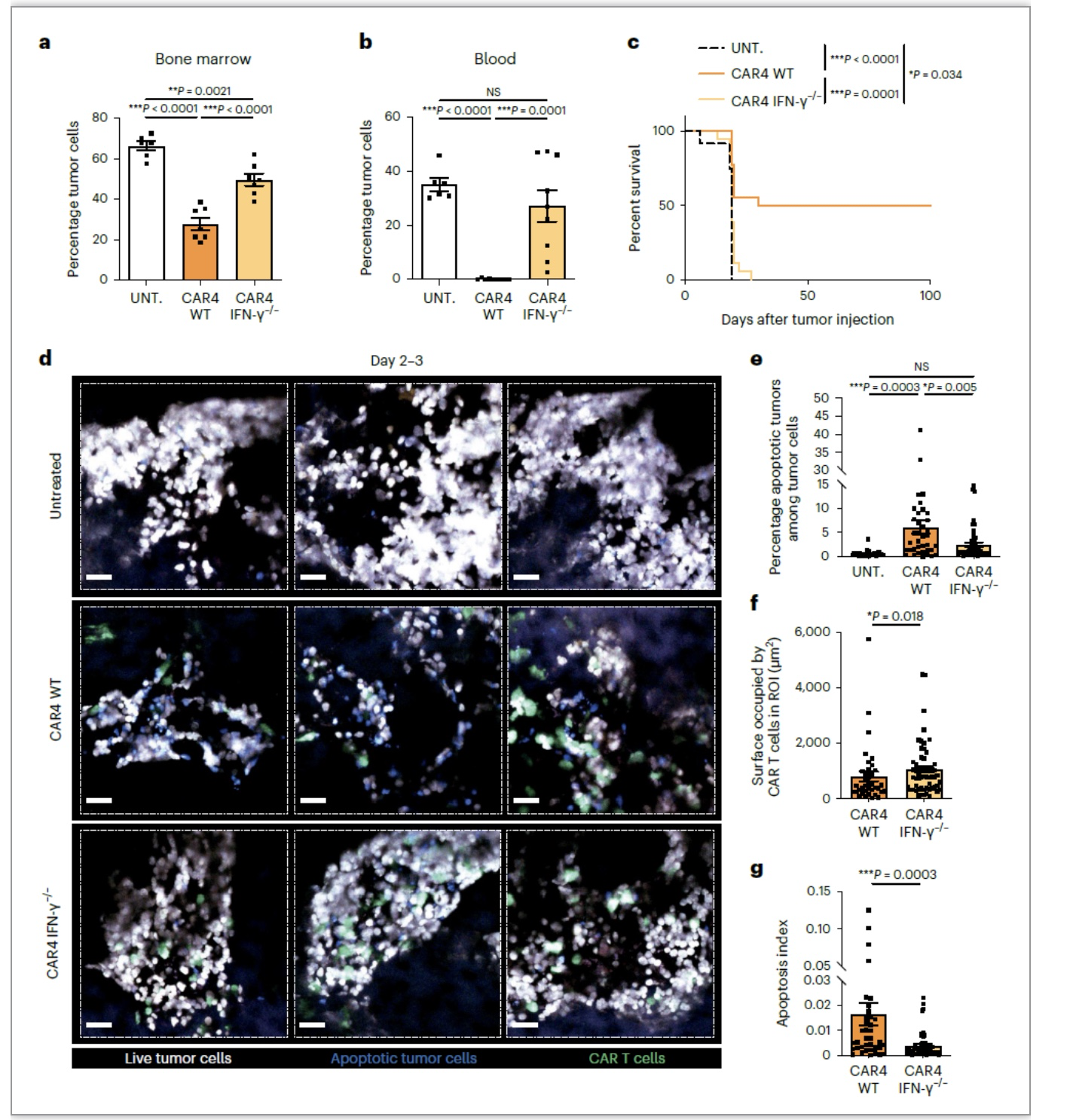
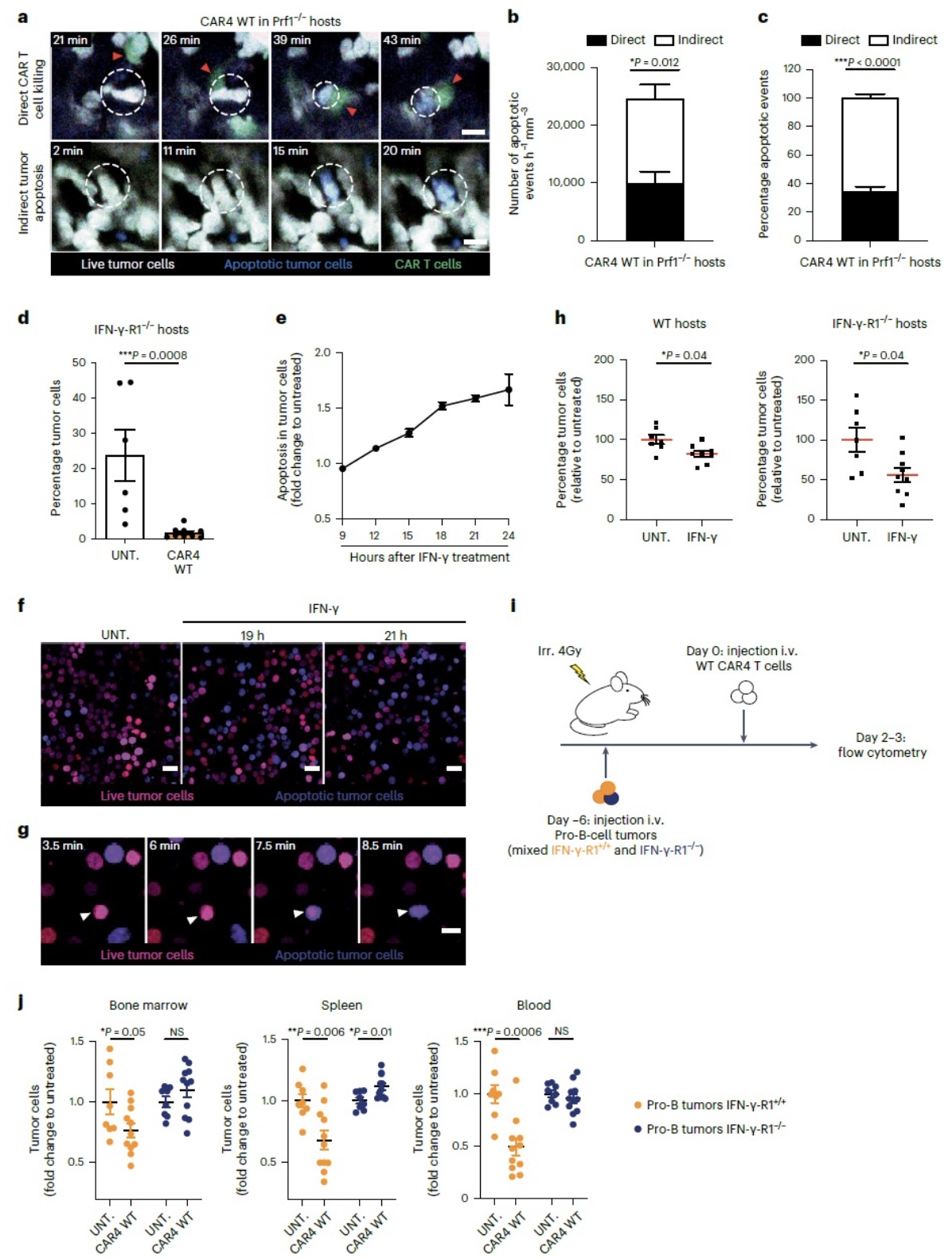
为进一步探究CAR4 T细胞杀伤肿瘤的具体机制,作者用WT CAR4 T、IFN-γ-/- CAR4 T以及Prf1-/-CAR4 T(perforin-deficient)分别治疗Pro-B细胞瘤,通过体内成像技术观察直接杀伤(与CAR4 T直接接触的肿瘤细胞死亡称之为直接杀伤)和间接杀伤(在CAR4T细胞非接触区域死亡的肿瘤细胞定义为间接死亡)。实验结果显示WT CAR4 T细胞治疗组,有1/3的肿瘤细胞死于直接接触,而大部分肿瘤细胞间接死亡,说明CAR4 T细胞主要通过非接触方式引发肿瘤细胞死亡。在IFN-γ-/-CAR4 T治疗组,大部分间接死亡消失,说明CAR4 T细胞驱动的间接杀伤作用主要通过IFN-γ。值得注意的是,IFN-γ的缺失也导致CAR4 T直接杀伤能力部分减弱,这可能是由于IFN-γ-IL-12 axis对维持CART细胞杀伤毒作用的重要性。相反,在Prf1-/- CAR4 T治疗组,间接杀伤作用与WT CAR4 T治疗组类似,但是直接杀伤几乎消失,这说明直接杀伤机制依赖于perforin/granzyme通路。以上结果说明CAR4 T细胞主要通过IFN-γ依赖的间接通路杀伤肿瘤,少部分依赖于接触式穿孔素直接杀伤通路。
上述阐明了IFN-γ在CAR4 T治疗Pro-B细胞肿瘤中的重要性,作者进一步确定了在CAR4 T治疗后,体内IFN-γ的产生情况。在回输CAR4 T细胞第三天,分析血清中的IFN-γ发现,IFN-γ-/- CAR4 T治疗组和WT CAR8 T治疗组血清中IFN-γ与非治疗组一样均处于基线水平,而WT CAR4 T细胞治疗组血清中有高水平IFN-γ,说明CAR4 T细胞为IFN-γ的主要来源。MHC I、ICAM-1以及PD-L1均能被IFN-γ上调,为评估IFN-γ在肿瘤中产生的重要性,作者分析了免疫细胞和肿瘤细胞表面MHC I、ICAM-1以及PD-L1的表达,发现CAR4 T细胞能显著上调肿瘤细胞和免疫细胞表面这些分子的表达,并且部分依赖于CAR4 T来源的IFN-γ。作者通过pro-B肿瘤细胞STAT1激活荧光标志观察IFN-γ信号传导情况,体内注射重组的IFN-γ发现大部分肿瘤细胞中STAT1发生核转位。随后作者将CAR4 T和Control CD4+T(CTRL)细胞注射到荷有Pro-B细胞瘤的IFN-γ-/-小鼠体内,评估CAR4 T细胞来源的IFN-γ在肿瘤中的扩散情况,实验结果显示CAR4 T组中肿瘤细胞STAT1发生转位,而CTRL CD4+T细胞组未发生。这些结果说明IFN-γ在肿瘤微环境中广泛分布,极有可能是由于其高效的扩散能力。

IFN-γ在体内至少通过两种可能的机制发挥抗肿瘤作用,一种通过作用于宿主激活内源性效应细胞如NK细胞、T细胞,这些效应细胞可能参与IFN-γ诱导的间接杀伤作用。但是,在Prf1-/-或WT小鼠中过继回输WT CAR4 T细胞治疗Pro-B细胞瘤并没有显著差异,说明IFN-γ介导的间接杀伤肿瘤不依赖于宿主毒性效应细胞中穿孔素杀伤肿瘤通路。过继回输CAR4 T细胞到IFNGR缺陷小鼠中,同样能够治疗pro-B细胞瘤,说明IFN-γ对宿主细胞的激活在抗Pro-B细胞瘤中无关紧要。第二种IFN-γ可能通过直接作用于肿瘤细胞介导杀伤。体外直接用IFN-γ处理Pro-B细胞瘤或体内直接给予IFN-γ均能够显著引起肿瘤细胞凋亡。进一步通过WT Pro-B与IFNGR-/-Pro-B细胞瘤实验发现,CAR4 T细胞只能选择性杀伤WT Pro-B细胞瘤,而不能有效杀伤IFNGR-/- Pro-B。这些实验说明CAR4 T细胞来源的IFN-γ直接介导了肿瘤细胞的杀伤作用。作者将CD19+ pro-B tumor和CD19- Pro-B tumor混合回输到受体小鼠,随后过继回输CAR4 T细胞治疗,发现同样能够间接杀伤CD19-B细胞瘤,而阻断IFN-γ或用IFN-γ-/-CAR4 T细胞治疗均减少了杀伤作用,说明CAR4 T细胞能够通过IFN-γ介导的间接杀伤作用预防肿瘤抗原逃逸。
随后作者通过Eµ-myc B、B16、MC38等多种肿瘤模型证明,CAR4 T治疗差异性主要由于不同肿瘤对IFN-γ的敏感性不同,CAR4 T能够有效治疗对IFN-γ敏感的肿瘤。作者通过分析临床弥散性B细胞淋巴瘤DLBCL(diffuse large B-cell lymphoma),发现CAR T治疗后CAR4 T:CAR8 T比例高的患者,血清中IFN-γ水平高,并且高IFN-γ与肿瘤预后呈正相关。说明IFN-γ在CAR T治疗中可能是CAR4 T细胞激活的潜在的标志物,能够预测病人的存活率。