线粒体是一种高度动态的细胞器,在细胞中不断的发生融合与分裂,线粒体这种融合与分裂的动力学平衡受到细胞中线粒体动力学相关蛋白的严格调控,一旦线粒体融合和分裂的动力学平衡出现异常,细胞就会发生病理变化,如肿瘤的发生。尽管线粒体动力学的异常调控在肿瘤的发生发展和多药耐药中的作用已在多方面得到证实[1,2],但线粒体动态的调控机制仍未完全了解。 揭示了肉碱棕榈酰转移酶1A(CPT1A)通过调节线粒体分裂因子(mitochondrial fission factor, MFF)的琥珀酰化修饰来调节线粒体动力学以促进卵巢癌进展的作用和机制。

研究表明,肿瘤细胞可通过加强对外界脂肪酸(FAs)的吸收以增强细胞的脂肪酸氧化降解(fatty acid oxidation,FAO)从而促使癌细胞在能量压力条件下生存[3,4],而细胞中脂肪酸的大量存在可诱导CPT1A的表达,同时引发线粒体的分裂[5]。作为细胞内FAO的关键限速酶,CPT1A在多种恶性肿瘤细胞中高表达并促进肿瘤的发生发展。有研究发现,CPT1A敲除能改变乳腺癌细胞BT549的线粒体形态并抑制细胞增殖[6]。那么,CPT1A是否能通过直接调控线粒体动态平衡来促进癌症进展?
该研究中,作者以卵巢癌细胞为模型,利用体内外技术手段探索发现CPT1A的表达存在与卵巢癌细胞线粒体动力学密切相关,CPT1A的敲减显著促进了线粒体融合,而外源性过表达CPT1A则导致线粒体更多的以分裂态存在。进一步研究发现CPT1A的存在显著增强线粒体分裂因子(mitochondrial fission factor, MFF)的表达;而在CPT1A敲低的背景下外源性过表达MFF可显著恢复线粒体的分裂,挽救卵巢癌细胞线粒体的动态平衡(图1),表明CPT1A通过调节MFF的表达进而调控卵巢癌细胞线粒体动力学。
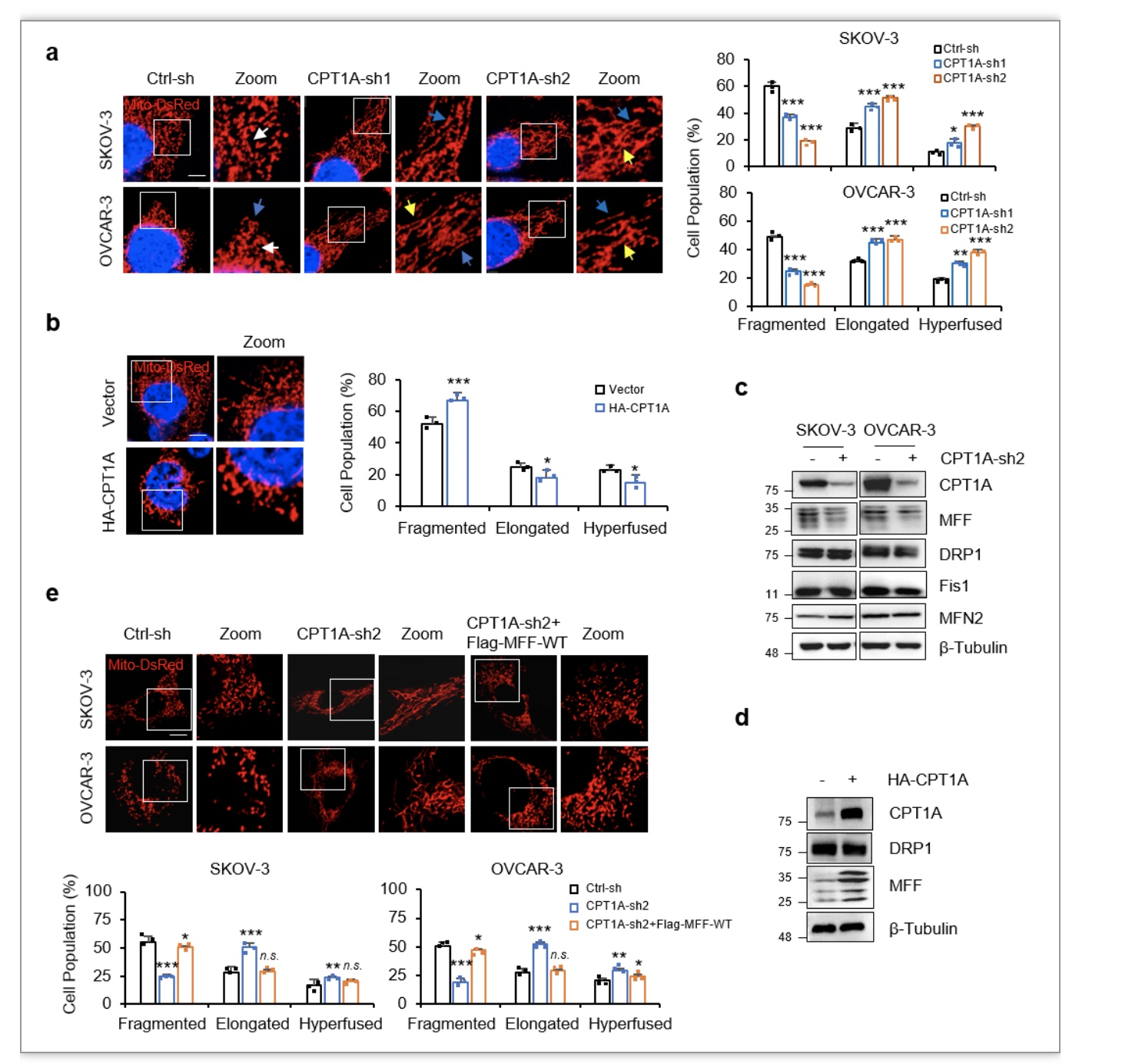
图1. CPT1A通过MFF调控线粒体动力学
接着该团队深入探究了CPT1A调控MFF表达的作用及分子机制。作者分析发现CPT1A的存在抑制了MFF第315位点赖氨酸(K315)的泛素化修饰,从而阻止了MFF的泛素化降解,稳定表达存在的MFF进而招募动力相关蛋白(dynamin-related protein 1,DRP1)到线粒体,维持卵巢癌细胞线粒体的分裂态和功能并促进肿瘤细胞生长。
CPT1A具有肉碱棕榈酰基转移酶(CPTase)活性和赖氨酸琥珀酰转移酶(LSTase)活性[7]。进一步,作者研究发现CPT1A通过其赖氨酸琥珀酰转移酶的作用促使MFF在第302位点赖氨酸(K302)发生琥珀酰化修饰,而K302的琥珀酰化修饰保护了MFF不被E3泛素连接酶Parkin介导的K315的泛素化修饰,从而稳定了MFF的表达(图2)。最后,作者也证实MFF在卵巢癌患者的组织细胞中高表达,MFF高表达与卵巢癌患者的预后不良密切相关;小鼠在体肿瘤模型也证实敲减MFF可显著抑制卵巢癌的体内进展,提示MFF是一个潜在的卵巢癌治疗靶标。
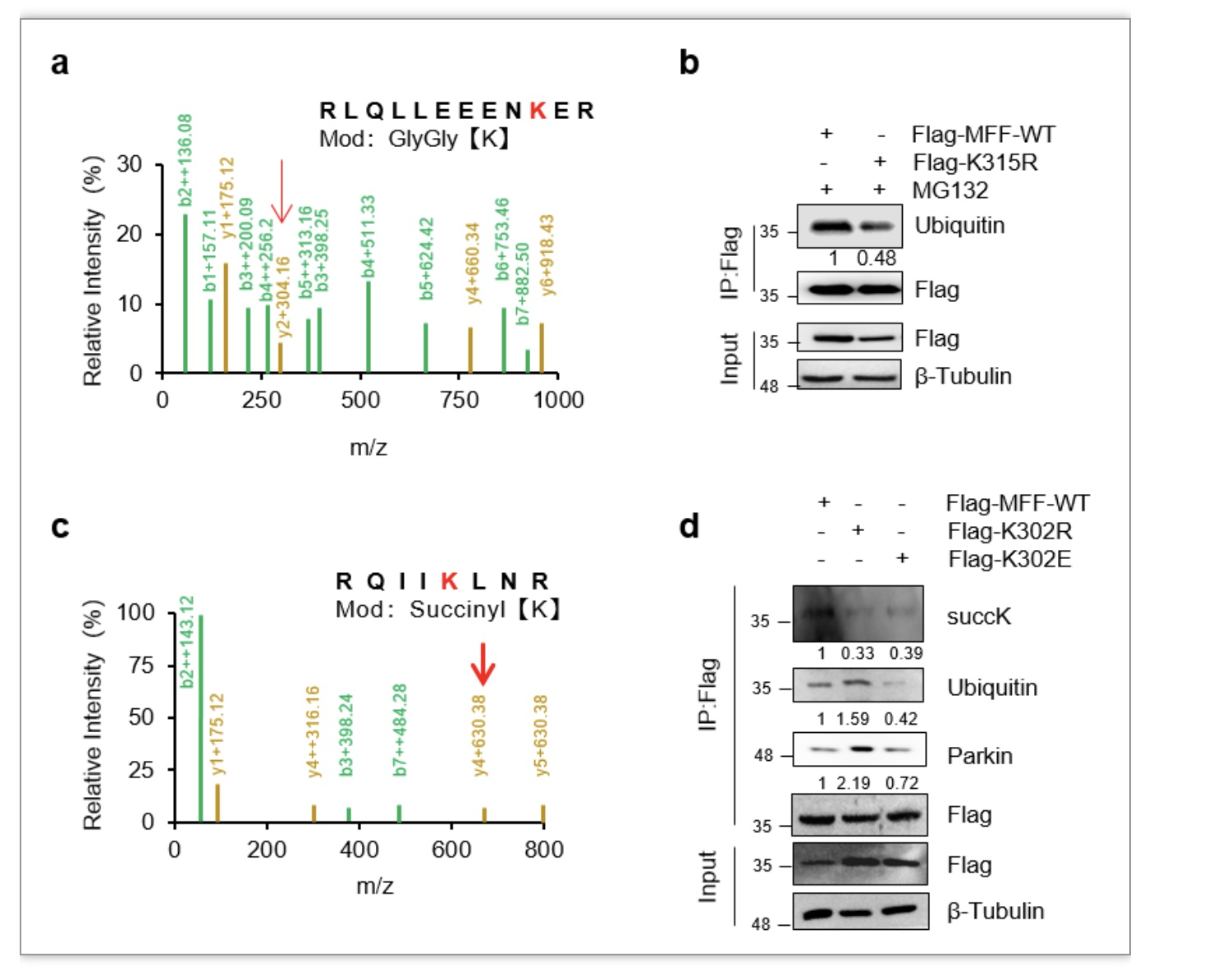
图2. CPT1A通过促进MFF琥珀酰化修饰来抑制其泛素-蛋白酶体降解
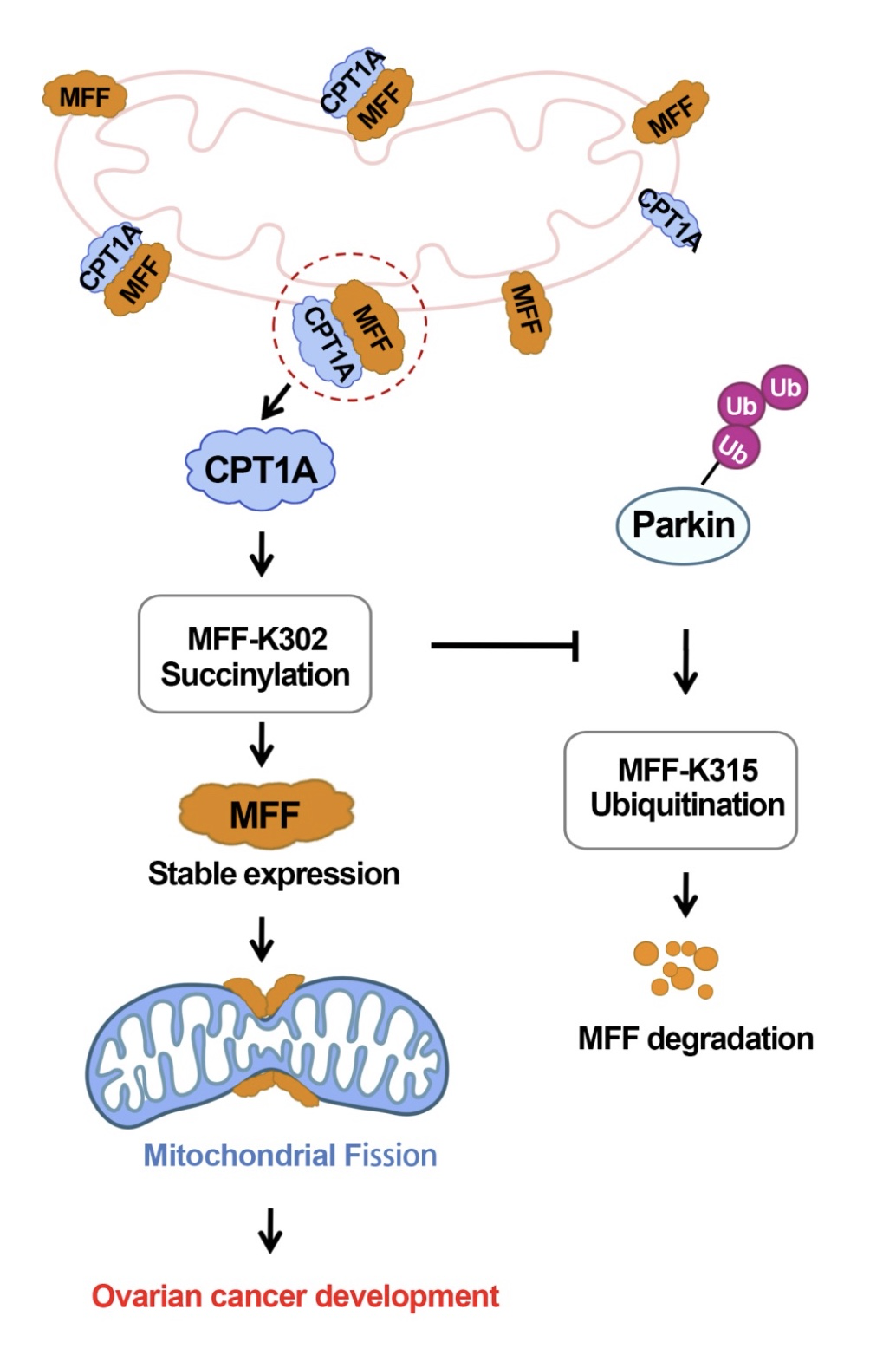
图3. 文章总结图

