免疫治疗是当前肿瘤治疗领域最具前景的方式之一,然而肿瘤微环境的复杂性极大地遏制了肿瘤免疫治疗的有效性。肿瘤相关性巨噬细胞(tumor-associated macrophages,TAMs)是肿瘤微环境中占比较多的免疫细胞(高达50%),因其高异质性和强可塑性成为肿瘤免疫治疗的重要靶点。深入解析肿瘤相关性巨噬细胞的表型和功能并阐明其作用机制有助于设计新的肿瘤免疫治疗策略。该研究报道了一群CD146+的肿瘤相关巨噬细胞亚群,揭示了其在肿瘤发生发展过程中的重要调控作用,为基于巨噬细胞的肿瘤免疫治疗提供了新策略。

研究团队前期在Cell Research(2017) 及Advanced Science (2022) 杂志上分别报道了CD146分子在高脂微环境中不同来源(外周浸润及脂肪组织定居)巨噬细胞促炎性极化过程中的作用及调控机制。鉴于肿瘤微环境中巨噬细胞在肿瘤免疫治疗中的重要作用,研究者进一步揭示该群细胞对肿瘤发展的影响。
首先,研究者利用小鼠荷瘤模型和临床肿瘤样本,证明在肿瘤微环境中存在一群CD146+的巨噬细胞,并发现这群细胞主要位于肿瘤组织的边缘部位(图1)。
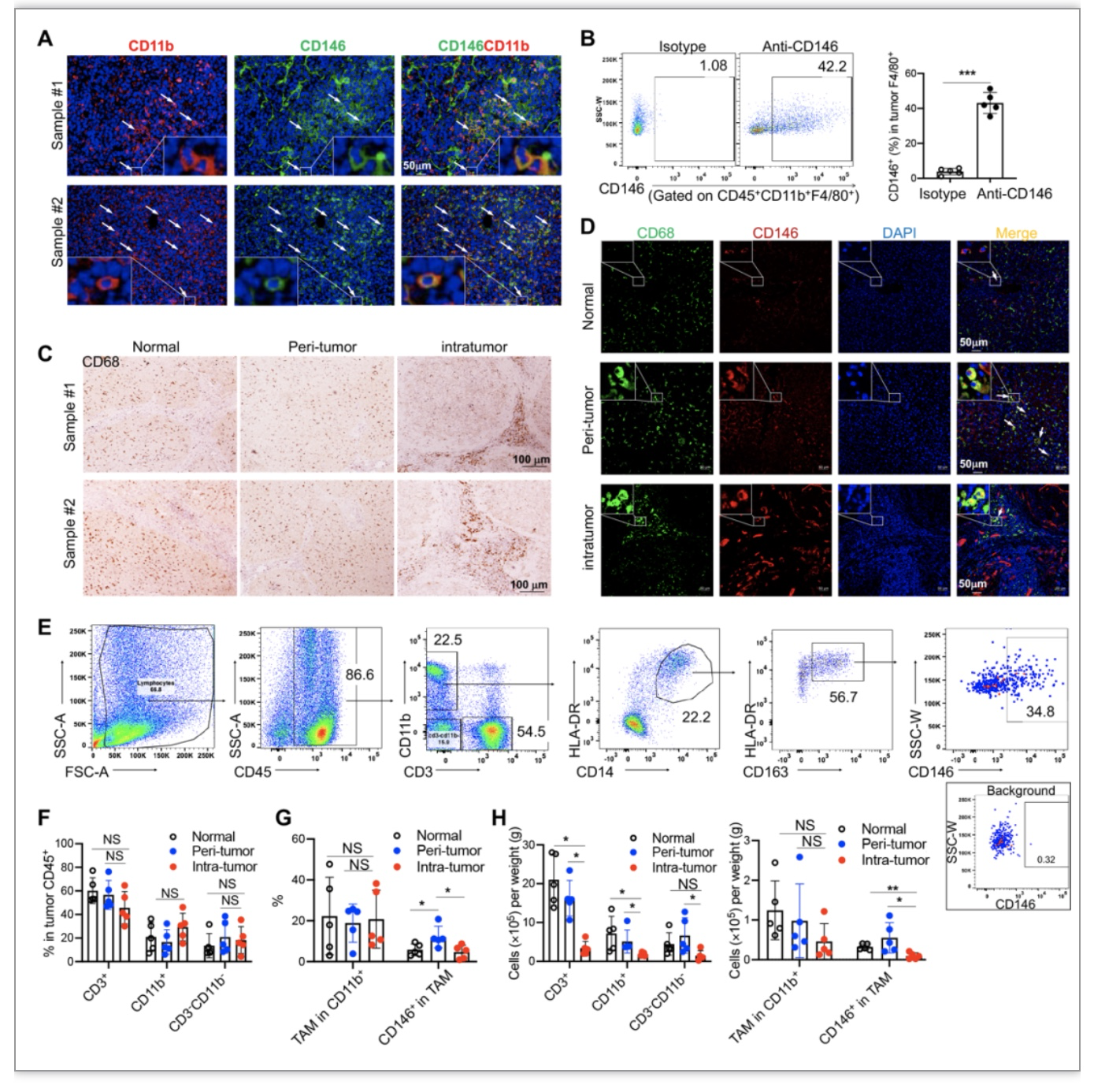
图1. CD146表达在一群肿瘤相关性巨噬细胞
随后,研究者初步探索了CD146+巨噬细胞在肿瘤微环境中的变化规律,发现随着肿瘤上清刺激时间的增加,这群巨噬细胞上的CD146分子表达逐渐下调。深入分析发现该变化主要由STAT3信号通路调控。在肿瘤微环境的驯化下CD146+的巨噬细胞上调STAT3信号,该信号抑制CD146的表达,从而使这群细胞逐渐丧失CD146,部分解释了为什么肿瘤内部的CD146+巨噬细胞更少(图2)
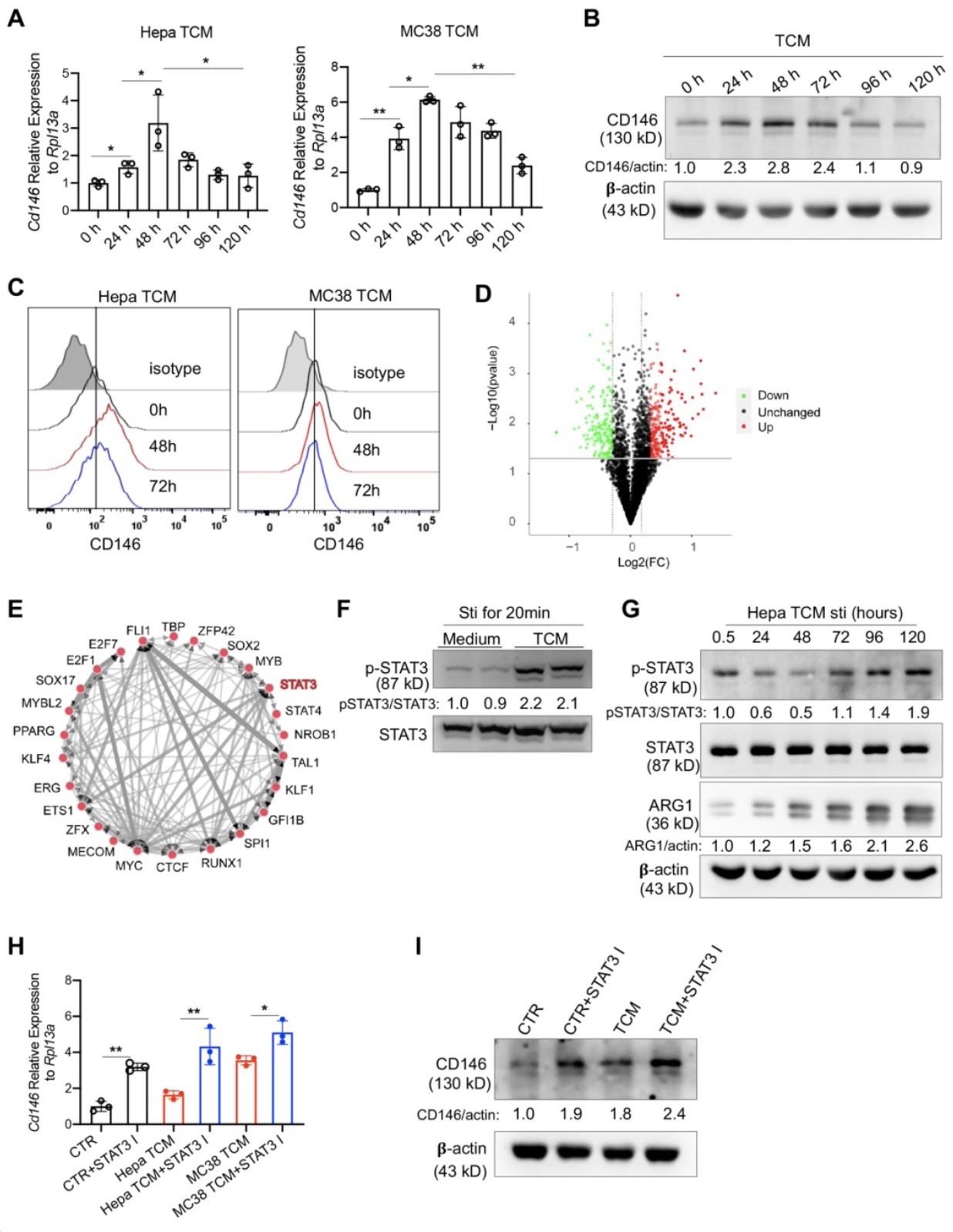
图2. CD146在巨噬细胞上的表达受肿瘤微环境的调控
为了阐明CD146+巨噬细胞在肿瘤发展中的作用,研究者分析了CD146+巨噬细胞与HCC患者生存率之间的关系,发现CD146+巨噬细胞在肿瘤中的比例越高,患者生存时间越长,提示这群巨噬细胞具有更高的抗肿瘤活性。研究者进一步构建了原位肝癌模型以及多种小鼠荷瘤模型验证了这一结论(图3)。
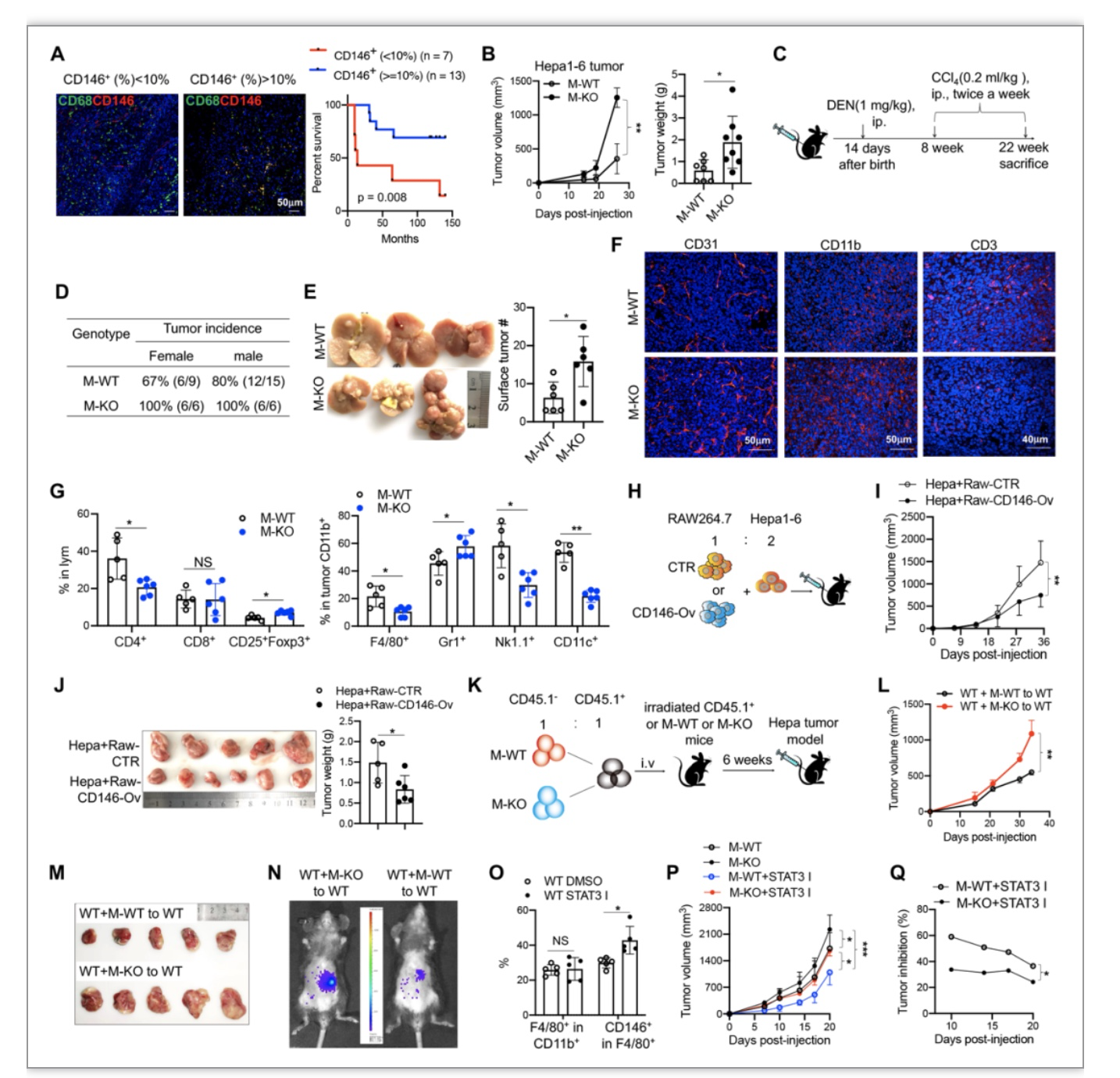
图3. CD146促进巨噬细胞的抗肿瘤活性。
为了进一步阐明CD146+巨噬细胞的抗肿瘤机制,研究者利用T细胞敲除小鼠、巨噬细胞/肿瘤细胞共注射模型等,发现CD146+巨噬细胞的抗肿瘤活性主要依赖于T细胞。深入研究发现CD146的缺失导致JNK信号的上调;JNK通路上调会产生两方面的作用:第一,促进巨噬细胞分泌更多的趋化因子(包括CCL2、CCL3、CCL4 、CXCL2、CXCL5等),增加MDSC向肿瘤微环境中的浸润;第二,促进炎症小体活化的抑制分子TMEM176B的表达,进而抑制巨噬细胞的NLRP3炎症小体信号通路的激活,减少IL1β和IL18的分泌。这两方面的共同作用进一步抑制了微环境中肿瘤杀伤性T细胞的募集和功能,从而促进肿瘤的进展(图4)。
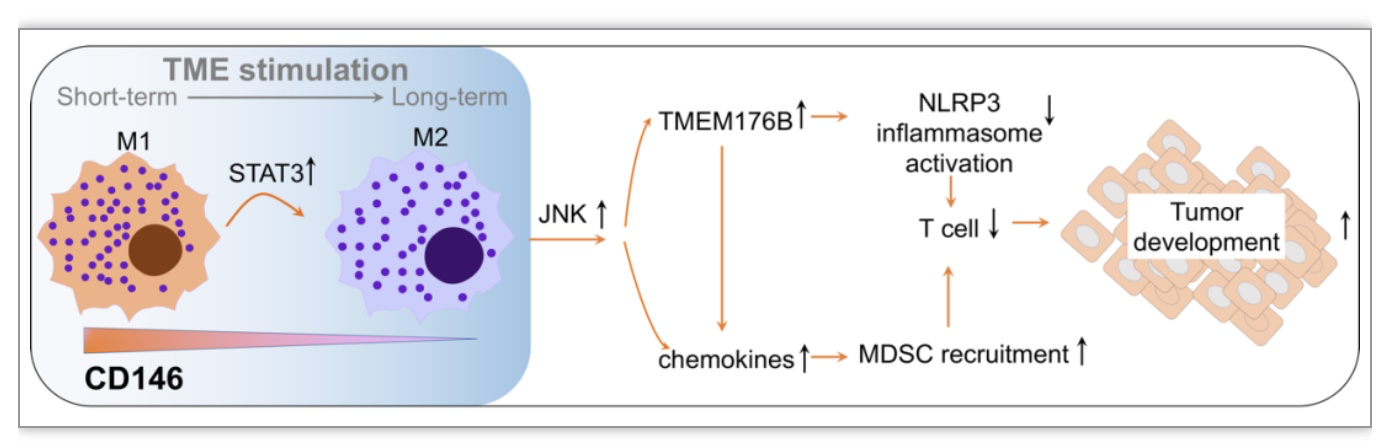
图4. CD146+巨噬细胞在肿瘤微环境中的变化规律及作用机制。
CD146分子被认为是肿瘤血管生成的标志物,并被确定为癌症治疗靶点。研究者实验室前期研究表明,利用功能抗体AA98靶向不同类型肿瘤的CD146,可以达到10-70%的肿瘤抑制效果。因此,研究者检测了抗CD146 功能性抗体AA98联合TMEM176B抑制剂的肿瘤联合治疗效果,结果显示该治疗策略比单独使用AA98抗体具有更好的抗肿瘤效果(图5)。
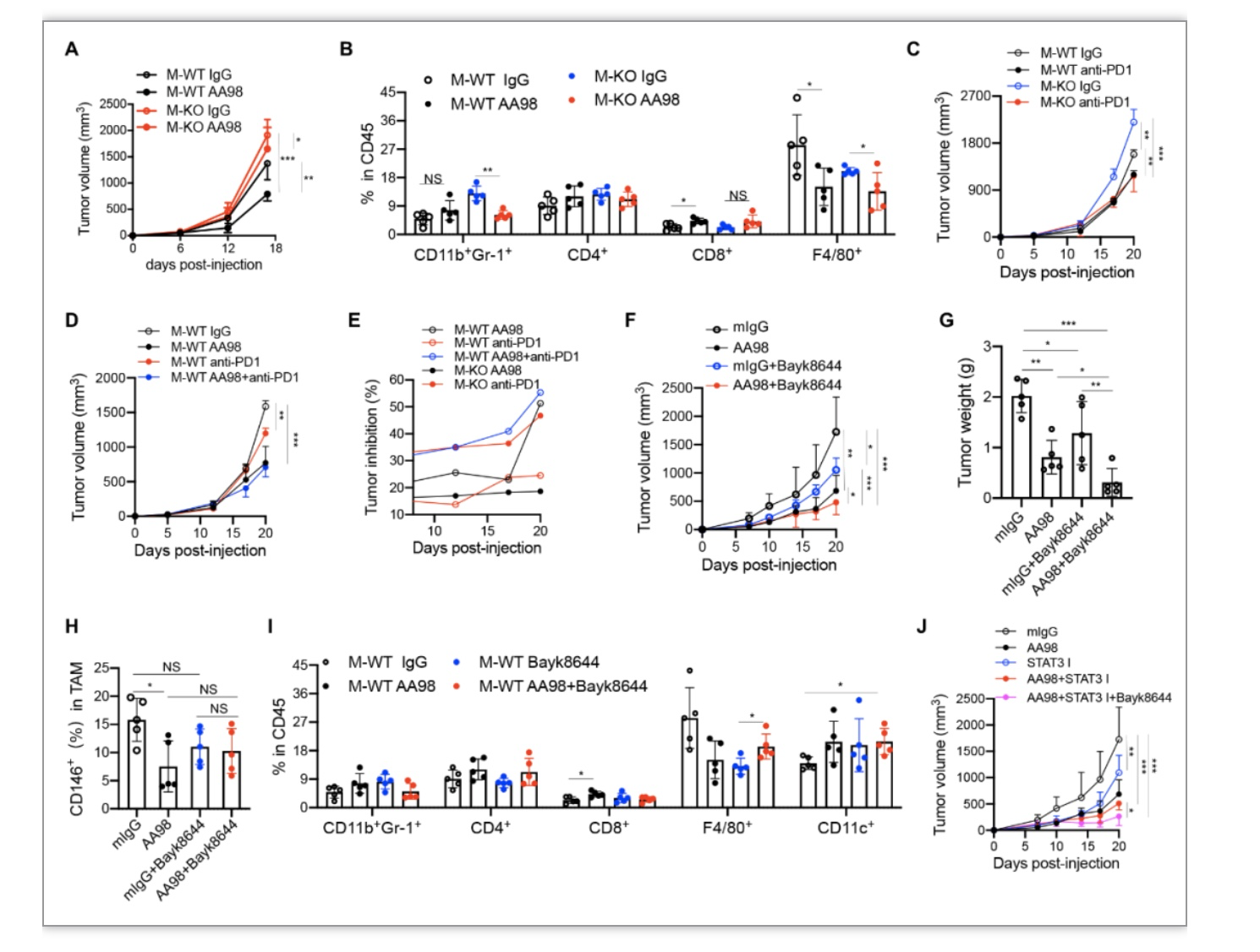
图5. 抗CD146+TMEM176B抑制剂联合治疗增强了抗肿瘤免疫。
总结:本研究揭示了CD146+巨噬细胞在肿瘤微环境中的变化规律及作用机制,为靶向TAM的肿瘤治疗提供了新的见解。

