过往的研究表明,类风湿性关节炎(rheumatoid arthritis, RA)与2型糖尿病(Type 2 Diabetes, T2D)的致病机制存在潜在联系。其中,慢性炎症和葡萄糖代谢紊乱之间的关系错综复杂,二者能够互相促进,形成恶性循环,进一步加速两种疾病的发展。有报道指出,糖尿病患者患RA的风险高出非糖尿病患者约55%;RA患者中,约有40%会出现胰岛素抵抗(IR),其T2D患病率增加15%,合并糖尿病的患者约为15-19%。此外,参与葡萄糖代谢的醛糖还原酶(AR),其表达在糖尿病人中显著上调,体内外研究均已证实抑制AR可有效改善其所介导的炎症反应;临床上,AR抑制剂-依帕司他广泛用于治疗糖尿病并发症,并展现出良好的抗炎作用。然而,AR也作为机体抗氧化防御机制的一部分,参与催化不饱和毒性醛,如4-羟基-2-壬烯醛(4-HNE);这种不饱和醛类被证实参与RA等自身免疫疾病的发展或加重免疫反应。AR介导的炎症反应与毒性醛的解毒作用似乎推动着炎症向着两个相悖的方向发展。预示着,AR的作用及功能存在着一种微妙的平衡。提示抑制AR可能在不同的病理状态带来不同,甚至相反的结果。考虑到RA合并T2D患者可能需要依帕司他治疗糖尿病并发症,有必要研究依帕司他对RA的影响,以及AR在RA中的作用,为合并症患者的治疗提供新的见解。

AR表达水平在糖尿病人中升高,参与糖尿病并发症的病理进程。AR通常还在炎症相关疾病中上调,AR的催化产物Glutathionyl-1,4-dihydroxynonene (GS-DHN)可诱导激活多条炎症通路,如MAPK, NF-κB, AP-1等;抑制AR可在多种疾病中减轻炎症反应、缓解病情,如盆腔炎、败血症、气管炎以及缺血再灌注损伤等。然而也有研究证实在巨细胞动脉炎中,AR上调参与脂质过氧化毒性产物的解毒,减少动脉壁的氧化损伤;抑制AR导致HNE加合物累积,诱导动脉壁细胞凋亡。考虑到AR作用结果的多样性,以及RA合并糖尿病患者可能需使用AR抑制剂依帕司他治疗糖尿病并发症,有必要探索AR在RA中的作用,以及依帕司他是否影响RA的病理进程。澳门科技大学黄锦伟教授带领的研究团队研究发现:AR基因表达在RA患者中升高,AR表达水平与疾病活动性正相关,提示AR可能与RA的发展相关联。研究团队设计了一系列关节炎动物实验:(1)建立AIA大鼠模型,证实了模型大鼠滑膜中AR转录水平较对照组大鼠明显升高,与临床RA患者的检测结果相一致;(2)AR抑制剂依帕司他加重AIA大鼠疾病严重程度,尽管其在体外实验中对于AR介导的炎症展现出良好的抗炎作用;(3)通过AAV腺相关病毒介导的AR高表达AIA大鼠模型,发现其关节炎表型与未诱导AR基因高表达组相当,确认AR高表达并非导致RA慢性炎症的关键致病因素。研究团队证实在RA这种慢性炎症和持续氧化应激的病理状态下,机体中高表达的AR主要是负责催化不饱和毒性醛,发挥调节慢性炎症的作用。然而,AR抑制剂依帕司他的使用导致脂质过氧化毒性产物4-HNE累积,加剧炎症和自身免疫反应,提示对于糖尿病与RA的合并症患者,临床应谨慎使用依帕司他。为解决依帕司他加重关节炎副作用的问题,考虑到AR抑制剂抗炎的局限性,以及膳食补充剂NAC的抗氧化作用,团队提出将NAC与依帕司他联合使用,发现联合用药组显著减少AIA大鼠血清及滑膜中4-HNE的含量,缓解AIA大鼠关节炎表型,效果与阳性药MTX组相当,说明AR抑制依帕司他的抗炎作用被AR抑制介导毒性醛累积的副作用掩盖,在使用抗氧化剂减少4-HNE的生成后,AR抑制剂体现出其抗炎特性,发挥联合的抗关节炎作用。
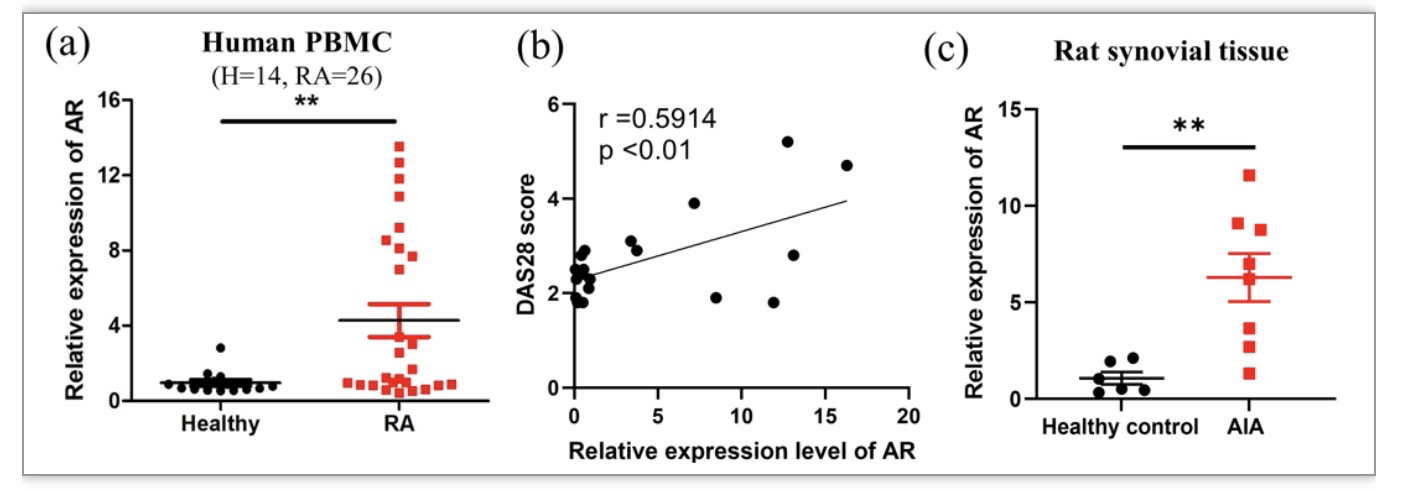
图1 风湿性关节炎ARR的表达及功能作用
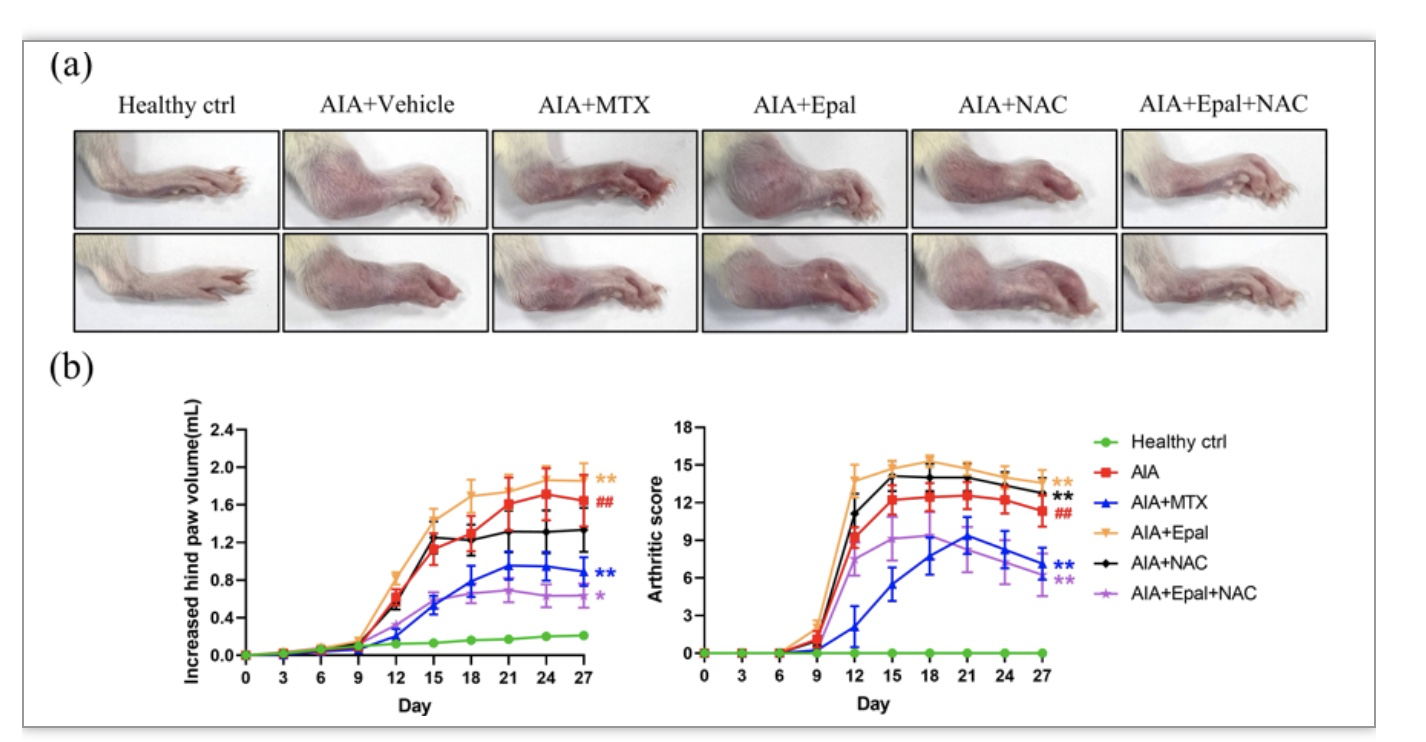
图2 AIA大鼠AR抑制剂、艾法雷他汀加剧了疾病的严重性
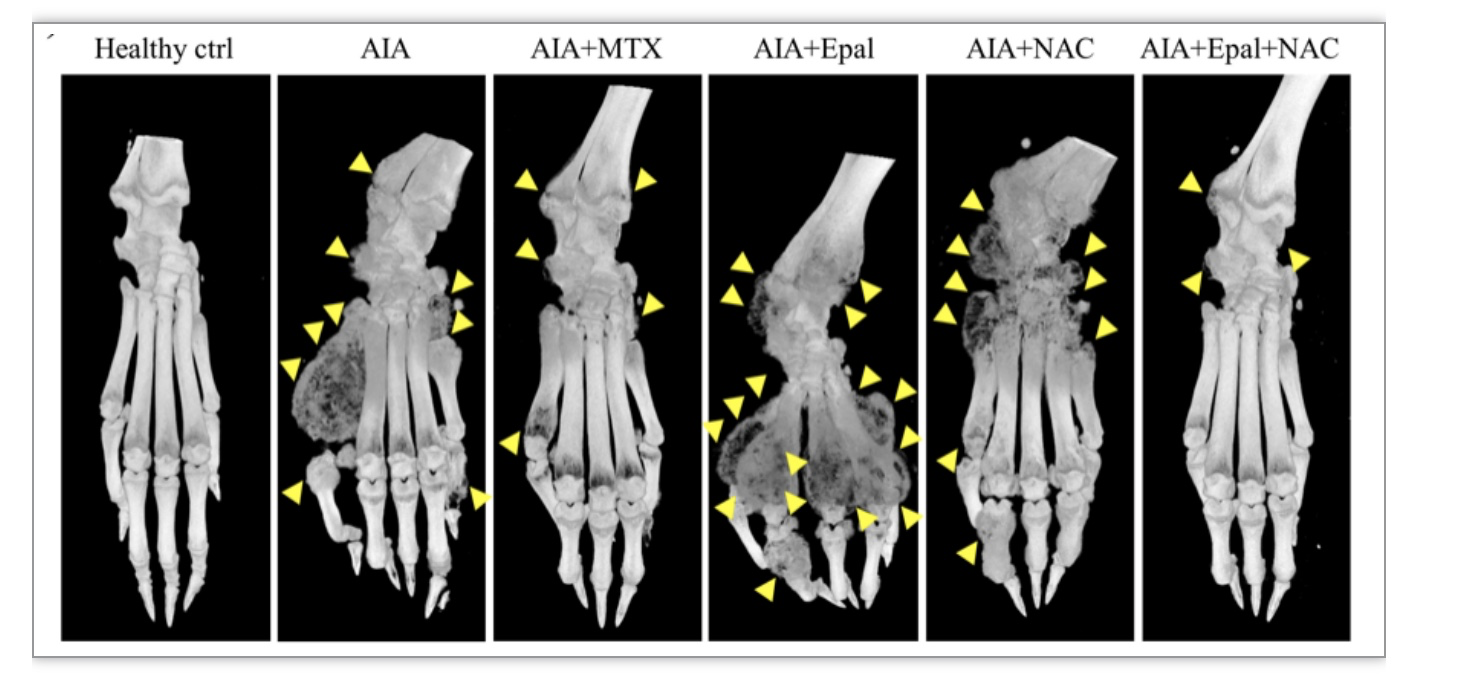
图3 损伤后肢关节骨的典型显微CT影像
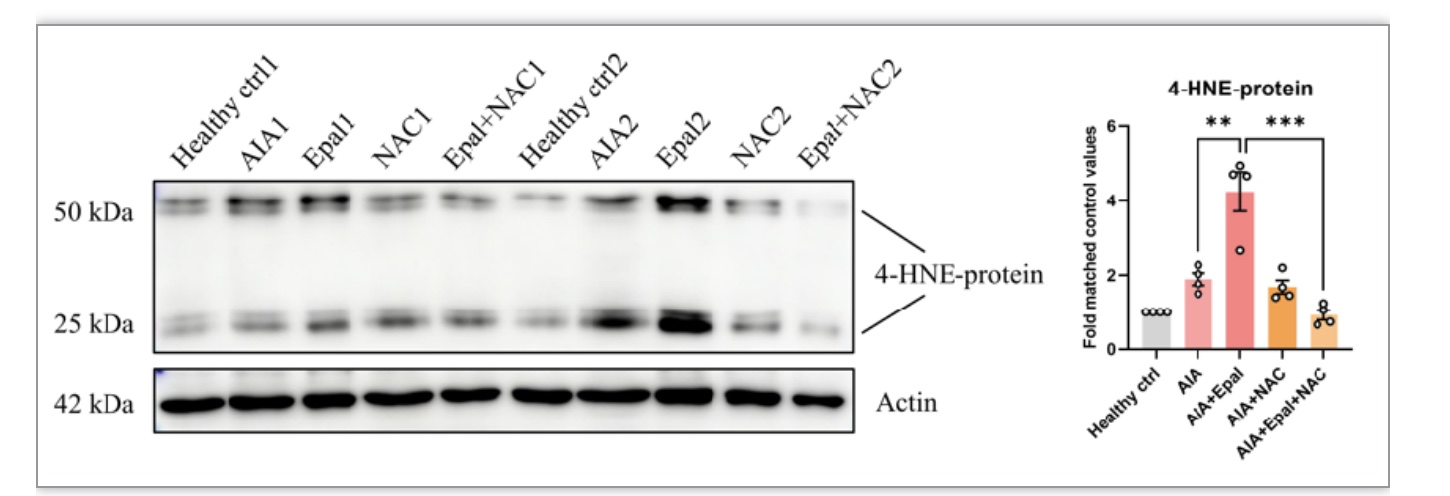
图4 4-Hnen蛋白结合物在经AIA治疗大鼠中的表达水平

图5 模式图

