早产是指妊娠满28周而不足37周的分娩,在全球新生儿死因中的占比高达35.4%,是新生儿死亡和出生缺陷的首要原因,其本质上与分娩的异常启动有关,因此解析分娩启动的动因和机制迫在眉睫。分娩启动的异常与母体众多因素有关,比如母体炎症、生活习惯、妊娠期并发症等,都可以影响妊娠进程和分娩结局;然而作为一个母胎间交互对话的复杂过程,分娩中胎源性因素的作用却长期为人们所忽视。课题组前期的研究表明,胎源性因素在分娩启动中起着重要的信号作用,如胎肺分泌的胎源性因子如SP-A、PAF缺失可导致过期产[1];并且过期产小鼠胎肺的发育成熟度显著低于正常胎肺[2]。然而作为胎鼠发育成熟的重要标志性事件,胎肺发育过程的代谢改变与母体的分娩启动是否直接关联尚未阐明。

研究者首先对过期产小鼠模型(steroid receptor coactivator,Src-1/-2 dKO)18.5dpc的胎肺进行RNA-seq分析,发现在Src-1/-2 dKO小鼠与WT小鼠胎肺中共有480个差异表达基因。根据Gene Ontology分析发现差异基因富集在多条与器官发育相关的通路上。由于Src-1/-2 dKO小鼠胎肺发育异常,其中9个差异表达基因,包括Crh、Gli3、Mycn、Gli1、Arg1、Lif、Crispld2、Ccbe1和Hsd11b1,与肺发育途径有关。在Src-1/-2 dKO小鼠胎肺中显著下调的转录本之一是Arg1,编码催化精氨酸代谢为鸟氨酸和尿素的关键酶(图1)。
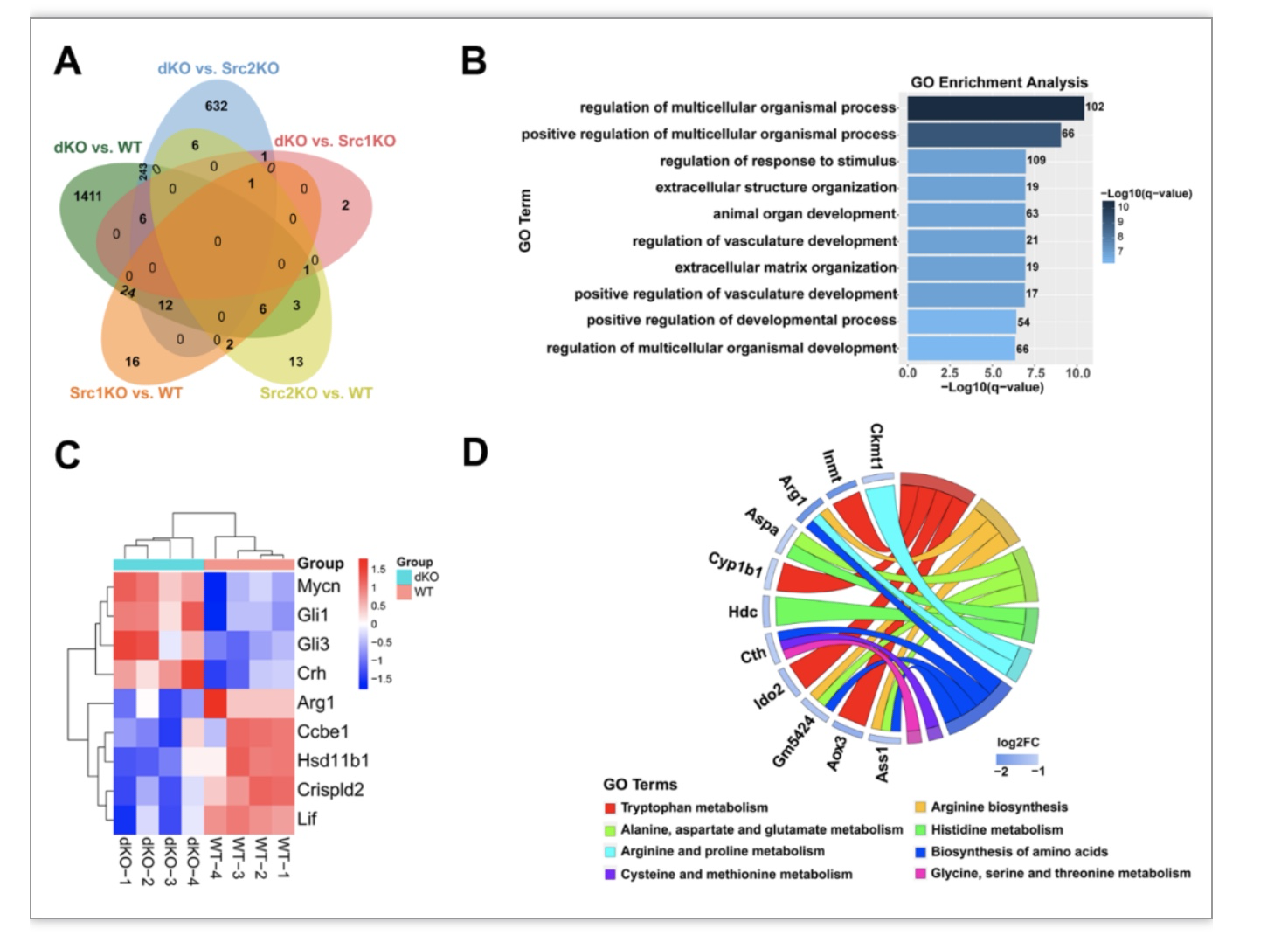
图1 精氨酸代谢通路在SRC-1/-2敲除胎肺中显著下调
接下来,研究者扩大样本量通过RT-qPCR和western blotting验证了胎肺中Arg1的mRNA和蛋白表达。与WT相比,Src-1/-2 dKO胎肺中的Arg1 mRNA和蛋白水平显著降低。免疫组化实验表明,与WT相比,Src-1/-2 dKO胎鼠18.5 dpc胎肺中ARG1的蛋白表达降低(图2)。
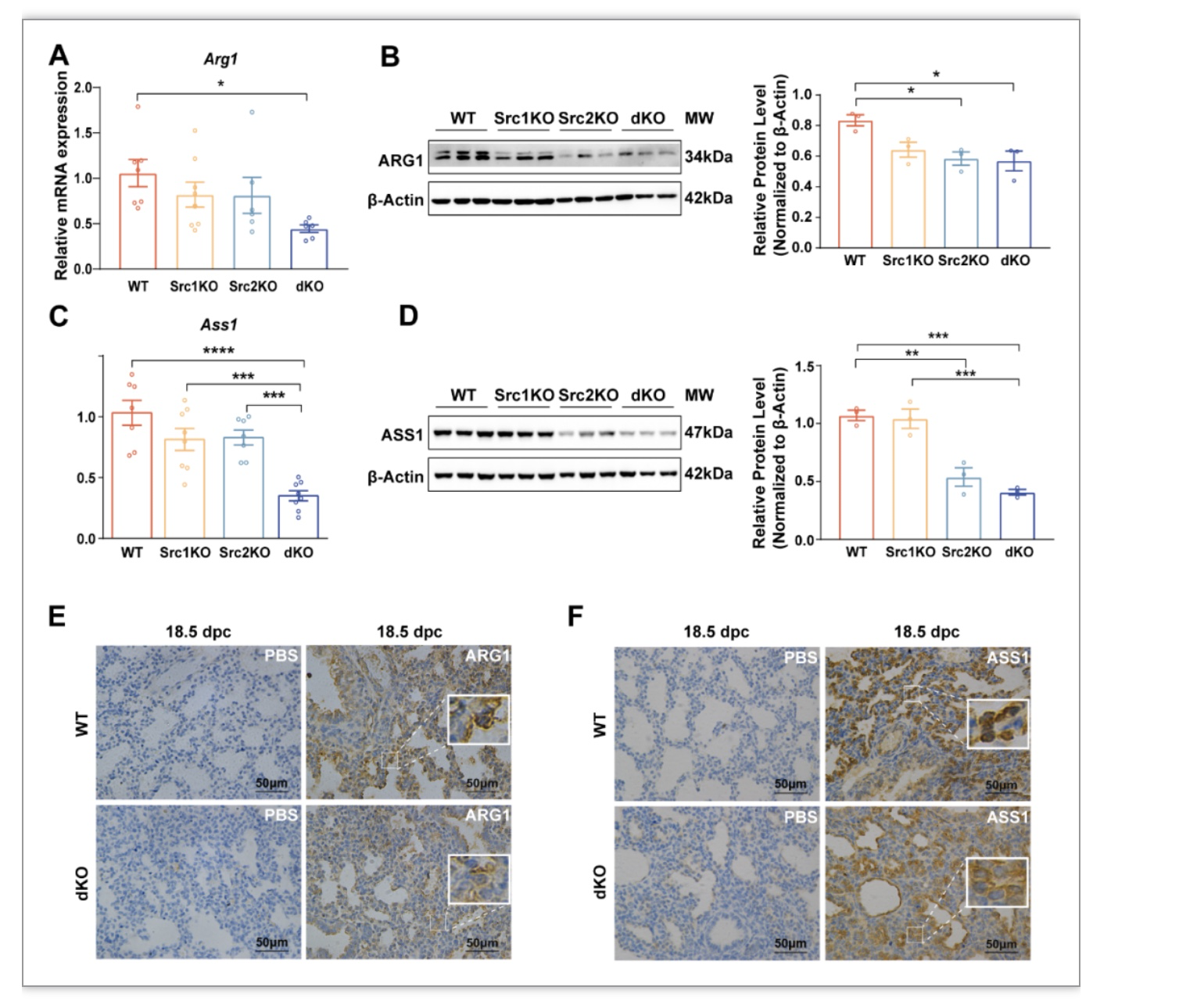
图2 ARG1在SRC-1/-2 dKO小鼠胎肺表达显著降低
研究者进一步采用靶向代谢组学监测技术针对核苷酸、氨基酸、能量代谢中间产物、神经递质、维生素等200种小分子代谢物进行检测和分析。结果显示,50种代谢物在SRC-1/2 dKO胎肺和WT胎肺之间的差异具有统计学意义。在KEGG通路富集分析中,精氨酸生物合成和代谢途径均显著富集:其中精氨酸含量升高,而鸟氨酸含量降低,与胎肺中ARG1的表达变化相一致(图3)。
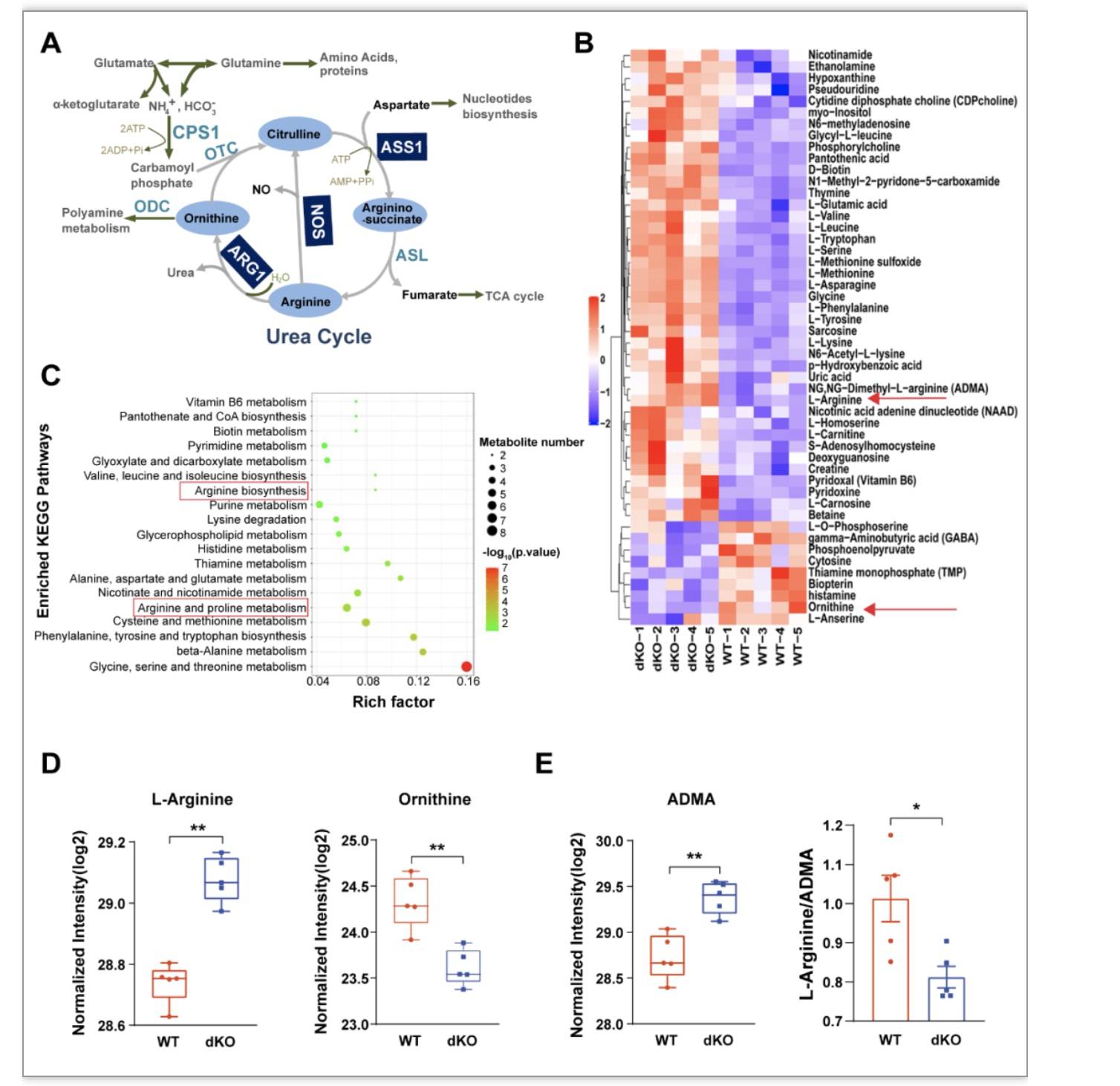
图3 SRC-1/-2 dKO小鼠胎肺中小分子代谢物表达情况
为了研究ARG1对胎肺发育的影响,研究者将靶向ARG1的腺相关病毒(AAV-shArg1)在13.0 dpc时注射到每个胚胎的胎盘中。孕鼠在分娩时被安乐死,并收取胎鼠的肺,肝脏,胎盘和子宫肌。与注射对照病毒(AAV-2/9)的小鼠相比,注射AAV-shArg1的小鼠胎肺中ARG1的蛋白质丰度显著降低。研究者利用Western blotting和免疫荧光观察Arg1敲低是否影响胎肺细胞的增殖或凋亡。Ki67的蛋白质表达不受胎肺中Arg1敲低的影响,而且,注射AAV-shArg1的小鼠胎肺和注射AAV-2/9的小鼠胎肺之间Ki67阳性细胞的数量没有统计学差异。但是注射AAV-shArg1的小鼠胎肺组织中cleaved caspase3表达显著增加。此外,免疫荧光显示AAV-shArg1注射小鼠的胎肺中TUNEL阳性细胞的数量在I型肺泡上皮细胞和II型肺泡上皮中均显著增加。体外实验发现L-精氨酸可诱导肺上皮细胞凋亡(图4)。
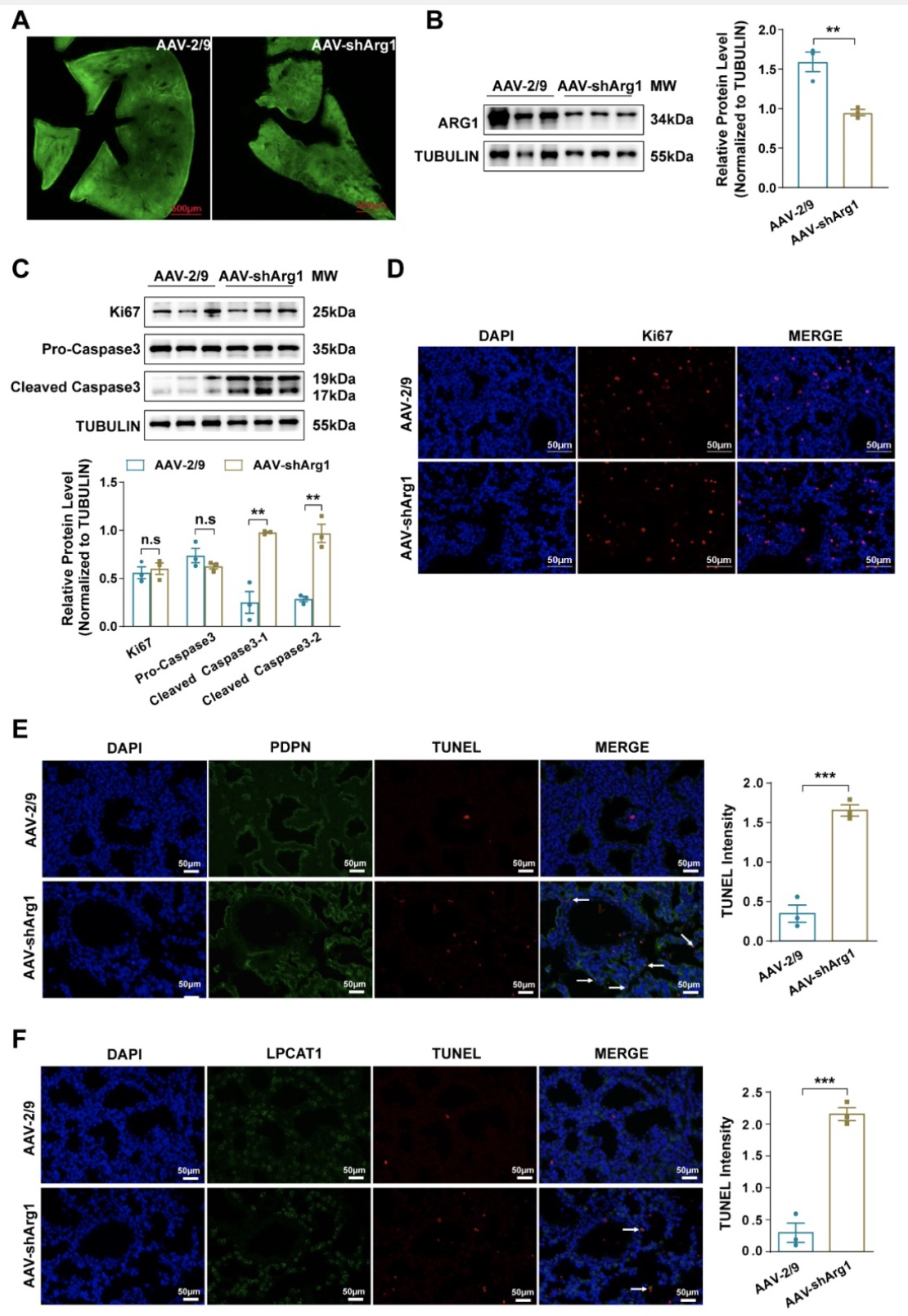
图4 Arg1敲低促进肺泡上皮细胞凋亡
有趣的是,研究者观察到胎肺中Arg1敲低的母鼠妊娠期延长,分娩启动延迟,平均分娩时间为21.375 ±0.473天,显著高于对照组的19.5 ±0.204天。体外细胞实验发现L-精氨酸处理显著抑制子宫平滑肌细胞的自发性收缩。注射AAV-shArg1孕鼠子宫肌收缩相关蛋白(CX43、OXTR、COX2和PTGFR)表达均显著降低,炎性反应通路蛋白NF-kB的磷酸化水平降低(图5)。
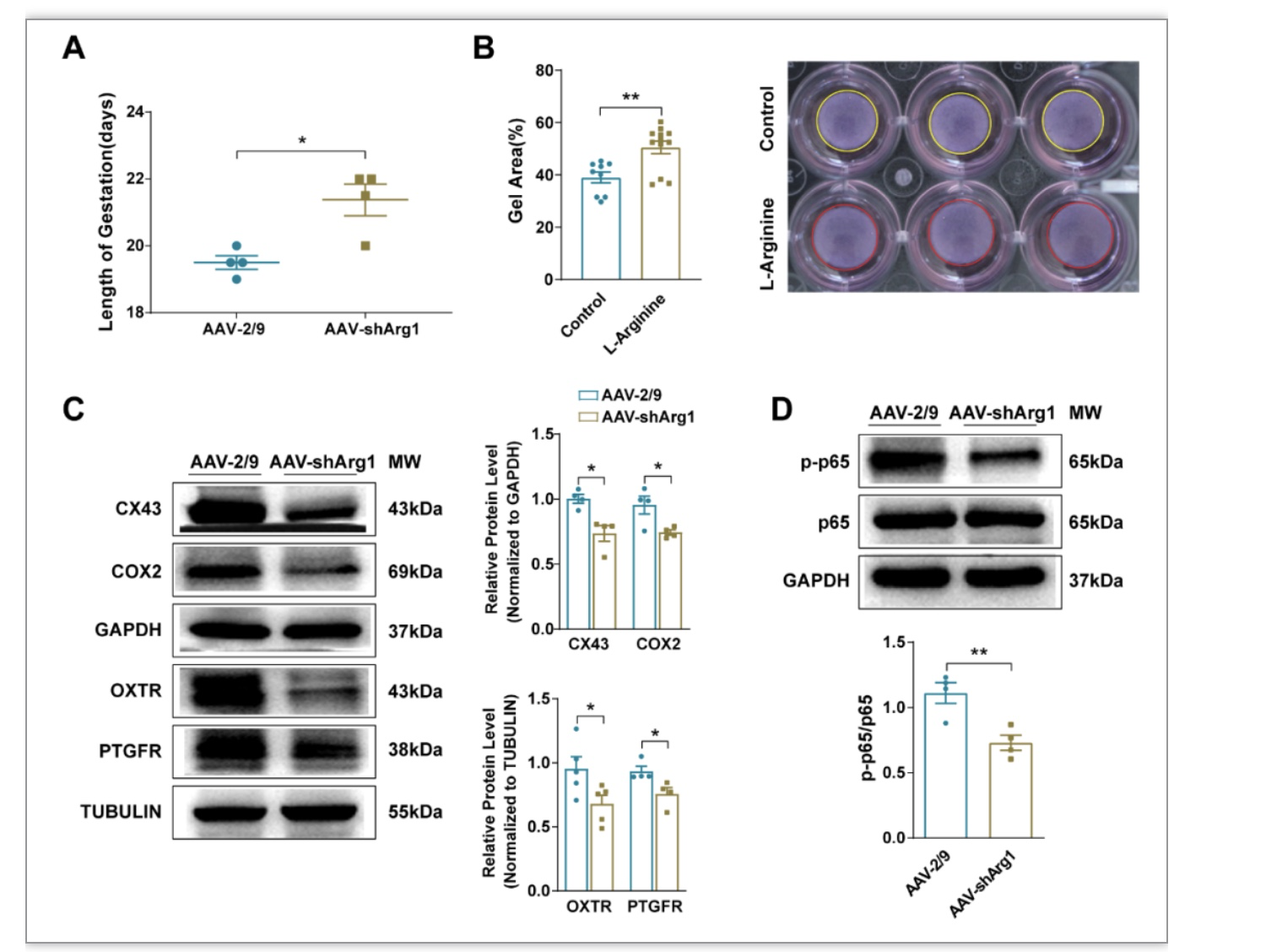
图5 L-精氨酸抑制子宫平滑肌收缩延缓分娩启动
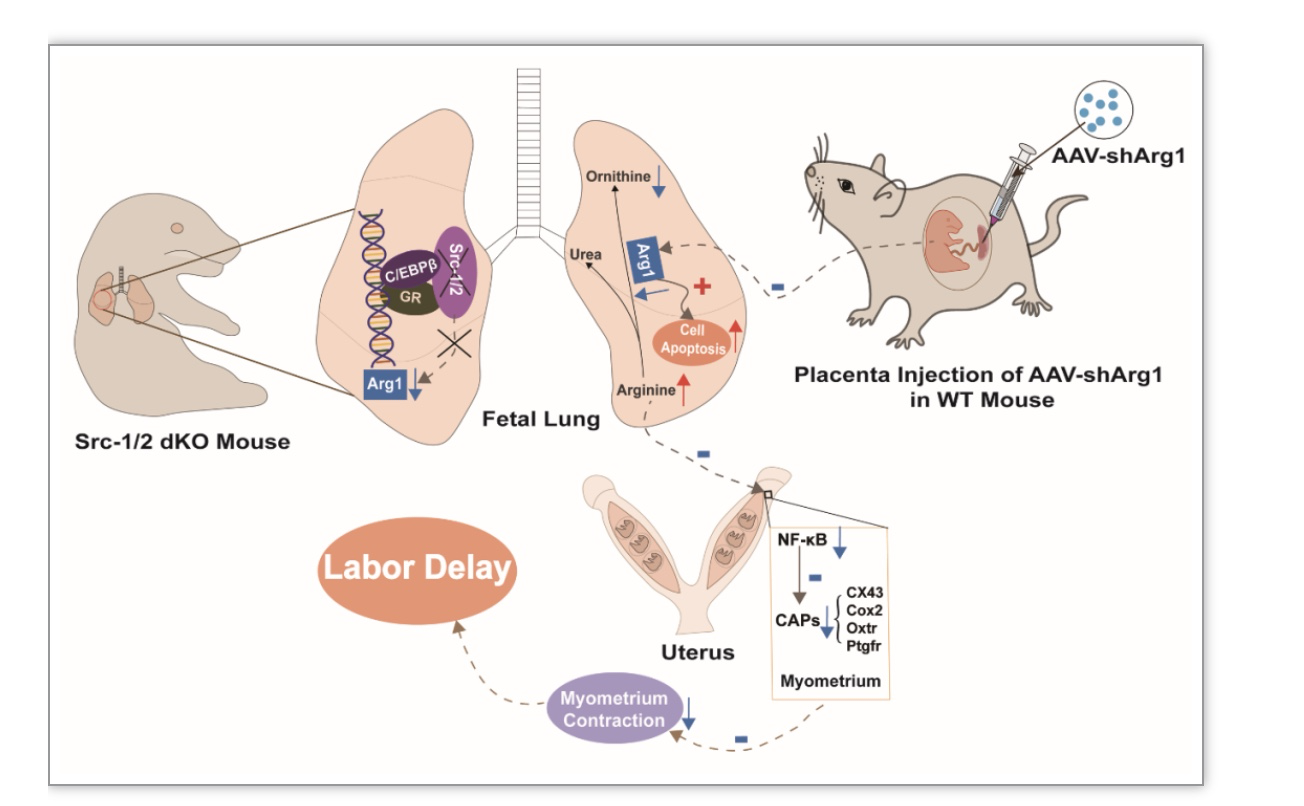
图6 胎肺Arg1的表达调控及其在胎肺发育和分娩启动中的协调作用
综上,该研究从氨基酸代谢的角度揭示了妊娠中晚期胎肺中精氨酸代谢关键酶的动态变化,并且发现Arg1缺陷导致的L-精氨酸累积不仅可以诱导胎肺上皮细胞凋亡进而导致胎肺发育异常,还可以通过旁分泌途径抑制子宫平滑肌的收缩,从而影响分娩启动的进程,为“胎源性因子”协调胎儿发育和分娩启动的学说提供了新的证据(图6)。

