马铃薯Y病毒属(Potyvirus)是最大的植物RNA病毒属,该属病毒种类多,寄主范围广[1]。在白菜、马铃薯和大豆等重要作物和果蔬上危害严重,造成巨大的产量与经济损失,严重危害我国粮食与果蔬生产安全[2]。水杨酸(salicylic acid,SA)及其受体蛋白NPR1介导的SA信号通路是植物免疫的重要组成部分,在维持植物基础抗性和建立系统获得抗性(systemic acquired resistance,SAR)中具有重要作用,并且可能拥有广谱的抗病功能[3, 4]。因此,对植物病毒与SA信号通路间相互关系进行深入研究,不仅有助于了解病毒蛋白的功能,也为挖掘和鉴定植物抗病基因奠定基础。
该研究发现SA信号通路在抑制Potyvirus属芜菁花叶病毒(TuMV)的侵染中具有重要的作用,而TuMV的NIb蛋白能够靶向水杨酸受体NPR1,阻止NPR1与SUMO3的相互作用及修饰,并导致后续苏木化修饰依赖的磷酸化过程不能进行,从而抑制水杨酸介导的植物抗病毒信号通路,以促进病毒的侵染。研究结果揭示了植物与病毒之间的一种新的分子“军备竞赛”,即Potyvirus属病毒利用NIb蛋白破坏NPR1的翻译后修饰,进而抑制水杨酸介导的植物抗病毒反应。

团队前期的研究发现TuMV编码的NIb与SUMO3相互作用并被其苏木化修饰,从而促进病毒感染[5]。由于NIb具有依赖SUMO3修饰的免疫抑制活性,猜想NIb可能与SUMO3底物直接相互作用以竞争SUMO3,影响其介导免疫途径。双分子荧光互补、酵母双杂交和免疫共沉淀等试验被用于证明这一猜想,结果显示(图1)NIb通过靶向NPR1包含His334和SIM3基序的ANK结构域在细胞核直接进行物理上的相互作用。进一步三种不同类型的npr1拟南芥突变体被用于分析NIb与NPR1相互作用在TuMV感染中的生物学功能。对接种TuMV-GFP后的WT和npr1突变体中的病毒含量进行分析,侵染叶面积、ELISA和RT-qPCR等试验均发现(图2)依赖于NPR1的免疫应答抑制会TuMV感染。为探究NIb对NPR1免疫信号途径影响,利用竞争性试验(图3)发现NIb通过靶向NPR1的SIM3基序,阻止NPR1与SUMO3的相互作用及苏木化修饰,从而抑制了npr1介导的抗病毒反应。此外,本研究还发现NIb本身被SUMO3的苏木化修饰不是NIb与NPR1的相互作用所必需的,但可以增强两者互作强度。有研究显示NPR1 Ser11/Ser15位点的磷酸化与NPR1的活性相关[6]。因此,对NIb与Ser11/Ser15的磷酸化关系进行了探究,构建NPR1多种突变型并使用双分子荧光互补以及酵母双杂交进行检测,发现(图4)NPR1 Ser11/Ser15位点的磷酸化促进NPR1-NIb相互作用。回补NPR1突变型得到转基因植株,其中表达不能与SUMO3互作同时模拟永久磷酸化的NPR1突变体的转基因植物,在不影响生长发育的前提下,赋予植株对TuMV非常好的抗性(图4)。该研究还证明NIb靶向NPR1,并且抑制NPR1与SUMO互作和苏木化修饰,是该属病毒NIb蛋白的一种高度保守能力。本研究结果为创制对该属病毒具有广谱抗性的作物提供了新的靶标,对构建新的抗病毒策略具有重要意义。
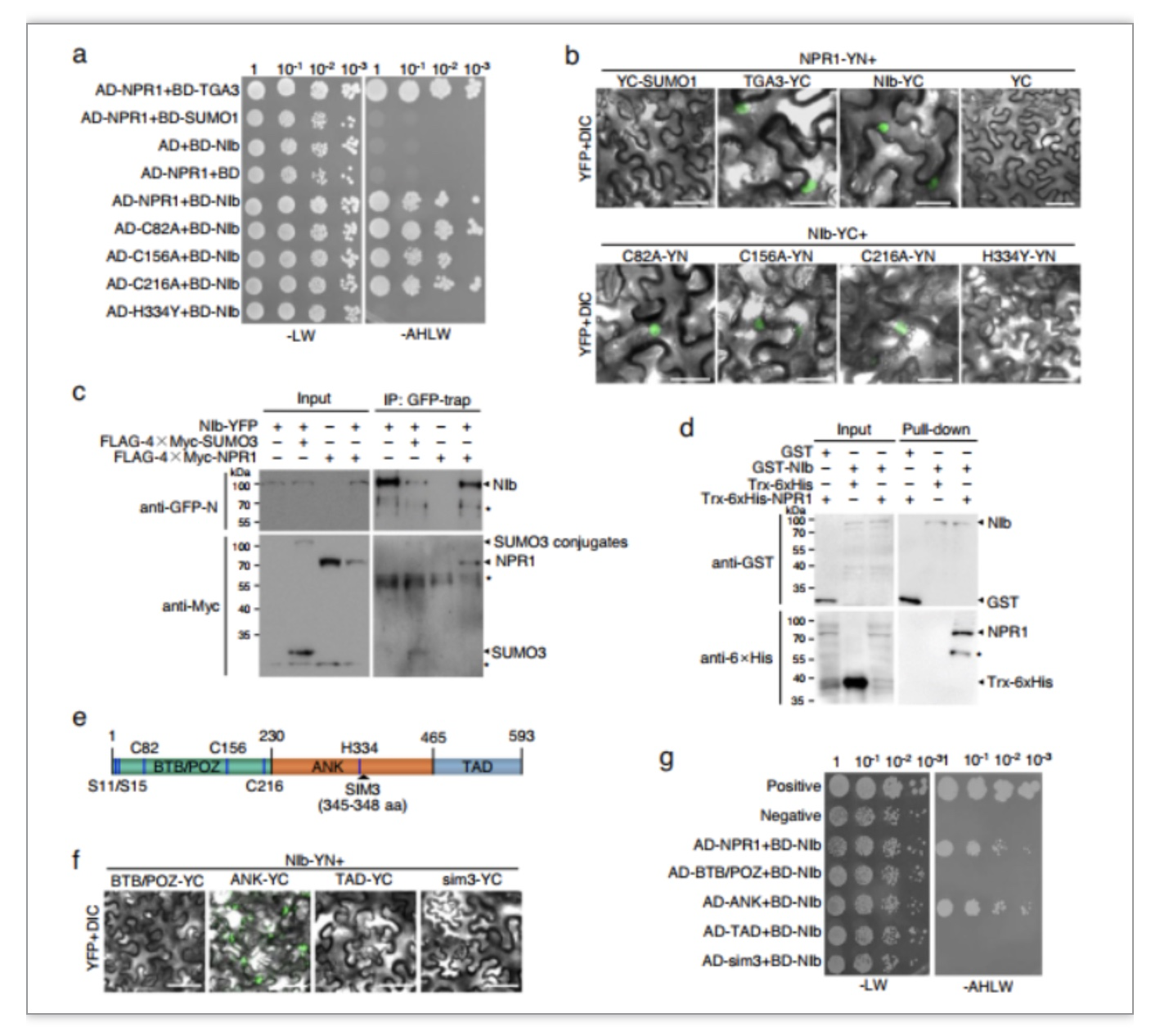
图1 TuMV NIb interacts with Arabidopsis NPR1
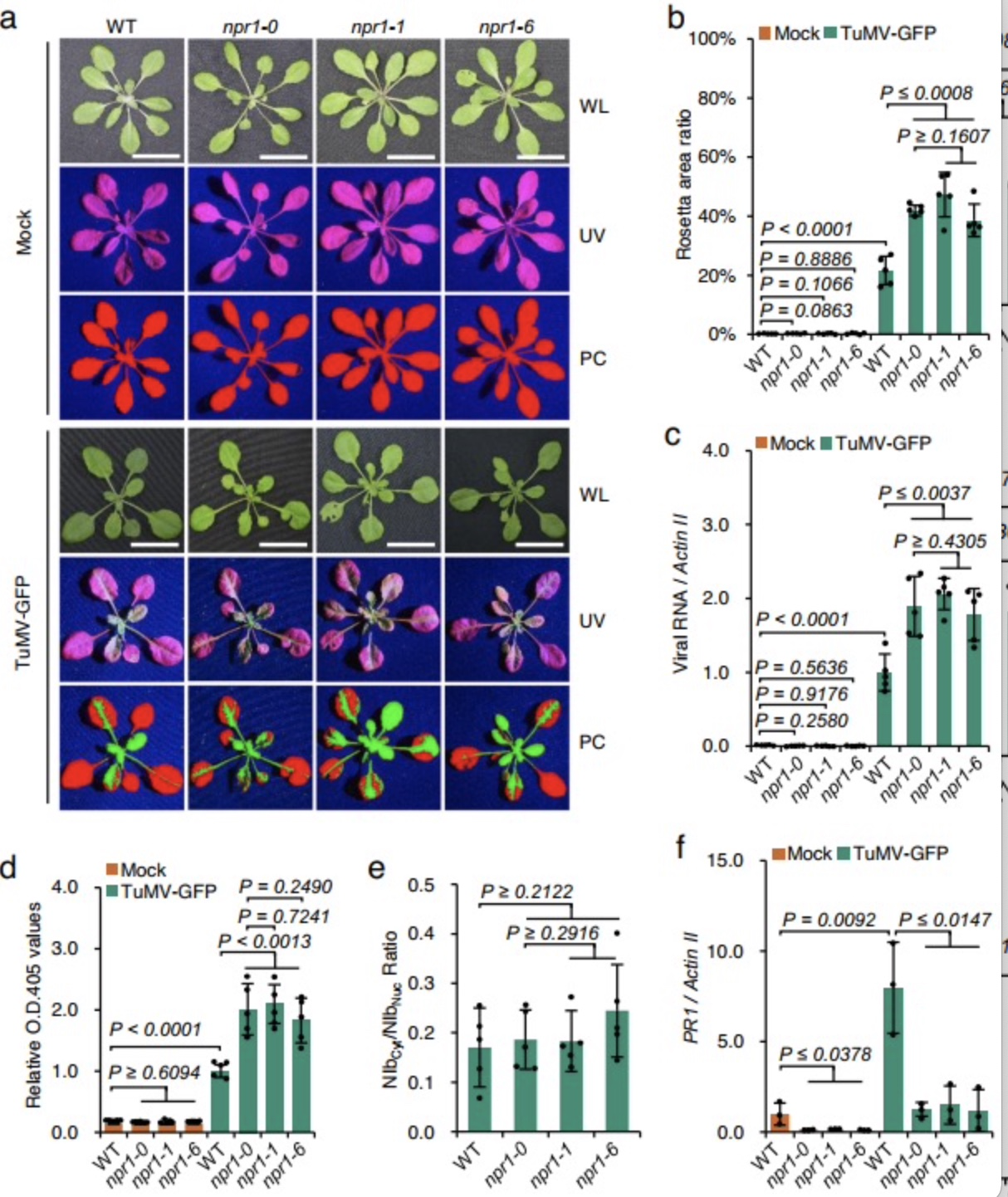
图2 npr1 mutants are hypersusceptible to TuMV infection
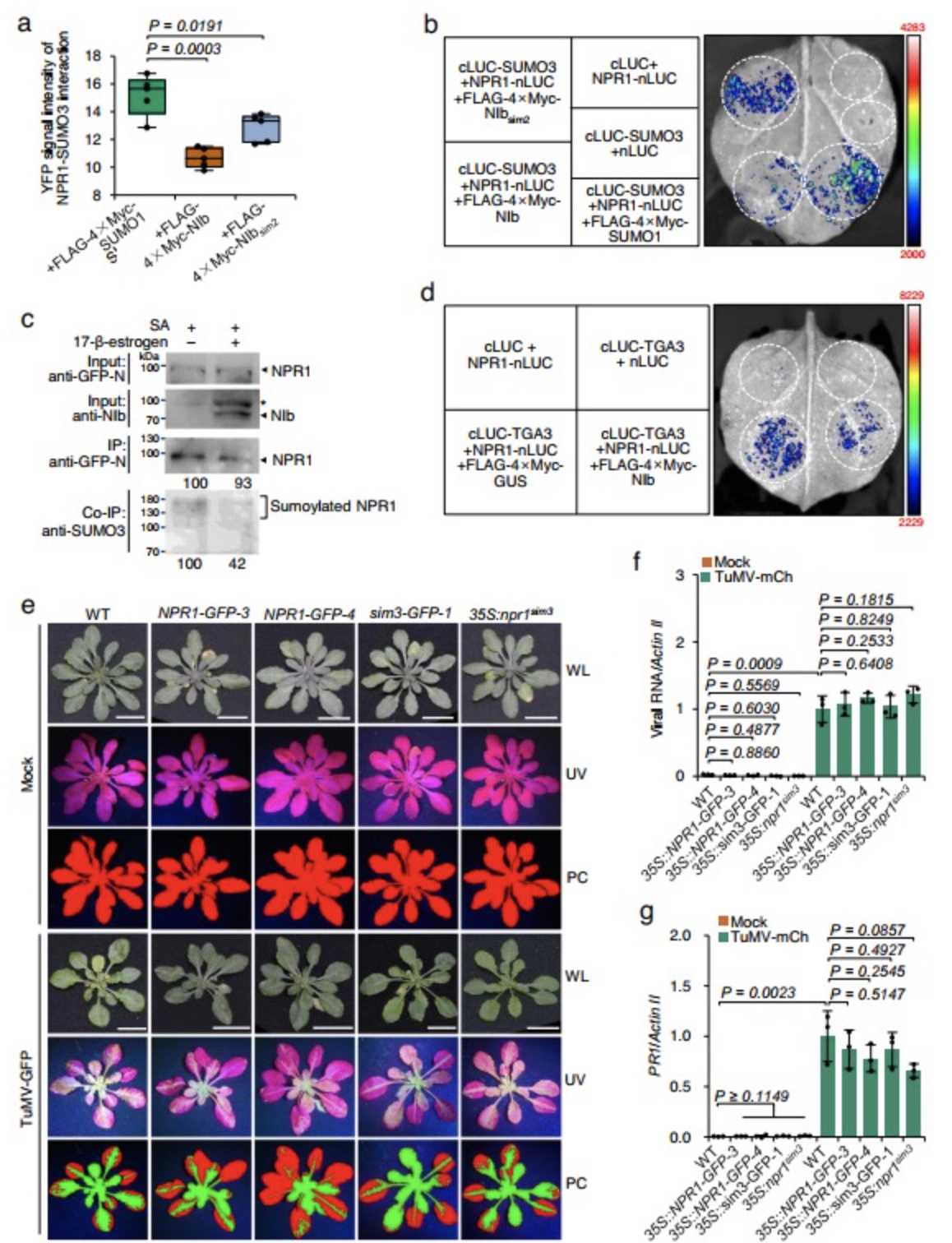
图3 NIb inhibits NPR1 from interacting with and being modified by SUMO3
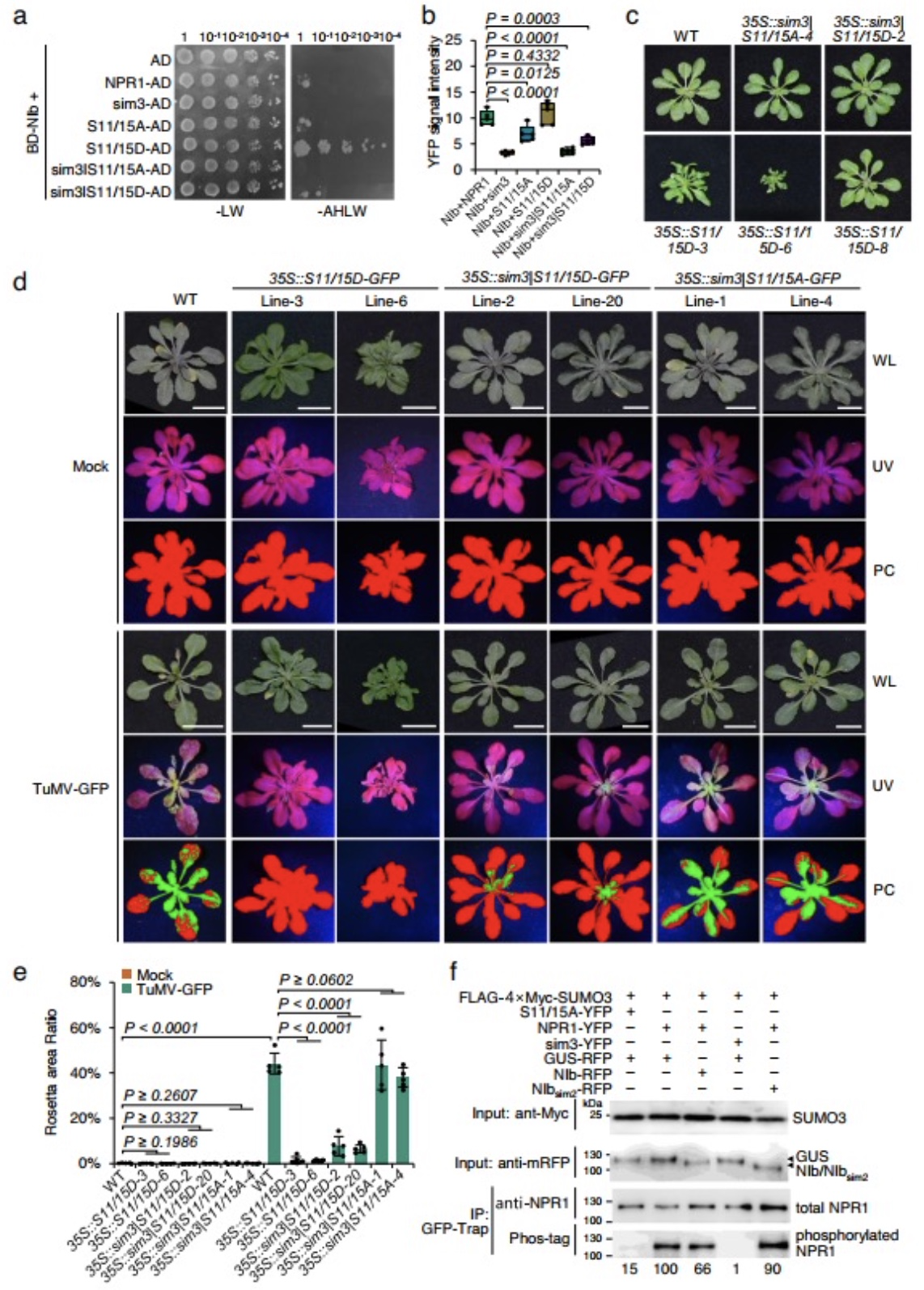
图4 NIb attenuates the phosphorylation of NPR1 at Ser11/Ser15.
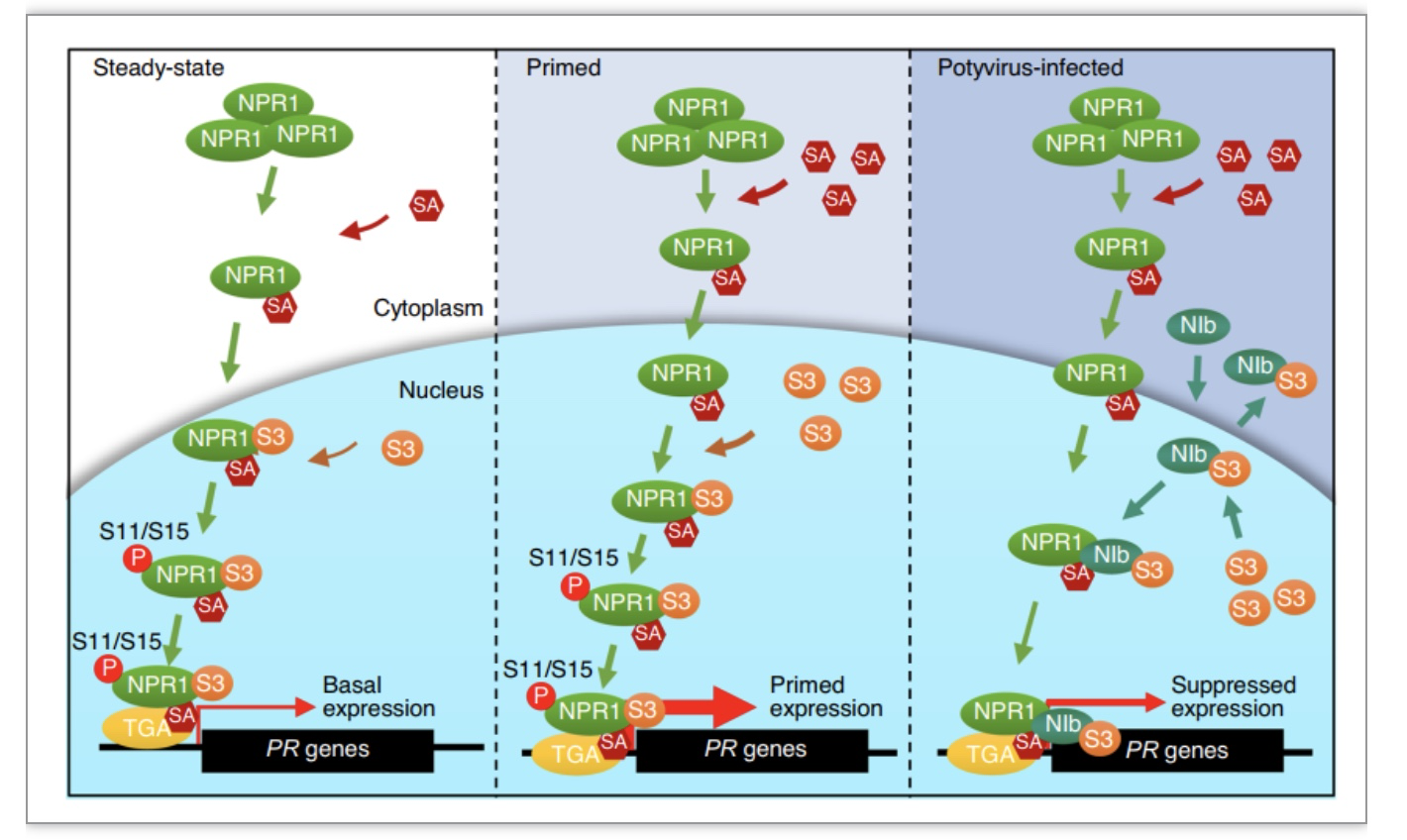
Potyvirus属病毒对多种作物的产量与品质造成巨大影响,但目前没有有效的措施或者广谱的抗病毒基因被发现,该研究选择TuMV为试验病毒,对NIb蛋白与水杨酸受体蛋白NPR1的相互作用及其对SUMO3介导免疫反应的影响进行研究,提出了该属编码的NIb蛋白抑制NPR1介导免疫途径的分子机制(图5)。为深入解析NIb在免疫途径中发挥重要作用提供理论依据,为鉴定植物抗病基因奠定基础,也为挖掘新的突变体材料开辟方向。该研究发现NIb与已知的SUMO3底物可能均具有相互作用,但是仅选择NPR1作为对象进行了后续试验。猜测NIb可能也会影响其他底物蛋白的相关功能,以达到促进病毒复制的目的,需后续进一步研究证明。

