胶质母细胞瘤(Glioblastoma,GB)是恶性程度较高的原发性脑肿瘤,具有高异质性,耐药性和复发性的特点,病人中位生存期为14.6个月。研究显示,胶质母细胞瘤中存在高水平的内质网(Endoplasmic reticulum,ER)应激[1]。通常细胞会通过激活未折叠蛋白质反应(UPR)来减轻ER 应激。然而,严重的ER应激会引发UPR介导的细胞死亡。KEAP1-NRF2通路作为重要的抗氧化途径,可降低ROS水平减轻ER应激[2]。然而,KEAP1-NRF2通路的调控机制尚未完全阐明。所以,深入研究ER应激下胶质母细胞瘤细胞存活的机制可以揭示其潜在的治疗靶点。

研究者利用ER应激诱导剂Thapsigargin(TG)和Tunicamycin(TM)处理胶质母细胞瘤细胞发现SMURF1表达显著降低。敲低SMURF1增强UPR中的IRE1和PERK通路的表达,抑制ER-相关蛋白降解(ERAD)活性,并促进细胞凋亡。相反,外源性过表达SMURF1降低ROS水平,减轻UPR介导的细胞死亡。NRF2是调控抗氧化基因的关键转录因子。接下来,研究者研究NRF2在SMURF1介导的ER应激反应中的关键作用。研究发现敲低SMURF1显著降低NRF2的进核以及其下游靶向基因NQO1和HO1的表达,但过表达 SMURF1显著增加NRF2的进核。
进一步的研究发现,过表达SMURF1显著降低KEAP1(NRF2负调控因子)的蛋白水平。深入研究发现SMURF1与KEAP1相互作用并泛素化降解KEAP1,导致NRF2稳定(图1)。所以,SMURF1通过激活KEAP1-NRF2信号通路减轻ER应激。最后研究者也通过裸鼠异种移植实验证明了SMURF1缺失可降低胶质母细胞瘤的增殖和生长。
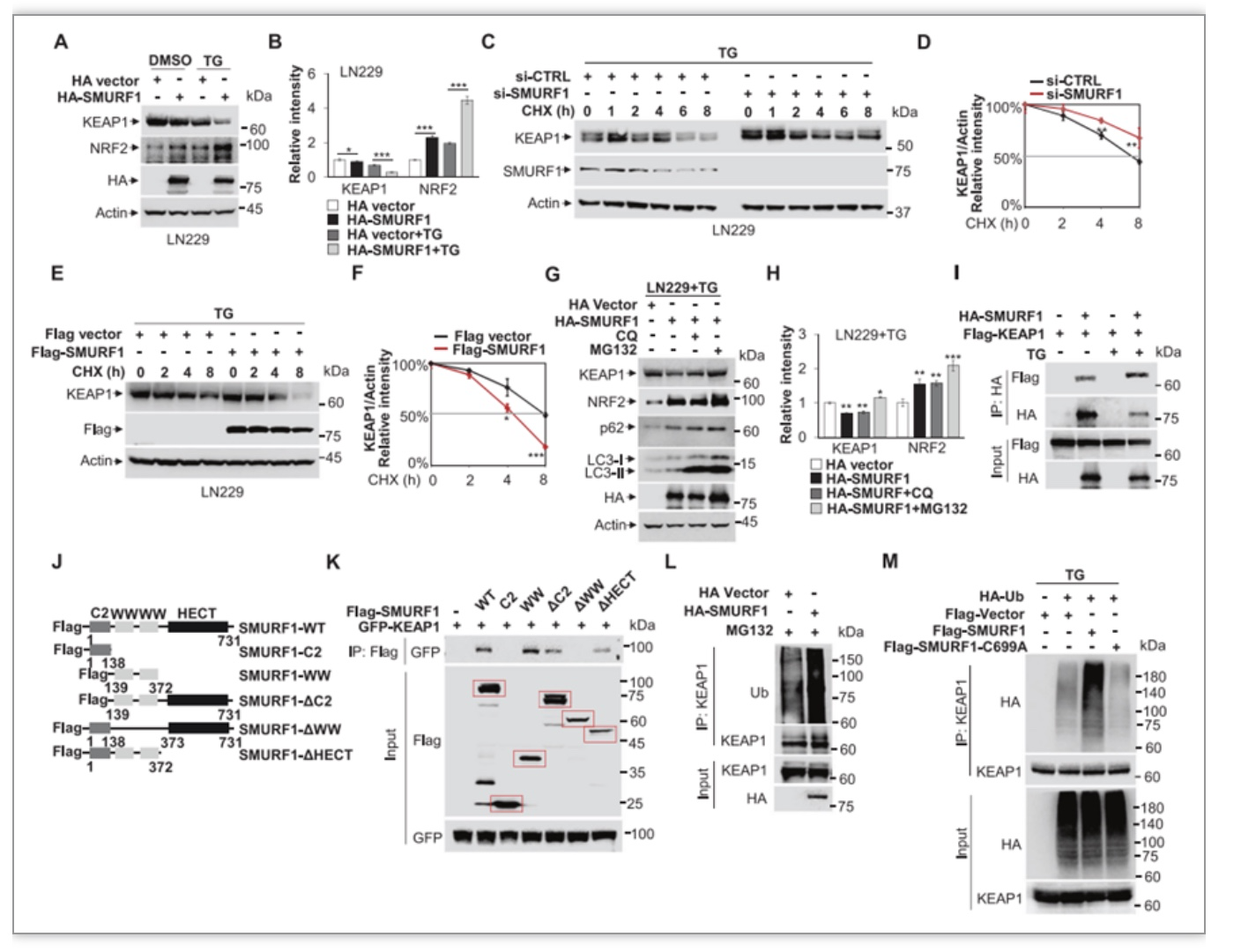
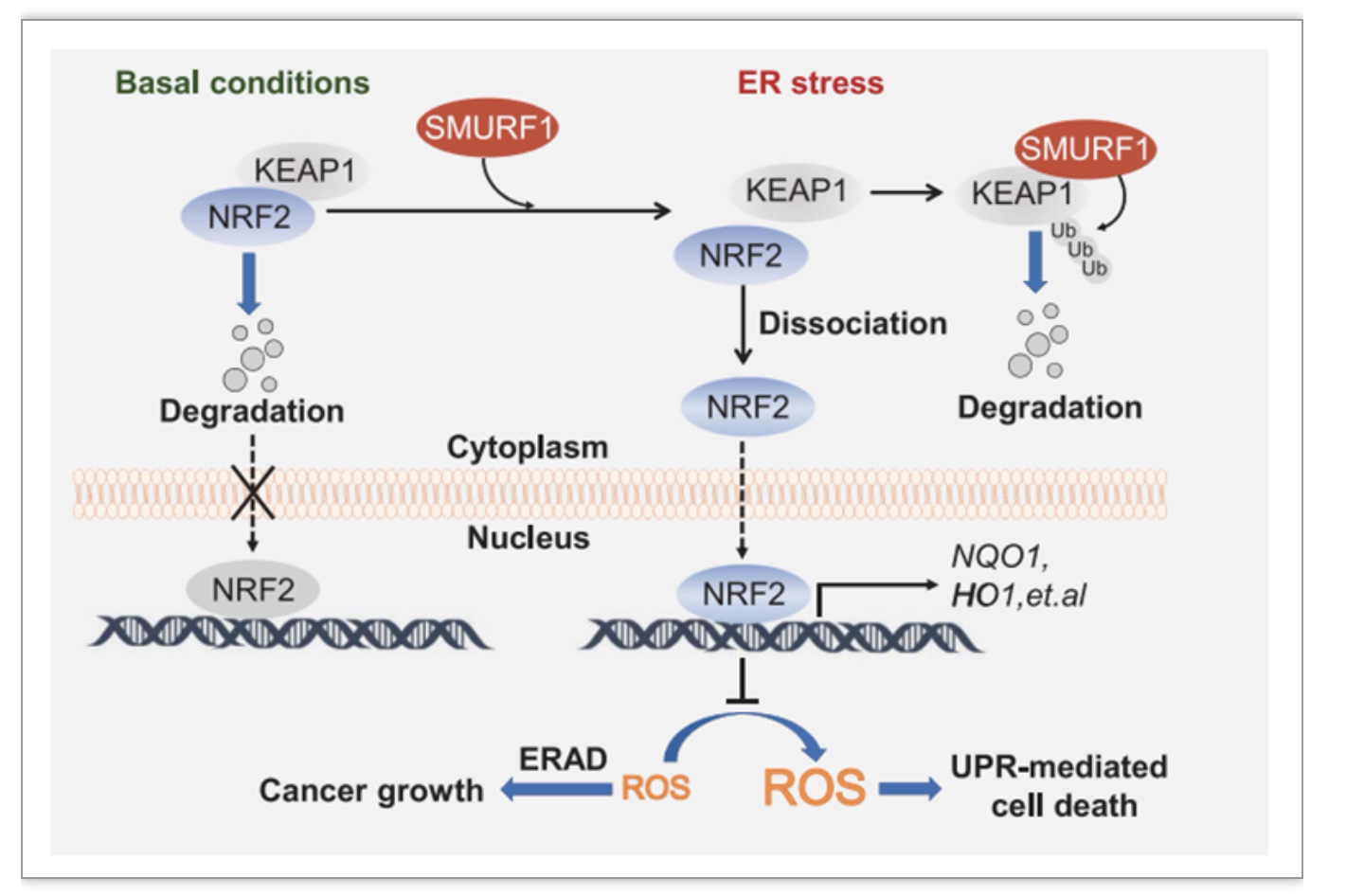
图2 SMURF1促进ER应激下肿瘤细胞存活模式图

