病毒感染是人类健康的一大威胁。每年仅由流感病毒引起的流行性疾病就会在全球造成大约300万至500万例严重病例。历史上因病毒感染产生的重大流行性疾病而死亡的人数更是不计其数,例如2019年由严重急性呼吸系统综合征冠状病毒2(SARS-CoV-2)引起的新型冠状病毒疾病(COVID-19)。利用全新技术开发的新型抗病毒药物或疗法将为有效应对这一威胁人类健康的疾病提供了一种思路。
以蛋白水解靶向嵌合体(PROteolysis-TArgeting Chimera, PROTAC)为代表的靶向蛋白降解(Targeted Protein Degradation, TPD)技术是一种新兴的药物开发平台。在过去的二十年里,靶向蛋白降解技术在癌症的基础研究和药物开发领域已取得了惊人的进展。近年来,利用靶向蛋白降解技术开发抗病毒药物的研究也相继出现。
Nucleozin是一个靶向作用于流感病毒核蛋白(Nucleoprotein, NP)的小分子抑制剂。研究者首先选择Nucleozin作为配体设计蛋白水解靶向嵌合体,并希望通过靶向降解流感病毒核蛋白实现抗流感病毒的作用。研究者其次基于Nucleozin的构效关系设计并制备了一个蛋白水解靶向嵌合体化合物库,然后使用携带GFP报告基因的重组流感病毒(NS1-GFP PR8 virus)对该化合物库进行筛选,最终发现了一个苗头化合物FM-74-103(下文简称103)。在未观察到细胞毒性的同时,103可以有效抑制流感病毒在肺癌细胞株(A549)中的复制,半数抑制浓度在纳摩尔水平。在人原代支气管/气管上皮细胞(HBTE)中,103表现出相同水平的抗流感病毒活性。定量蛋白质组学分析表明,103可以有效抑制流感病毒蛋白在A549细胞中的表达,同时完全清除细胞内翻译终止因子GSPT1。值得注意的是,该GSPT1清除现象在未被流感病毒感染的A549细胞中同样得以观察(图1)。由此可以推断,103可以通过以下两种机产生抗流感病毒活性, 1)直接降解流感病毒核蛋白;2)直接降解GSPT1,从而抑制流感病毒蛋白在人体细胞内的合成。研究者随后对这两种可能的分子机制进行了深入探索。
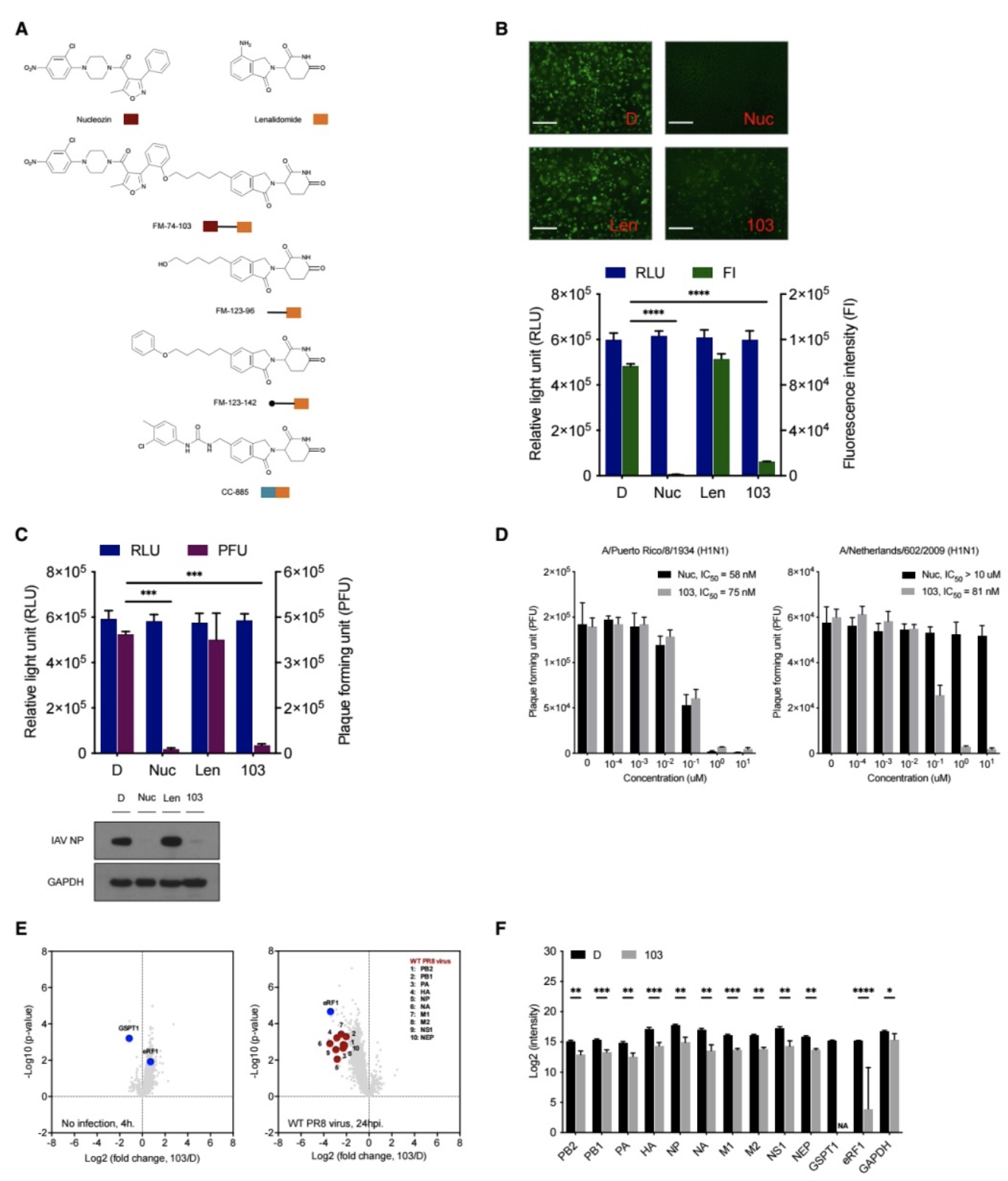
图1 化合物103抑制流感病毒在人体细胞内复制
作者首先通过质粒转染,在A549细胞中表达流感病毒核蛋白。在质粒转染24小时后,使用103处理细胞,细胞内流感病毒核蛋白的水平未发生变化。但是,如果在质粒转染的同时,使用103处理细胞,细胞内流感病毒核蛋白的水平显著降低。此外,在转染其它非流感病毒核蛋白质粒的同时,使用103处理细胞,细胞内相应蛋白的水平均显著降低。这些现象表明103不能直接降解流感病毒核蛋白(附图2)。
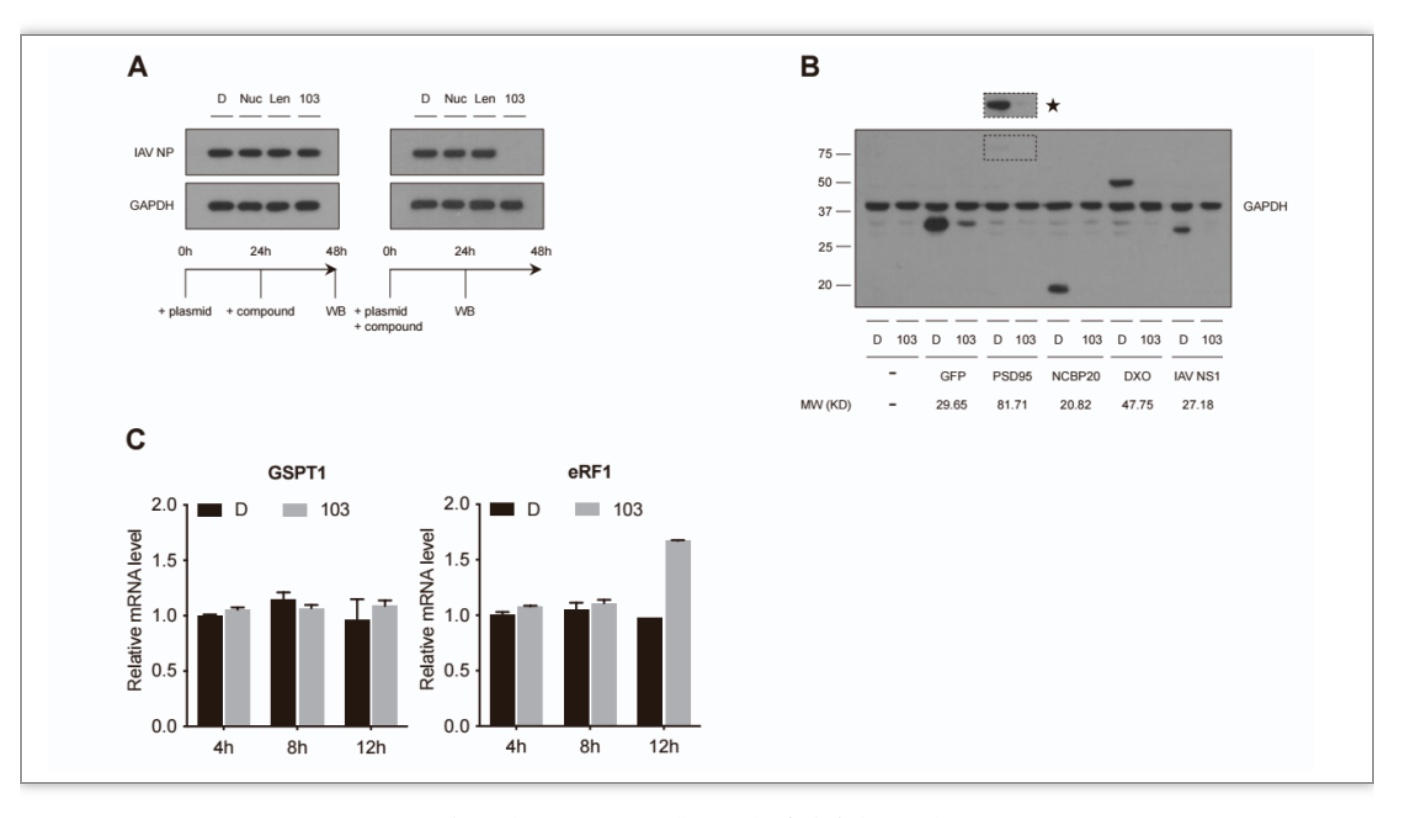
附图2化合物103无能靶向降解流感病毒核蛋白
由于GSPT1调控蛋白翻译过程中的终止步骤,研究者推断103可以通过降解GSPT1阻断流感病毒蛋白的翻译过程,从而抑制病毒在人体细胞内的复制。通过一系列化学和生物学实验,研究者证实103确实可以通过泛素-蛋白酶体途径特异性降解A549细胞中的GSPT1,并对103降解GSPT1所需的浓度,时间,可逆性,对于E3连接酶的依赖性,以及构效关系进行了系统研究。研究者同时发现,在A549细胞中,103诱导的GSPT1降解可以下调另一个翻译起始因子的水平,eIF2α,表明103的抗流感病毒活性不仅与其降解GSPT1相关,可能还与其下调eIF2α水平相关。(图2)。
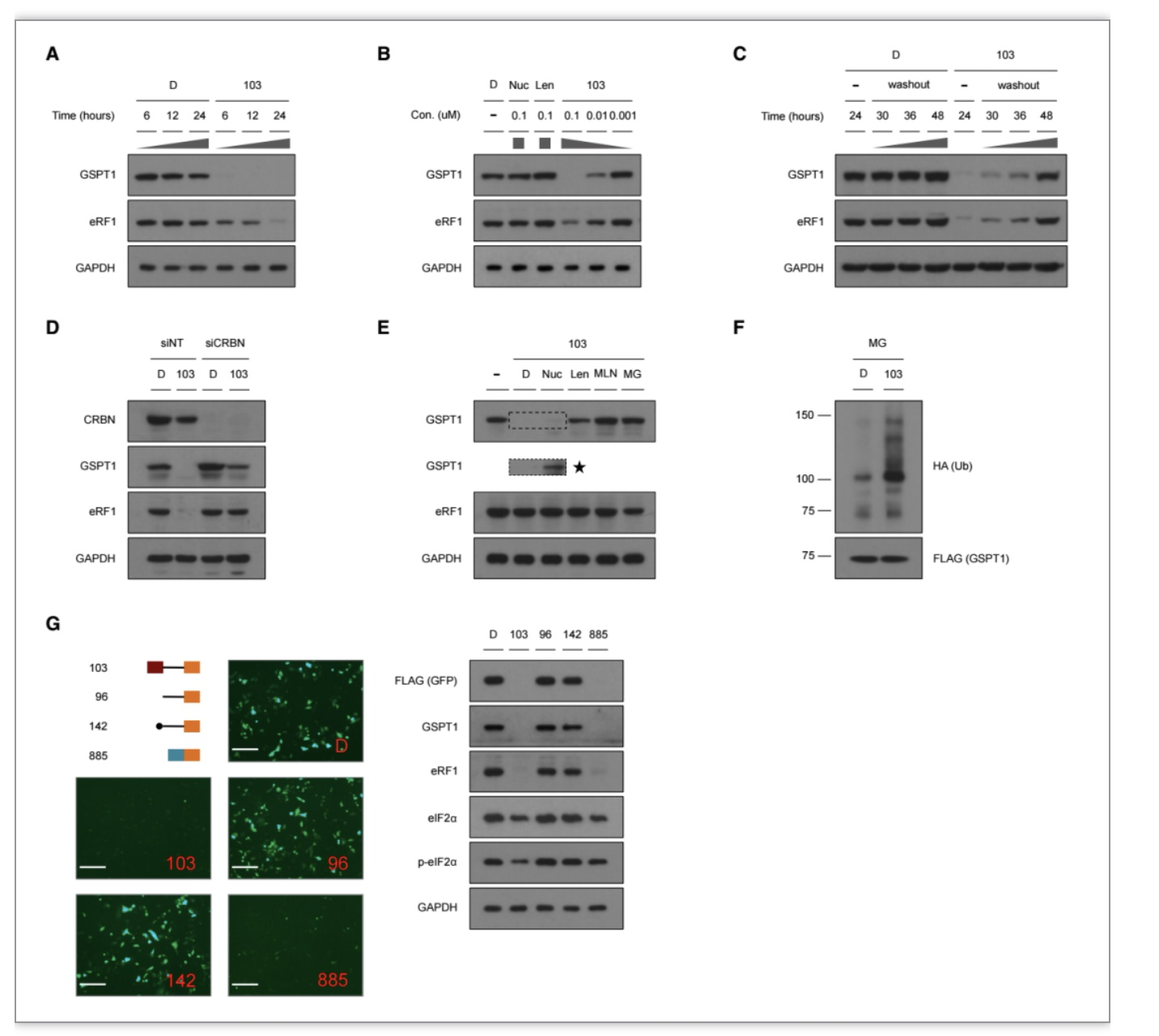
图2 化合物103选择性诱导GSPT1降解
研究者随后确定了103诱导GSPT1降解与其抗流感病毒活性的关联性。这种关联性是间接传递的,主要因为研究者发现利用RNA干扰(RNA)技术可以敲低GSPT1,敲低水平与103诱导的GSPT1降解水平相同,但是敲低GSPT1并没有导致显著的抗流感病毒活性。而敲低EIF2S1(编码eIF2α)则重现了103的抗流感病毒活性。这些现象表明,103是通过选择性诱导GSPT1的降解,进而抑制翻译的起始过程来发挥其抗流感病毒活性的(图3)。
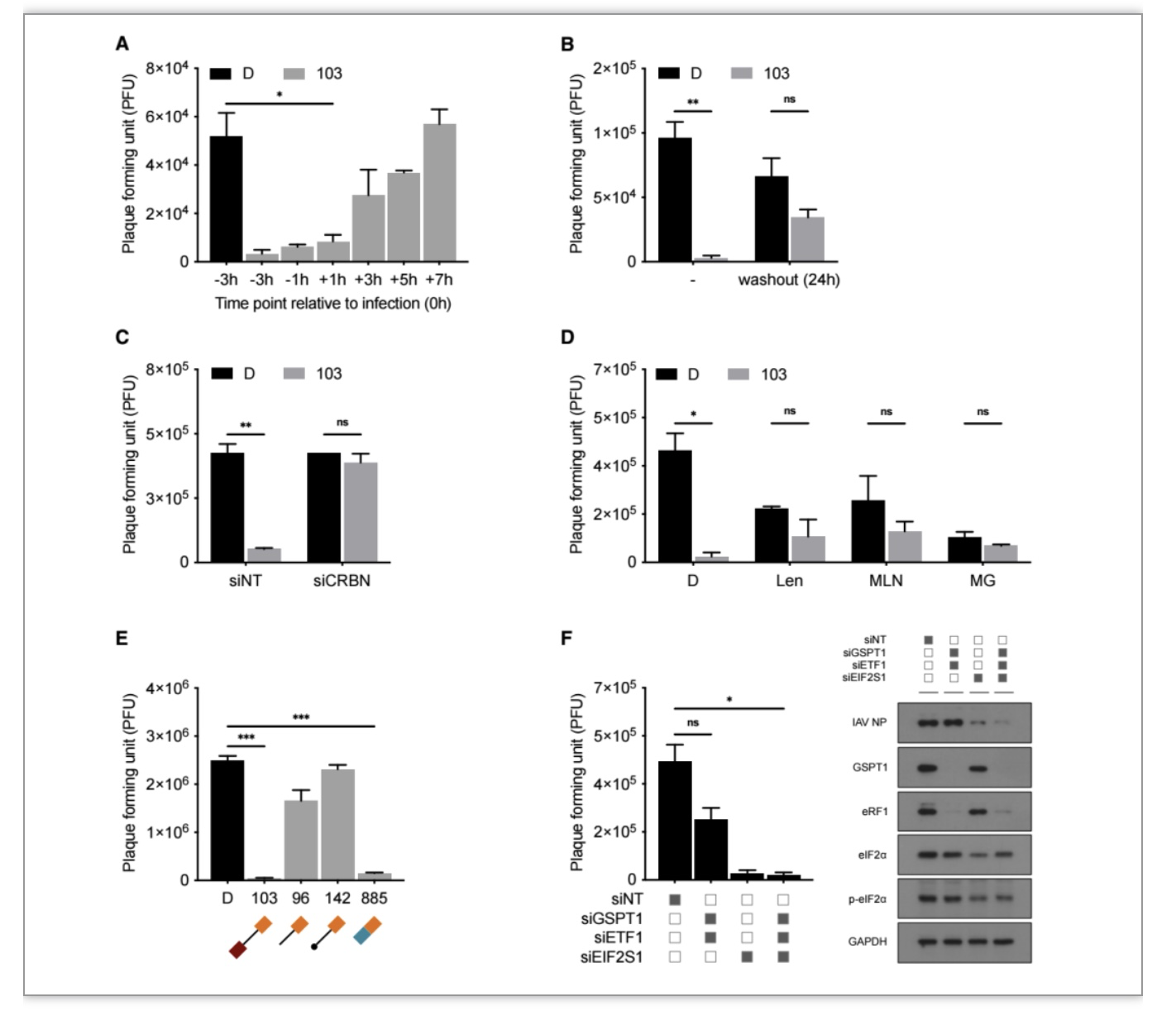
图3 化合物103的抗流感病毒活性与其诱导GSPT1降解相关
研究者进一步在人多能干细胞(hPSCs)衍生的肺上皮细胞以及三维肺类器官中验证了103的抗流感病毒活性,且证明分子机制与103降解GSPT1和下调 eIF2α相关(图4)。
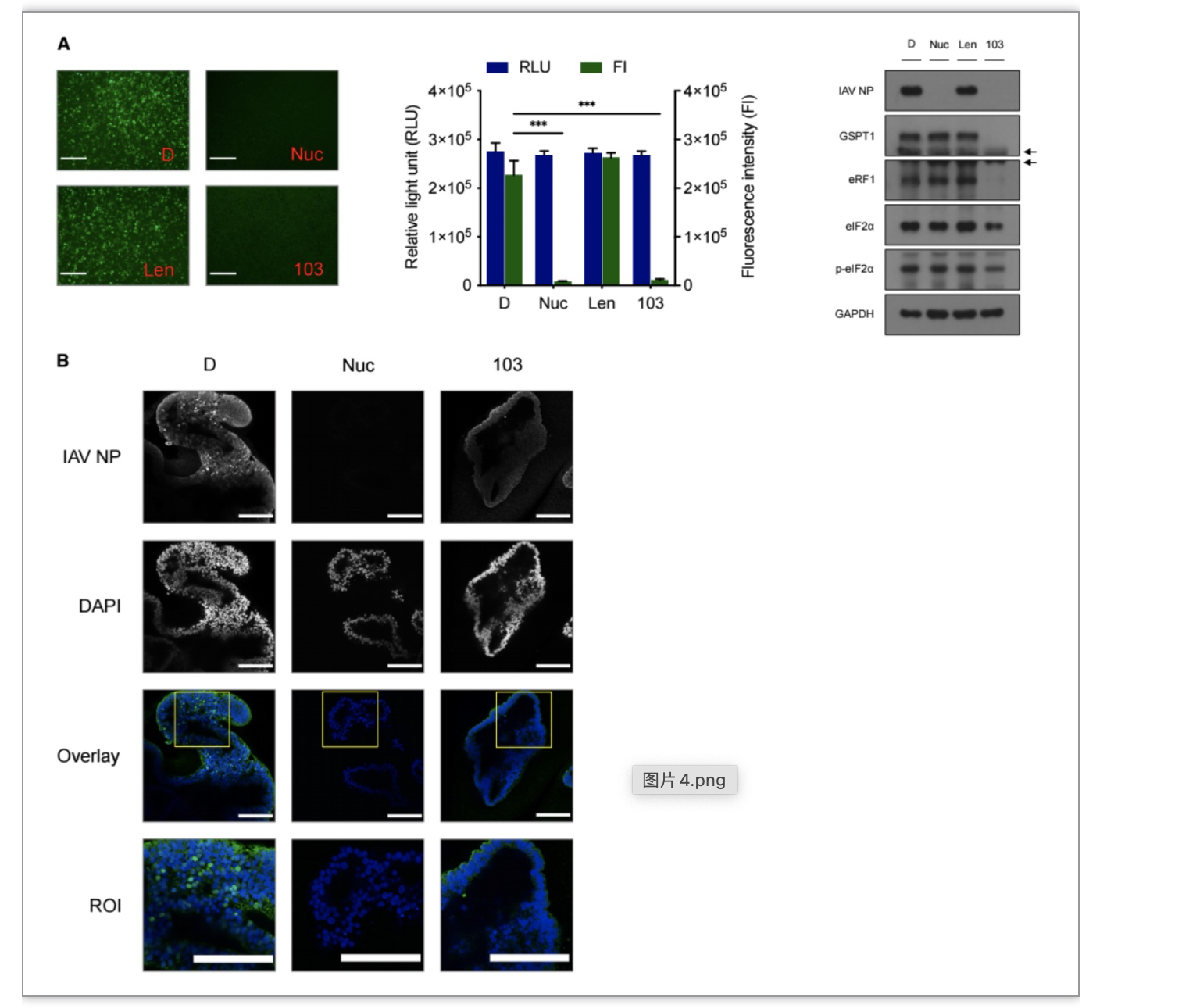
图4 化合物103抑制流感病毒在三维肺类器官内复制
鉴于GSPT1和elF2α在调节病毒蛋白翻译终止和翻译起始中的核心作用,研究者继续预测103可以阻碍不同门类的病毒在人体细胞中的复制并证实了这一猜想。103分别展示了抗严重急性呼吸系统综合征冠状病毒2和抗巨细胞病毒的活性。103的广谱抗病毒活性与其降解GSPT1和下调elF2α/诱导elF2α磷酸化的相关性也再次得以验证(由于篇幅限制,详细结果见原文中图5与图6)。
除了利用小分子,研究者还创新性地将流感病毒RNA基因组末端的非编码区域(UTR)作为配体引入至蛋白水解靶向嵌合体的设计中,希望能够获得一款特异性的抗流感病毒药物。由于UTR序列在流感病毒进化过程中的突变率极低且与流感病毒聚合酶(vPOL)保持极强的亲和力,因此,研究者大胆推测UTR序列可以用于设计广谱抗流感病毒的新型蛋白水解靶向嵌合体(Destroyer)。研究者随后首先设计了4个包含UTR序列特征的RNA寡聚核苷酸,并利用蛋白-蛋白相互作用实验证实,4个RNA寡聚核苷酸(RNA1-4)都能够结合vPOL。在此基础上,RNA3和RNA4被选定用于构建蛋白水解靶向嵌合体(AHPC-RNA3和AHPC-RNA4)。初步抗流感病毒活性评估结果显示AHPC-RNA3和AHPC-RNA4均能在一定程度上抑制流感病毒在HEK293T细胞内的复制,并且该抗流感病毒活性是通过泛素-蛋白酶体途径发挥作用的(图5)。

图5 Destroyer抑制流感病毒在人体细胞内复制

